Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
16 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
269.00 kB
Просмотров:
32
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Анод + Катод = Электролиз
Выполнил:
ученик 11М класса
МОУ лицея №6
Аббязов Эрик
№2 слайд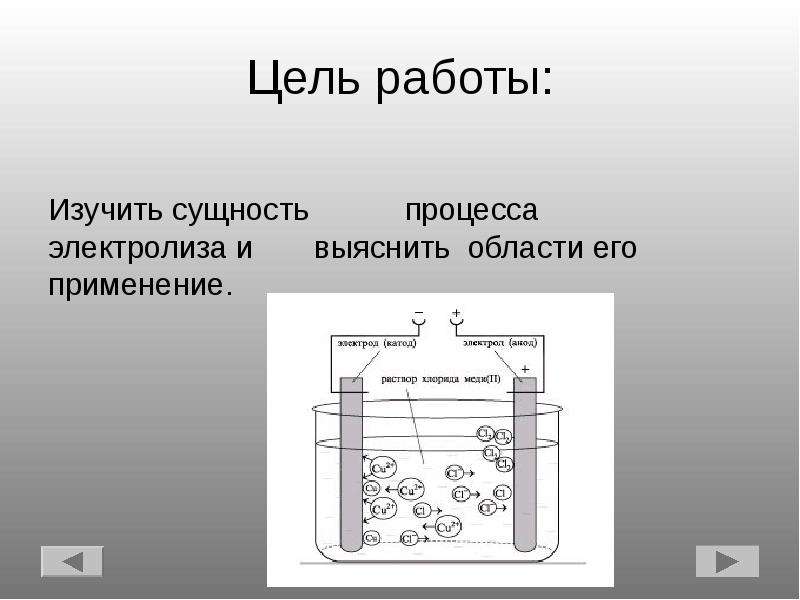
Содержание слайда: Цель работы:
Изучить сущность процесса электролиза и выяснить области его применение.
№3 слайд
№4 слайд
Содержание слайда: Электролиз расплава
Если расплавить поваренную соль, то произойдет расщепление кристаллической решетки на ионы. При этом образуются катионы натрия и анионы хлора:
NaCI -> Na+ + CI-
Опустим в расплав электроды постоянного электрического тока.
Направляясь к катоду, катион натрия получает с него один электрон, т.е. происходит восстановление:
Na+ + ē -> Na0
Катод, на котором имеется постоянный избыток электронов, является восстановителем.
К аноду направляется анион хлора. Поскольку на аноде постоянный недостаток электронов, ион хлора отдает электрон, превращаясь в нейтральный атом, т.е. окисляется:
Cl- - ē -> Cl0
Анод, на котором постоянный недостаток электронов, является окислителем.
2NaCl -> 2 Na + Cl2
ЭЛЕКТРОЛИЗ – окислительно-восстановительный процесс, протекающий под действием электрического тока.
№5 слайд
№6 слайд
Содержание слайда: Электролиз раствора
В водных растворах процесс приобретает ряд особенностей, так как в нем принимает участие вода.
В растворе, помимо диссоциации соли, происходит весьма слабая диссоциация воды.
NaCI -> Na+ + CI-
H2O -> H+ + OH-
Таким образом, в растворе образуется два вида катионов (Na+ и H+) и два вида анионов (CI- и OH-).
В ряду напряжений металлов натрий стоит намного левее водорода. Следовательно, восстановительные свойства атома натрия сильнее, чем атома водорода. Зато окислительные свойства иона Na+ выражены слабее, чем иона H+ , следовательно, на катоде будет восстанавливаться не металлический натрий, а водород:
2H2O + 2ē -> H2 + 2OH-
Ионы натрия будут находиться в растворе до тех пор, пока полностью не разрядятся ионы водорода.
К аноду направятся анионы CI- и OH-, восстановительные свойства которых также неодинаковы (см. ряд анионов, расположенных в порядке увеличения способности к окислению). Анионы CI- окисляются легче, чем OH-, поэтому на аноде будет происходить процесс:
CI- - ē → CI0
№7 слайд
Содержание слайда: Электролиз раствора
К аноду направятся анионы CI- и OH-, восстановительные свойства которых также неодинаковы (см. ряд анионов, расположенных в порядке увеличения способности к окислению). Анионы CI- окисляются легче, чем OH-, поэтому на аноде будет происходить процесс:
CI- - ē CI0, 2CI0 CI2
В большинстве случаев анионы, состоящие из атомов одного элемента, такие, как CI-, Br-, I-, S2-, окисляются на аноде быстрее, чем гидроксид-ион.
При электролизе раствора поваренной соли на электродах получаются водород и хлор, а в растворе остаются ионы Na+ и OH-. Эти ионы представляют собой в диссоциированном виде едкий натр NaOH.Таким способом в промышленности получают едкие щелочи.
2NaCl + 2H2O H2 + Cl2 + 2NaOH
№8 слайд
№9 слайд
Содержание слайда: Примеры электролиза растворов солей:
Примеры электролиза растворов солей:
№10 слайд
№11 слайд
№12 слайд
№13 слайд
Содержание слайда: Применение электролиза
№14 слайд
№15 слайд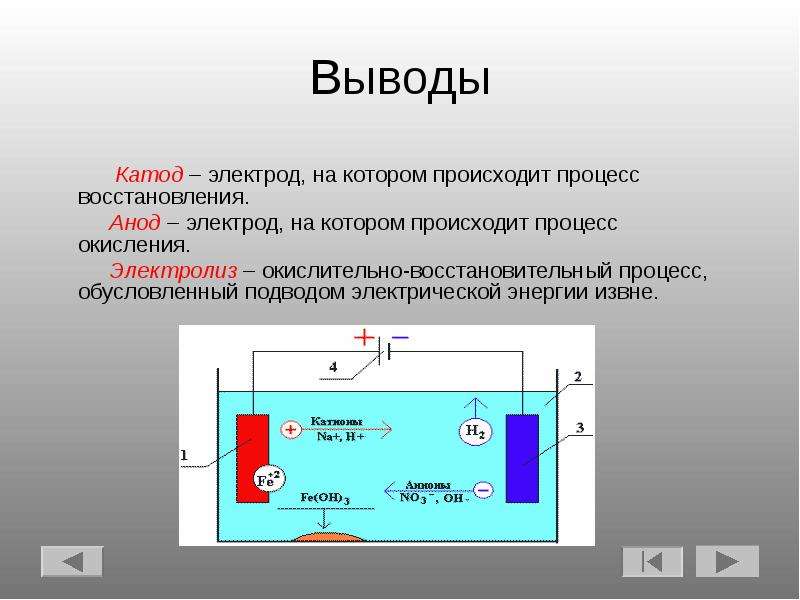
Содержание слайда: Выводы
Катод – электрод, на котором происходит процесс восстановления.
Анод – электрод, на котором происходит процесс окисления.
Электролиз – окислительно-восстановительный процесс, обусловленный подводом электрической энергии извне.
№16 слайд

























