Презентация Электронные эффекты заместителей. Типы химических реакций онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Электронные эффекты заместителей. Типы химических реакций абсолютно бесплатно. Урок-презентация на эту тему содержит всего 65 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Электронные эффекты заместителей. Типы химических реакций
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:65 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:1.90 MB
- Просмотров:76
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№3 слайд
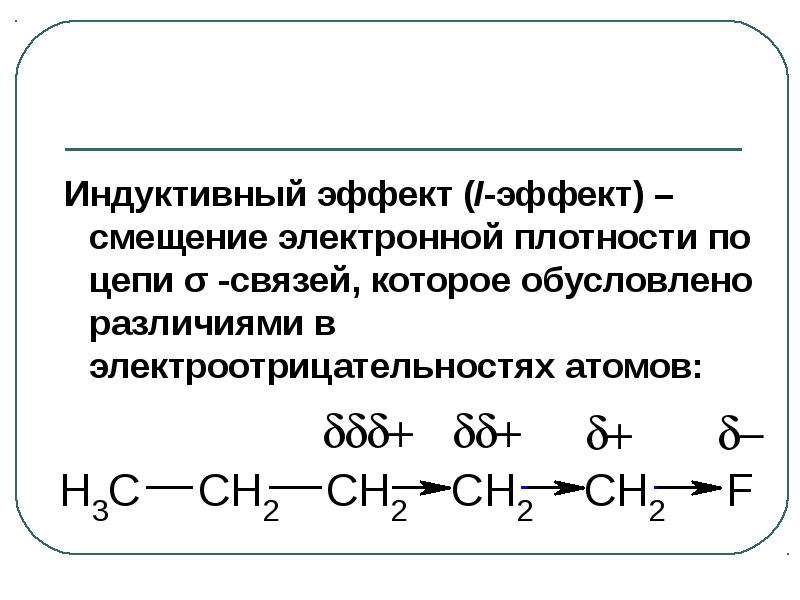

Содержание слайда: Индуктивный эффект (I-эффект) – смещение электронной плотности по цепи σ -связей, которое обусловлено различиями в электроотрицательностях атомов:
Индуктивный эффект (I-эффект) – смещение электронной плотности по цепи σ -связей, которое обусловлено различиями в электроотрицательностях атомов:
№4 слайд


Содержание слайда: Индуктивный эффект обозначают буквой I и графически изображают стрелкой, остриё которой направлено в сторону более ЭО элемента.
Индуктивный эффект обозначают буквой I и графически изображают стрелкой, остриё которой направлено в сторону более ЭО элемента.
Действие индуктивного эффекта наиболее сильно проявляется на двух ближайших атомах углерода, а через 3-4 связи он затухает.
№5 слайд


Содержание слайда: –I эффект проявляют заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др.
–I эффект проявляют заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др.
Это электроноакцепторные заместители (ЭА). Они снижают электронную плотность в углеродной цепи.
№6 слайд


Содержание слайда: +I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: металлы (-Mg, -Li); насыщенные углеводородные радикалы (-CH3, -C2H5) и т.п.
+I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: металлы (-Mg, -Li); насыщенные углеводородные радикалы (-CH3, -C2H5) и т.п.
Это электронодонорные (ЭД) заместители. Они повышают электронную плотность в углеродной цепи.
№7 слайд


Содержание слайда: Мезомерный эффект – смещение электронной плотности по цепи сопряженных -связей. Возникает только при наличии сопряжения связей.
Мезомерный эффект – смещение электронной плотности по цепи сопряженных -связей. Возникает только при наличии сопряжения связей.
Действие мезомерного эффекта заместителей проявляется как в открытых, так и замкнутых системах.
№8 слайд


Содержание слайда: - М-эффект проявляют заместители, понижающие электронную плотность в сопряженной системе. Заместители содержат кратные связи: -CHO, -COOH, -NO2, -SO3H, -CN).
- М-эффект проявляют заместители, понижающие электронную плотность в сопряженной системе. Заместители содержат кратные связи: -CHO, -COOH, -NO2, -SO3H, -CN).
Это электроноакцепторные (ЭА) заместители.
№9 слайд


Содержание слайда: +М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся -OH, -NH2, -OCH3, -O-, -F, -Cl, -Br, -I и др.
+М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся -OH, -NH2, -OCH3, -O-, -F, -Cl, -Br, -I и др.
Это электронодонорные заместители (ЭД).
№11 слайд
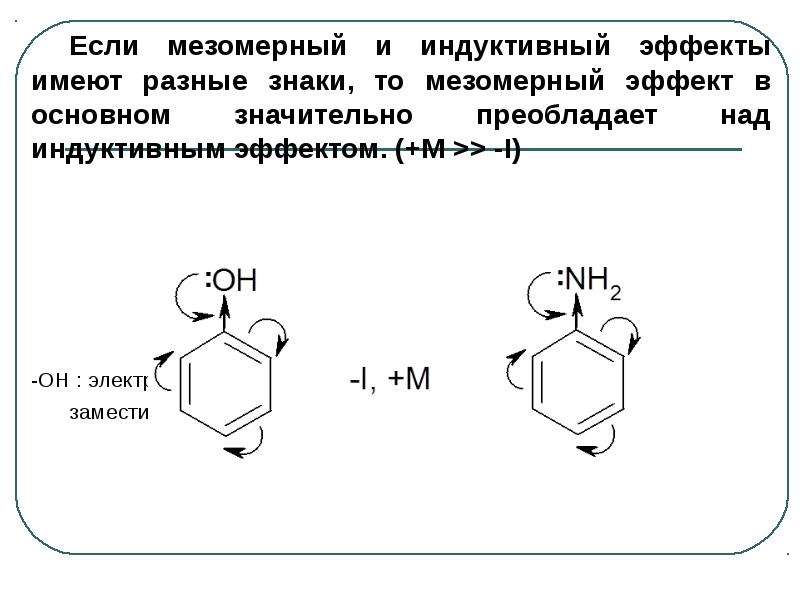

Содержание слайда: Если мезомерный и индуктивный эффекты имеют разные знаки, то мезомерный эффект в основном значительно преобладает над индуктивным эффектом. (+M >> -I)
Если мезомерный и индуктивный эффекты имеют разные знаки, то мезомерный эффект в основном значительно преобладает над индуктивным эффектом. (+M >> -I)
-ОН : электронодонорный -NH2: электронодонорный
заместитель заместитель
№29 слайд


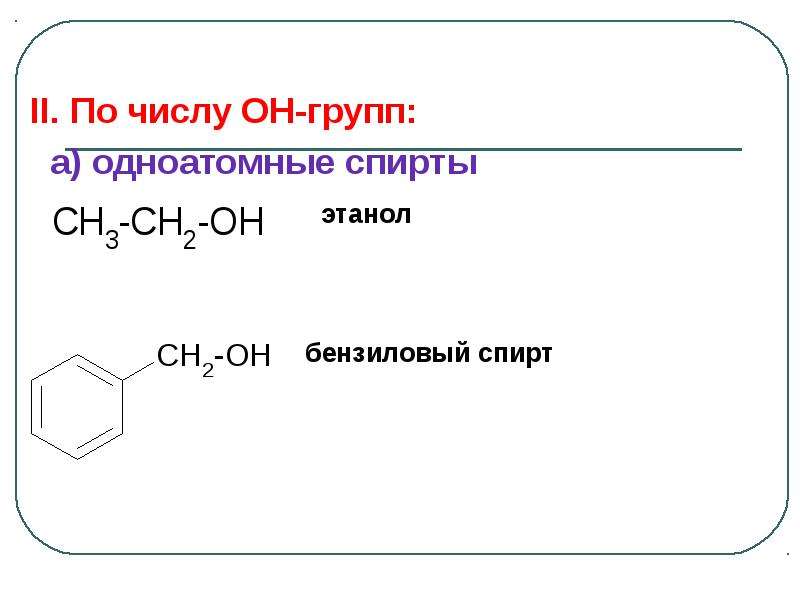
Содержание слайда: Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол смешиваются с водой во всех отношениях.
Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол смешиваются с водой во всех отношениях.
С увеличением количества атомов углерода растворимость уменьшается.
Растворимость амилового спирта (пентанола-1) – 2,7 г/ 100 мл, растворимость октанола-1 – 0,059 г/ 100 мл.
№32 слайд
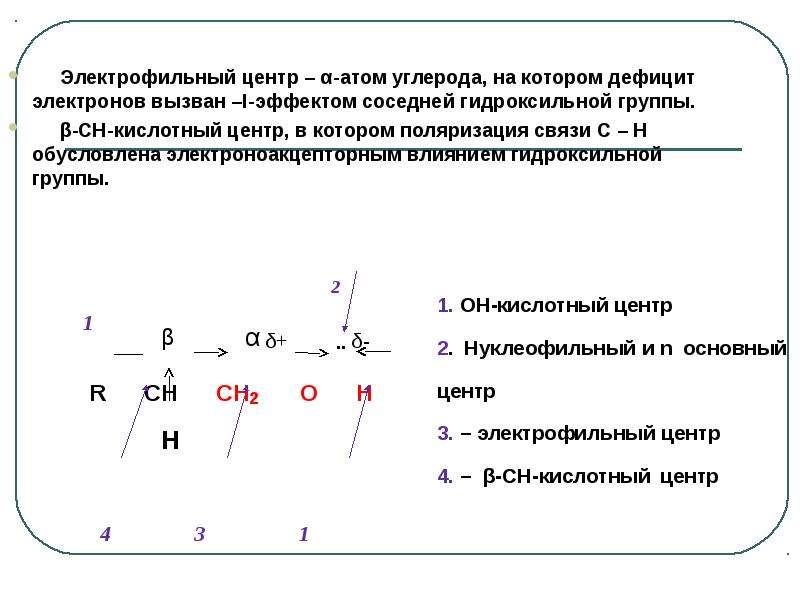

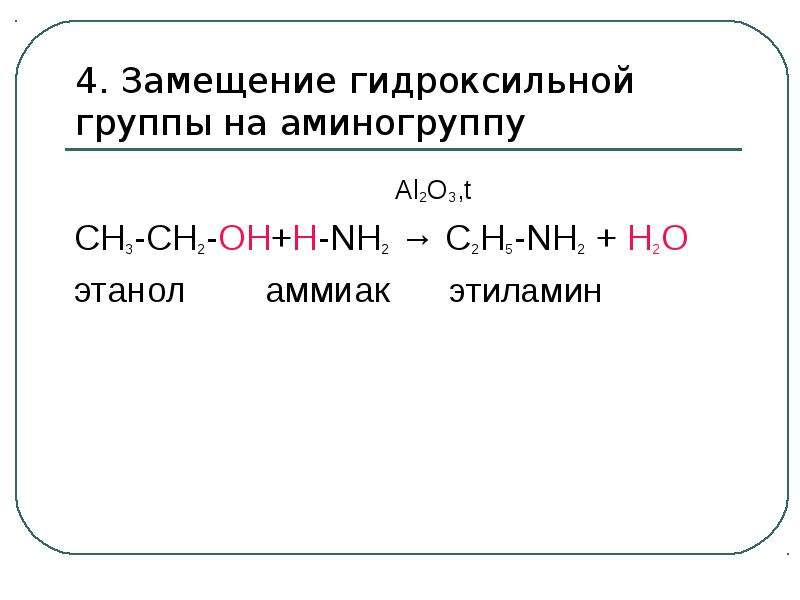
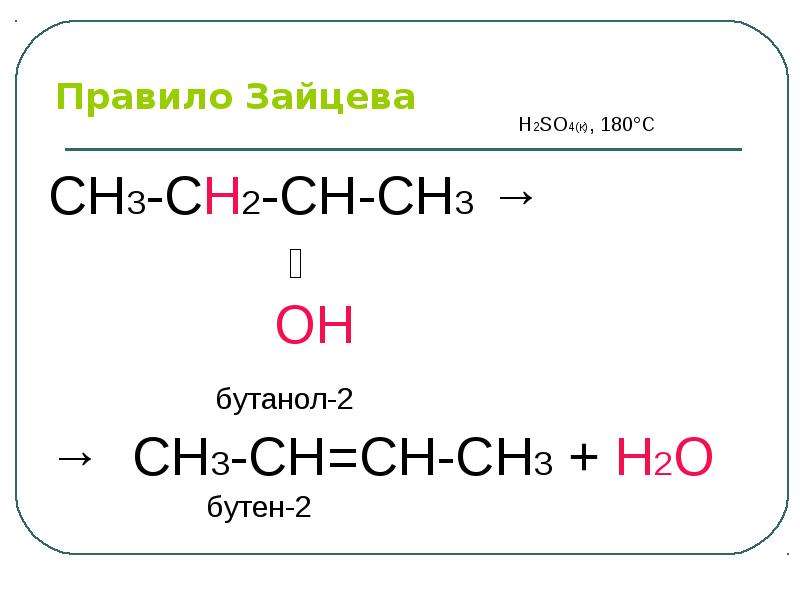
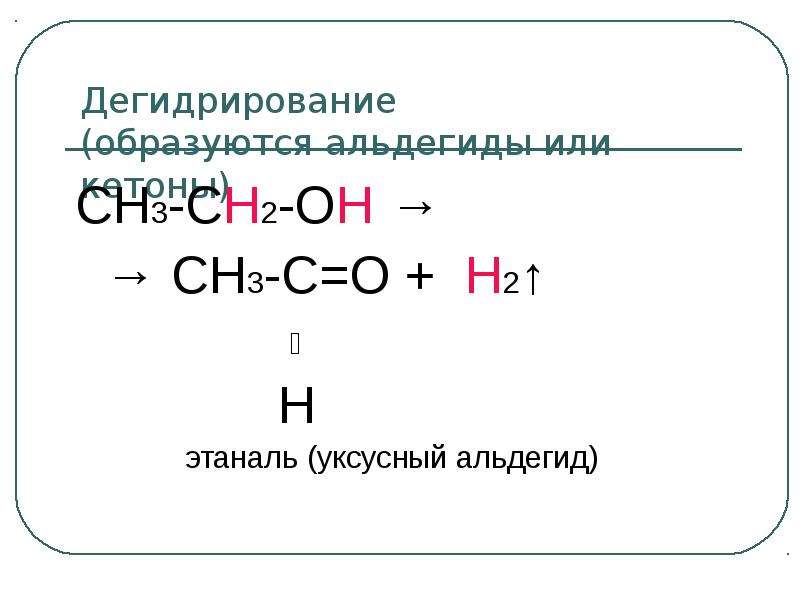
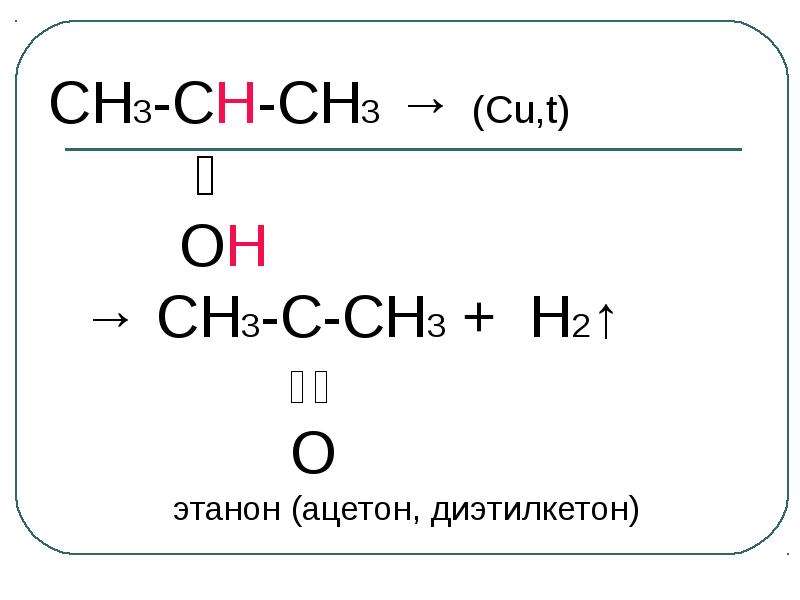
Содержание слайда: Электрофильный центр – α-атом углерода, на котором дефицит электронов вызван –I-эффектом соседней гидроксильной группы.
Электрофильный центр – α-атом углерода, на котором дефицит электронов вызван –I-эффектом соседней гидроксильной группы.
β-CH-кислотный центр, в котором поляризация связи C – H обусловлена электроноакцепторным влиянием гидроксильной группы.
№48 слайд


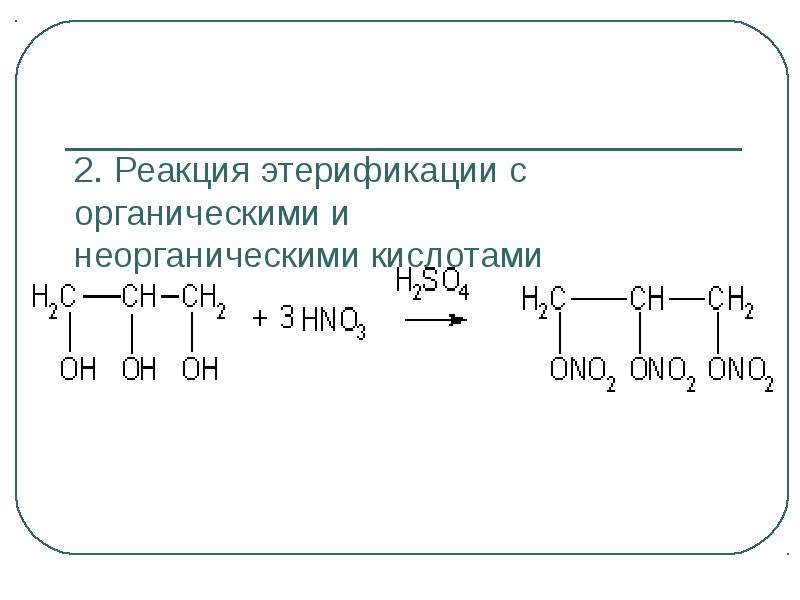
Содержание слайда: Многоатомные спирты
Присутствие в молекулах многоатомных
спиртов двух и более гидроксильных
групп обуславливает некоторые отличия
в их свойствах по сравнению с
одноатомными спиртами:
- гликоли и другие многоатомные
спирты реагируют со щелочами , образуя соли по одной из гидроксильных групп;
- многоатомные спирты взаимодействуют с
гидроксидом меди (II)
№63 слайд


Содержание слайда: 4. Реакции присоединения (гидрирование) с образованием алициклических спиртов (циклогексанол)
4. Реакции присоединения (гидрирование) с образованием алициклических спиртов (циклогексанол)
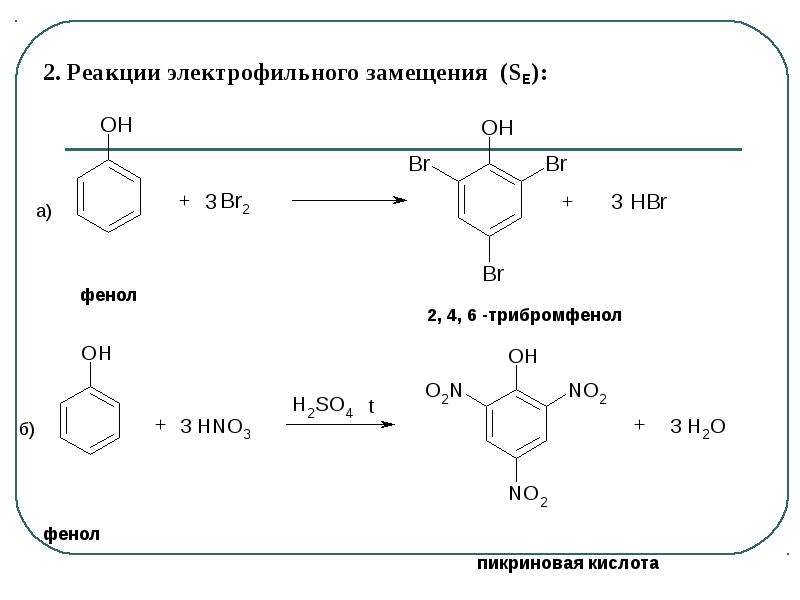
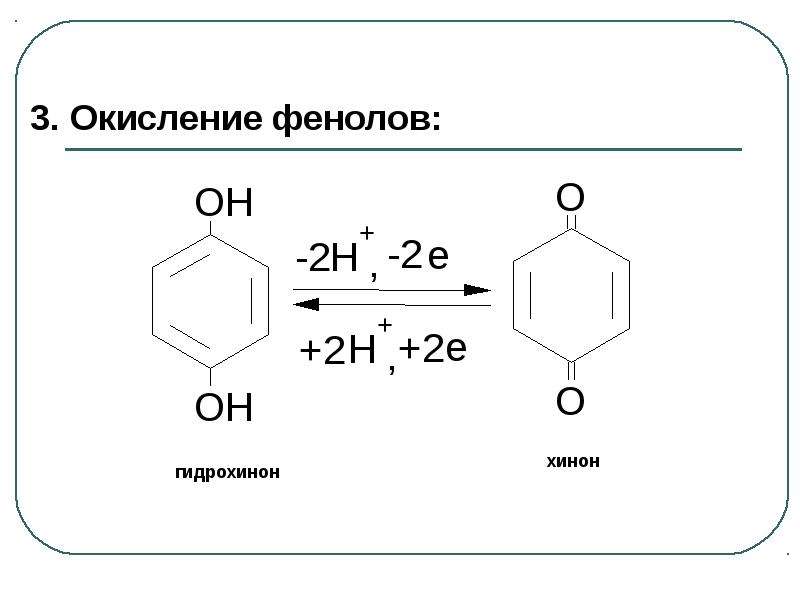
5. Качественная реакция с хлоридом железа (III):
Одноатомные фенолы + хлорид железа → сине-фиолетовая окраска, исчезающая при подкислении
Многоатомные фенолы + хлорид железа → окраска различных оттенков
Скачать все slide презентации Электронные эффекты заместителей. Типы химических реакций одним архивом:
Похожие презентации
-
 Основы строения и реакционной способности органических соединений. Сопряжение. Ароматичность. Электронные эффекты заместителей
Основы строения и реакционной способности органических соединений. Сопряжение. Ароматичность. Электронные эффекты заместителей -
 Урок химии на тему: «Типы химических реакций»
Урок химии на тему: «Типы химических реакций» -
 Сущность химических реакций и признаки их протекания. Тепловой эффект реакции.
Сущность химических реакций и признаки их протекания. Тепловой эффект реакции. -
 Тепловой эффект химических реакций 8 класс
Тепловой эффект химических реакций 8 класс -
 Типы химических реакций
Типы химических реакций -
 По Химии "строение спиртов, характерные типы химических реакци" - скачать смотреть
По Химии "строение спиртов, характерные типы химических реакци" - скачать смотреть -
 Типы химических реакций на примере свойств воды Автор: учитель химии, МКОУ «Касторенская СОШ 1», п. г. т. Касторн
Типы химических реакций на примере свойств воды Автор: учитель химии, МКОУ «Касторенская СОШ 1», п. г. т. Касторн -
 Типы химических реакций на примере свойств воды.
Типы химических реакций на примере свойств воды. -
 Типы химических реакций Карпухина Ирина Степановна Учитель химии МБОУ СОШ 32 Город Новосибирск
Типы химических реакций Карпухина Ирина Степановна Учитель химии МБОУ СОШ 32 Город Новосибирск -
 Урок химии на тему: «Типы химических реакций»
Урок химии на тему: «Типы химических реакций»