Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
73 слайда
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
0.98 MB
Просмотров:
95
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Основы органической химии
Кислородсодержащие органические соединения
№2 слайд
Содержание слайда: Кислородсодержащие органические соединения
известно большое число органических соединений, в состав которых наряду с углеродом и водородом входит кислород.
атом кислорода содержится в различных функциональных группах, определяющих принадлежность соединения к определенному классу.
№3 слайд
Содержание слайда: Основные кислородсодержащие соединения
№4 слайд
Содержание слайда: Функциональные группы
HO–R–CHO - гидроксиальдегиды
HO–R–CO–R’ - гидроксикетоны
HO–R–COOH - гидроксикислоты
ROR’ - простые эфиры
RCOOR’ - сложные эфиры
RCONH2 - амиды
(RCO)2O - ангидриды
RCOCl - хлорангидриды
№5 слайд
Содержание слайда: Строение кислорода
Кислород – элемент VI А группы 2-го периода периодической системы; порядковый номер 8; атомная масса 16; электроотрицательность 3,5.
Электронная конфигурация в основном состоянии 1s22s22p4:
№6 слайд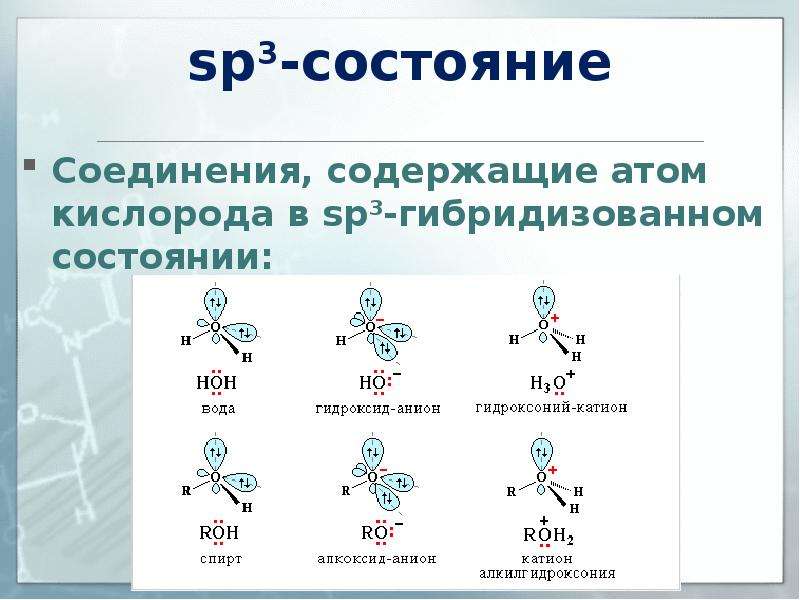
Содержание слайда: sp3-состояние
Соединения, содержащие атом кислорода в sp3-гибридизованном состоянии:
№7 слайд
Содержание слайда: sp2-состояние
sp2-Гибридизованный атом кислорода присутствует в соединениях с карбонильной группой С=О
№8 слайд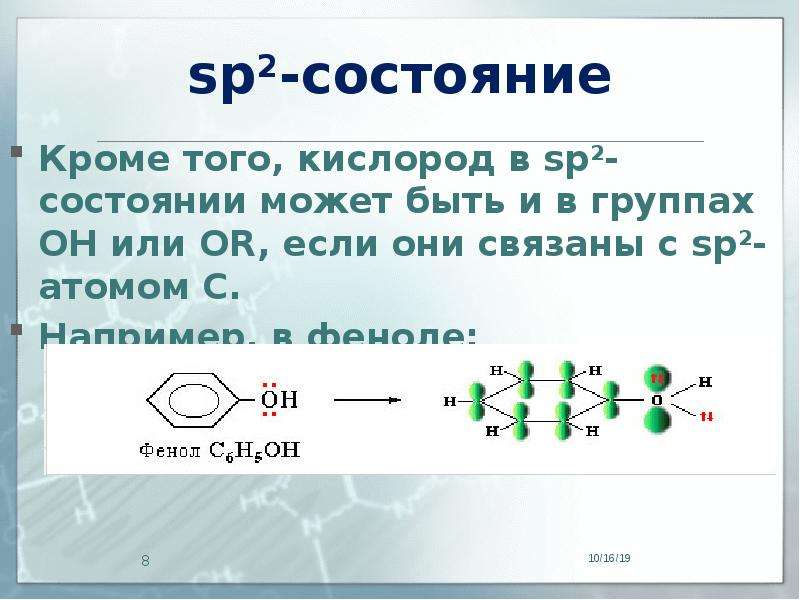
Содержание слайда: sp2-состояние
Кроме того, кислород в sp2-состоянии может быть и в группах ОН или ОR, если они связаны с sp2-атомом С.
Например, в феноле:
№9 слайд
Содержание слайда: Гидроксисоединения
вещества, содержащие одну или более гидроксильных групп –ОН, связанных с углеводородным радикалом:
спирты R–OH
фенолы Ar–OH
R – алкил (алифатический радикал);
Ar – арил (ароматический радикал, радикал фенил -C6H5)
№10 слайд
Содержание слайда: Спирты
Спирты - соединения алифатического ряда, содержащие одну или несколько гидроксильных групп.
Общая формула спиртов с одной гидроксигруппой R–OH.
№11 слайд
Содержание слайда: Классификация спиртов
1.По числу гидроксильных групп спирты подразделяются на
одноатомные (одна группа -ОН),
многоатомные (две и более групп -ОН).
Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д):
двухатомный спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
№12 слайд
Содержание слайда: Классификация спиртов
2.В зависимости от того, с каким атомом углерода связана гидроксигруппа, различают спирты
первичные R–CH2–OH,
вторичные R2CH–OH,
третичные R3C–OH.
№13 слайд
Содержание слайда: Классификация спиртов
3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на:
предельные, или алканолы (СH3CH2–OH)
непредельные, или алкенолы (CH2=CH–CH2–OH)
ароматические (C6H5CH2–OH).
№14 слайд
Содержание слайда: Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо):
№15 слайд
Содержание слайда: Номенклатура спиртов
Нумерация ведется от ближайшего к ОН-группе конца цепи:
№16 слайд
Содержание слайда: Номенклатура спиртов
В многоатомных спиртах положение и число ОН-групп указывают суффиксами диол, триол и цифрами:
№17 слайд
Содержание слайда: Номенклатура спиртов
Радикально-функциональная номенклатура ИЮПАК, наличие функциональной группы отражают не суффиксом, а названием соответствующего класса соединений:
C2H5OH - этиловый спирт;
C2H5Cl - этилхлорид;
CH3–O–C2H5 - метилэтиловый эфир;
CH3–CO–CH=CH2 – метилвинилкетон.
№18 слайд
Содержание слайда: Номенклатура спиртов
Названия спиртов производят от названий радикалов с добавления слова спирт:
№19 слайд
Содержание слайда: Назовите следующие спирты:
CH3—OH
CH3—CH2— OH
CH3—CH2—CH2—OH
CH3—CH2—CH2—CH2—OH
CH3—CH2—CH2—CH2—CH2—OH
CH3—CH2—CH2—CH2—CH2—CH2—OH
№20 слайд
Содержание слайда: Структурная изомерия спиртов
№21 слайд
Содержание слайда: Структурная изомерия спиртов
№22 слайд
Содержание слайда: Структурная изомерия спиртов
№23 слайд
Содержание слайда: Пространственная изомерия
Для спиртов с асиметрическим атомом характерна оптическая изомерия:
№24 слайд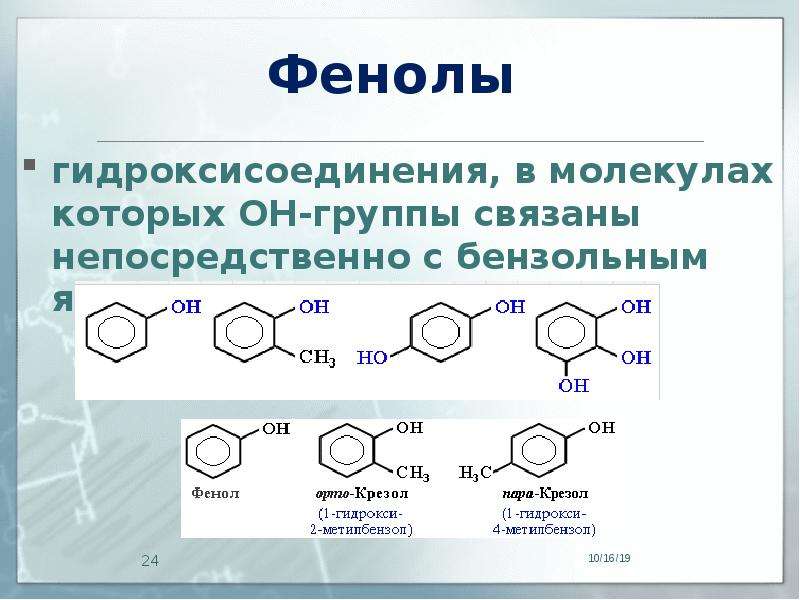
Содержание слайда: Фенолы
гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром:
№25 слайд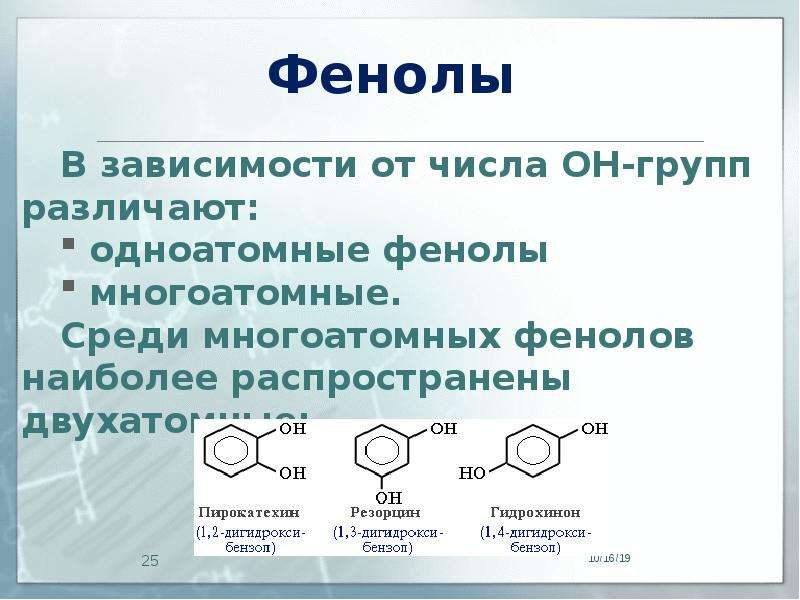
Содержание слайда: Фенолы
В зависимости от числа ОН-групп различают:
одноатомные фенолы
многоатомные.
Среди многоатомных фенолов наиболее распространены двухатомные:
№26 слайд
Содержание слайда: Номенклатура фенолов
Одноатомные фенолы называются как производные от первого вещества этого ряда - фенола:
№27 слайд
Содержание слайда: Номенклатура фенолов
В названиях монозамещённых фенолов применяют приставки – орто, мета, пара, а сами фенолы называют крезолами:
№28 слайд
Содержание слайда: Номенклатура фенолов
Для большинства многоатомных фенолов сохраняются тривиальные названия:
№29 слайд
Содержание слайда: Структурная изомерия фенолов
№30 слайд
Содержание слайда: Структурная изомерия фенолов
№31 слайд
Содержание слайда: Химические свойства спиртов
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей:
№32 слайд
Содержание слайда: Химические свойства спиртов
Поэтому даже низшие спирты - жидкости с относительно высокой температурой кипения
При переходе от одноатомных к многоатомным спиртам или фенолам температуры кипения и плавления резко возрастают:
№33 слайд
Содержание слайда: Химические свойства спиртов
В химических реакциях возможно разрушение:
С–ОН с отщеплением ОН-группы
О–Н с отщеплением водорода.
Это могут быть реакции замещения, или реакция отщепления (элиминирования),
Полярный характер связей С–О и О–Н способствует протеканию реакций по ионному механизму.
№34 слайд
Содержание слайда: Химические свойства спиртов
При разрыве связи О–Н с отщеплением протона Н+ проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О - свойства основания и нуклеофильного реагента:
№35 слайд
Содержание слайда: Химические свойства спиртов
К наиболее характерным реакциям с разрывом связи О–Н, относятся:
реакции замещения атома водорода на металл (кислотные свойства);
реакции замещения атома водорода на остаток кислоты (образование сложных эфиров);
реакции отщепления водорода при окислении и дегидрировании.
№36 слайд
Содержание слайда: Химические свойства спиртов
Легкость этих реакций и строение образующихся продуктов зависят от строения углеводородного радикала и взаимного влияния атомов.
Реакционная способность одноатомных спиртов в реакциях по связи О–Н:
CH3OH > первичные > вторичные > третичные.
№37 слайд
Содержание слайда: Химические свойства фенолов
Фенолы в большинстве реакциий по связи О-Н активнее спиртов,
эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе π-сопряжения).
№38 слайд
Содержание слайда: Химические свойства спиртов
Одноатомные спирты реагируют с активными металлами (Na, K,Mg, Al), образуя соли - алкоголяты (алкоксиды):
2R–OH + 2Na → 2RO–Na+ + H2
2C2H5OH + 2K → 2C2H5O–K+ + H2
№39 слайд
Содержание слайда: Химические свойства спиртов
Алкоголяты под действием воды полностью гидролизуются :
C2H5OК + H2O → C2H5OH + КOH
Спирты – более слабые кислоты, чем вода, поэтому при взаимодействии спиртов со щелочами алкоголяты практически не образуются.
№40 слайд
Содержание слайда: Химические свойства спиртов
Многоатомные спирты (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты.
Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов.
№41 слайд
Содержание слайда: Химические свойства спиртов
Многоатомные спирты, в отличие от одноатомных, взаимодействуют с раствором гидроксида меди (II), образуя комплексные соединения, окрашивающие раствор в ярко-синий цвет (качественная реакция):
№42 слайд
Содержание слайда: Химические свойства фенолов
Фенолы являются более сильными кислотами, чем спирты и вода.
Фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты:.
№43 слайд
Содержание слайда: Образование сложных эфиров
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры.
Реакция обратима (обратный процесс – гидролиз сложных эфиров):
№44 слайд
Содержание слайда: Образование сложных эфиров
Название сложного эфира образуется от углеводородного радикала:
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
№45 слайд
Содержание слайда: Химические свойства фенолов
Фенолы не образуют сложные эфиры в реакциях с кислотами.
Для этого используются более реакционноспособные производные кислот (ангидриды, хлорангидриды):
№46 слайд
Содержание слайда: Простые эфиры
Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R'–O–R", где R' и R" - различные или одинаковые радикалы.
№47 слайд
Содержание слайда: Простые эфиры
Простые эфиры рассматриваются как производные спиртов.
Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова "эфир":
CH3OCH3 - диметиловый эфир;
C2H5OCH3 - метилэтиловый эфир.
№48 слайд
Содержание слайда: Простые эфиры
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы).
№49 слайд
Содержание слайда: Простые эфиры
Эфиры несимметричного строения R–O–R' образуются при взаимодействии галогеноуглеводорода и алкоголята (синтез Вильямсона):
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (CH3O–).
№50 слайд
Содержание слайда: Простые эфиры
Простые эфиры получают также присоединением спиртов и фенолов к ненасыщенным углеводородам.
а) Присоединение к алкенам:
№51 слайд
Содержание слайда: Простые эфиры
б) Присоединение к алкинам (образование виниловых эфиров):
Механизм реакции – нуклеофильное присоединение по тройной связи. Нуклеофил – феноксид-анион ArO– (или алкоксид-анион RO–), образующийся из фенола (или спирта) под действием щелочи.
№52 слайд
Содержание слайда: Получение спиртов и фенолов
I. Метанол получают из синтез-газа над катализаторами (оксид Zn, Cr,Al):
№53 слайд
Содержание слайда: Получение спиртов и фенолов
2. Этанол в промышленности получают несколькими способами:
а) ферментативное брожение глюкозы (пищевой спирт):
б) гидролиз древесины и последующее её сбраживание (гидролизный спирт)
в) гидратация этилена (синтетический спирт):
№54 слайд
Содержание слайда: Получение спиртов и фенолов
3. Гидратация алкенов: присоединение воды к несимметричным алкенам идет по правилу Марковникова с образованием вторичных и третичных спиртов:
№55 слайд
Содержание слайда: Получение спиртов и фенолов
4. Щелочной гидролиз галогеноуглеводородов:
№56 слайд
Содержание слайда: Получение спиртов и фенолов
5. Гликоли получают окислением алкенов щелочным раствором KMnO4 :
№57 слайд
Содержание слайда: Получение спиртов и фенолов
6. восстановление альдегидов и кетонов:
№58 слайд
Содержание слайда: Получение спиртов и фенолов
7. Кумольный способ получения фенола (СССР, 1949 г.).
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность:
№59 слайд
Содержание слайда: Получение спиртов и фенолов
8. фенолы и крезолы извлекают из каменноугольной смолы, которая образуется при получении кокса и полукокса для металлургической промышленности
№60 слайд
Содержание слайда: Применение спиртов
Метанол (метиловый спирт) CH3OH:
производство формальдегида
муравьиной кислоты;
растворитель.
№61 слайд
Содержание слайда: Применение спиртов
Этанол (этиловый спирт) С2Н5ОН:
производство ацетальдегида, уксусной кислоты, бутадиена, простых и сложных эфиров;
растворитель для красителей, лекарственных и парфюмерных средств;
производство ликеро-водочных изделий;
дезинфицирующее средство в медицине;
горючее для двигателей, добавка к моторным топливам
№62 слайд
Содержание слайда: Применение спиртов
Этиленгликоль HOCH2–CH2OH:
производство пластмасс;
компонент антифризов;
сырье в органическом синтезе
№63 слайд
Содержание слайда: Применение спиртов
Глицерин HOCH2–CH(OH)–CH2OH:
фармацевтическая и парфюмерная промышленность;
смягчитель кожи и тканей;
производство взрывчатых веществ
№64 слайд
Содержание слайда: Применение спиртов
Фенол C6H5OH:
производство фенолформальдегидных смол;
полупродукт в органическом синтезе
№65 слайд
Содержание слайда: 1.Контрольная работа
№66 слайд
Содержание слайда: 2. Контрольная работа
№67 слайд
Содержание слайда: 3.Контрольная работа
№68 слайд
Содержание слайда: 4. Контрольная работа
№69 слайд
Содержание слайда: 5. Контрольная работа
№70 слайд
Содержание слайда: 6. Контрольная работа
№71 слайд
Содержание слайда: 7. Контрольная работа
№72 слайд
Содержание слайда: Свойства спиртов
Взаимодействие спирта и натрия
Напищите уравнения реакций.
(видеоролик op3.exe в папке лабораторные опыты-кислородсодержащие соединения)
№73 слайд
Содержание слайда: Свойства спиртов
Образование глицерата меди.
Напишите уравнение реакции:
(видеоролик ор2.exe в папке лабораторные -опыты кислородсодержащие соединения)
















 По Химии "Основные классы Неорганических соединений" - скачать смотреть
По Химии "Основные классы Неорганических соединений" - скачать смотреть По химии Основные классы неорганических соединений
По химии Основные классы неорганических соединений По химии Общие закономерности реакционной способности органических соединений как химическая основа их биологическ
По химии Общие закономерности реакционной способности органических соединений как химическая основа их биологическ Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ 10 Ст. Новомыша
Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ 10 Ст. Новомыша Тема урока: «Генетическая связь между классами неорганических соединений » ГОУ СОШ 149 Учитель химии: Иванова Г. М.
Тема урока: «Генетическая связь между классами неорганических соединений » ГОУ СОШ 149 Учитель химии: Иванова Г. М. Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Арены. Бензол. Среди 22 миллионов органических соединений немного найдется таких , которые оказали на развитие органической химии
Арены. Бензол. Среди 22 миллионов органических соединений немного найдется таких , которые оказали на развитие органической химии Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени
Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А. М. БУТЛЕРОВА Становление органической химии. Предпосылки теории строения
ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А. М. БУТЛЕРОВА Становление органической химии. Предпосылки теории строения По Химии "Теория строения органических соединений" - скачать смотреть
По Химии "Теория строения органических соединений" - скачать смотреть































































