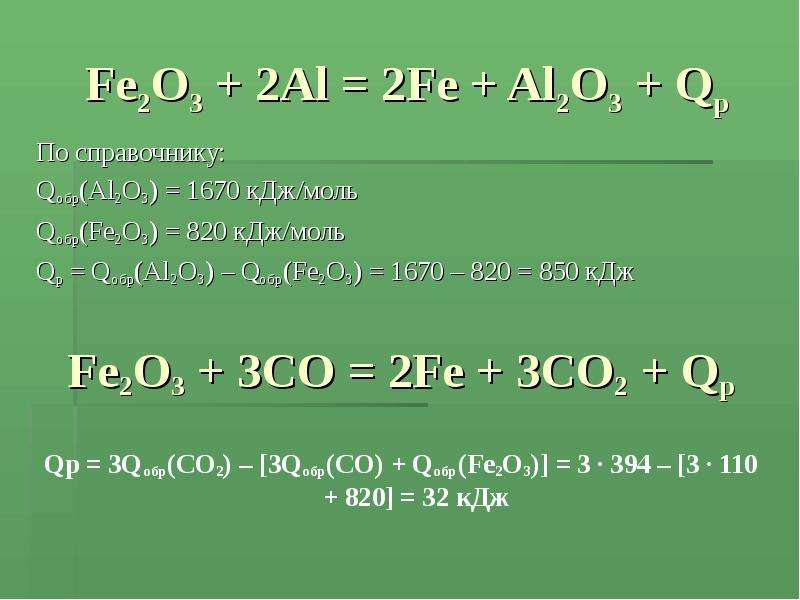Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
16 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
499.00 kB
Просмотров:
124
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Почему протекают химические реакции
Начала термодинамики
Автор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А.М.Горького г.Карачева Брянской обл.
№2 слайд
Содержание слайда: Первый закон термодинамики – закон сохранения энергии
Энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую
№3 слайд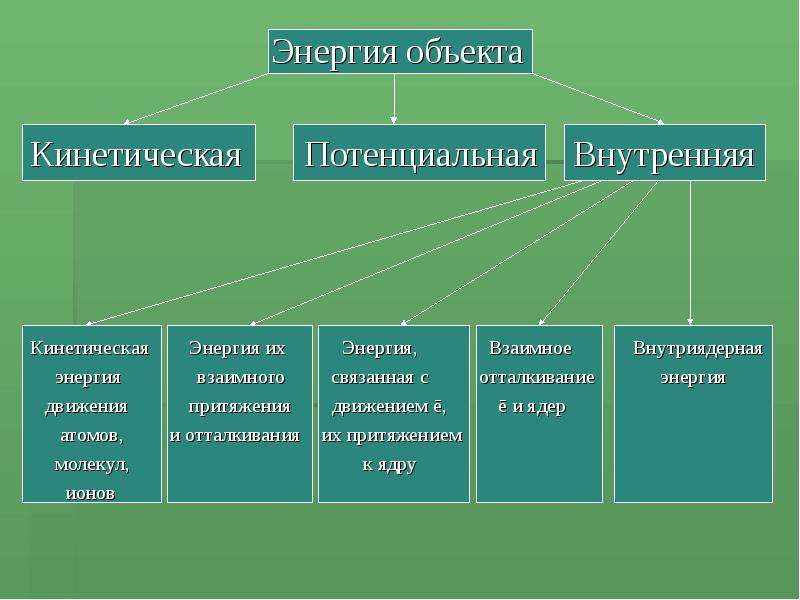
Содержание слайда: Энергия объекта
Энергия объекта
Кинетическая Потенциальная Внутренняя
Кинетическая Энергия их Энергия, Взаимное Внутриядерная
энергия взаимного связанная с отталкивание энергия
движения притяжения движением ē, ē и ядер
атомов, и отталкивания их притяжением
молекул, к ядру
ионов
№4 слайд
Содержание слайда: Е реагентов > Е продуктов
Е реагентов > Е продуктов
Энергия выделяется в окружающую среду
Реакции, при которых выделяется энергия и нагревается окружающая среда, называются экзотермическими.
№5 слайд
Содержание слайда: Е реагентов < Е продуктов
Е реагентов < Е продуктов
Энергия поглощается из окружающей среды, температура системы понижается
Реакции, при протекании которых энергия поглощается из окружающей среды, называется эндотермической.
№6 слайд
Содержание слайда: Энергия, которая выделяется или поглощается в химической реакции, называется тепловым эффектом реакции.
Тепловой эффект реакции
выражается в кДж и его относят к тем количествам веществ, которые определены уравнением.
Уравнение, в котором указан тепловой эффект реакции, называется термохимическим.
2H2 + O2 = 2H2O + 484 кДж
№7 слайд
Содержание слайда: Для расчета тепловых эффектов реакций используют значения величин теплот образования исходных веществ и продуктов реакции
Теплота образования соединения (Qобр) – это тепловой эффект реакции образования одного моля соединения из простых веществ, устойчивых в стандартных условиях (25°С, 1 атм)
При таких условиях теплота образования простых веществ равна 0.
C + O2 = CO2 + 394 кДж
теплоты образования
0,5N2 + 0,5O2 = NO – 90 кДж
№8 слайд
Содержание слайда: Закон Гесса (1840)
Тепловой эффект химической реакции не зависит от промежуточных стадий (при условии, что исходные вещества и продукты реакции одинаковы).
С + O2 → CO2 + 394 кДж/моль (Q1)
а) С + 0,5O2 → CO + ?(Q2)
б) CO + 0,5O2 → CO2 + 284 кДж/моль(Q3)
Q1 = Q2 + Q3
Q2 = Q1 – Q3 = 394 – 284 = 110 кДж
№9 слайд
Содержание слайда: Следствие из закона Гесса
Тепловой эффект химической реакции равен сумме теплот образования всех продуктов реакции минус сумма теплот образования всех реагентов (с учетом коэффициентов в уравнении реакции):
Qр = ΣQобр(продукты) – ΣQобр(реагенты)
№10 слайд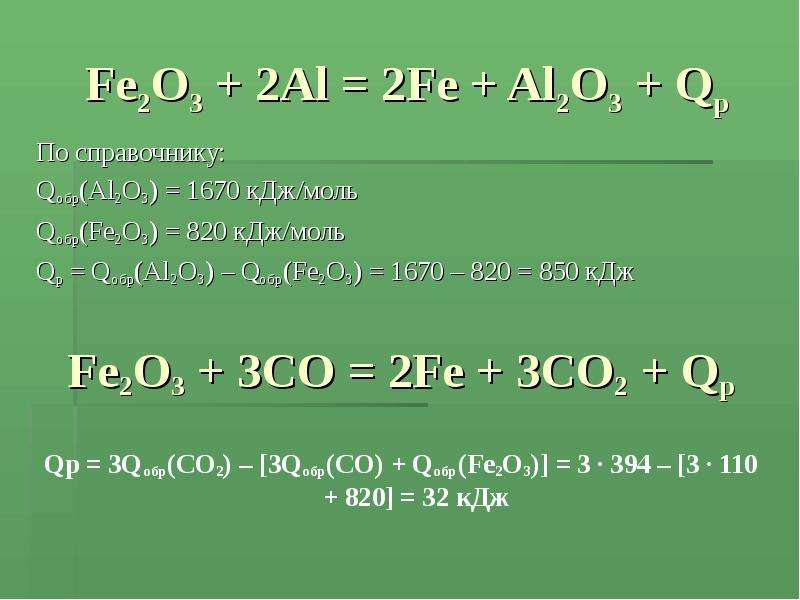
Содержание слайда: Fe2O3 + 2Al = 2Fe + Al2O3 + Qр
По справочнику:
Qобр(Al2O3) = 1670 кДж/моль
Qобр(Fe2O3) = 820 кДж/моль
Qр = Qобр(Al2O3) – Qобр(Fe2O3) = 1670 – 820 = 850 кДж
Fe2O3 + 3CO = 2Fe + 3CO2 + Qр
Qр = 3Qобр(CO2) – [3Qобр(CO) + Qобр(Fe2O3)] = 3 · 394 – [3 · 110 + 820] = 32 кДж
№11 слайд
Содержание слайда: Энтальпия (теплосодержание) – это величина, которая характеризует запас энергии в веществе.
ΔH = ΣHпродукты – ΣHреагенты
ΔH = -Qреакции
Для экзотермической реакции:
Q > 0, ΔH < 0
Для эндотермической реакции
Q < 0, ΔH > 0
(ΔH обр – справочное значение)
№12 слайд
Содержание слайда: Движущая сила реакций
Для экзотермических реакций – стремление системы к состоянию с наименьшей внутренней энергией.
Для эндотермических реакций – стремление любой системы в наиболее вероятному состоянию, которое характеризуется максимальным беспорядком, более высокой энтропией.
Энтропия – мера хаоса.
№13 слайд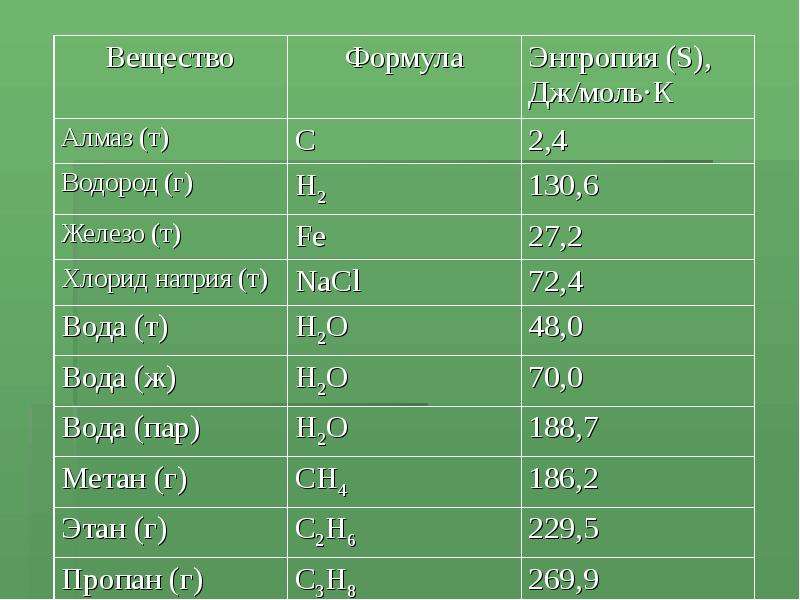
№14 слайд
Содержание слайда: Выводы
Направление химической реакции определяется двумя факторами: стремлением к уменьшению внутренней энергии и стремлением к увеличению энтропии.
Эндотермическую реакцию можно активировать, если она сопровождается увеличением энтропии.
Энтропия увеличивается при повышении температуры и особенно при фазовых переходах.
Чем выше температура, при которой проводят реакцию, тем большее значение будет иметь энтропийный фактор по сравнению по сравнению с энергетическим.
№15 слайд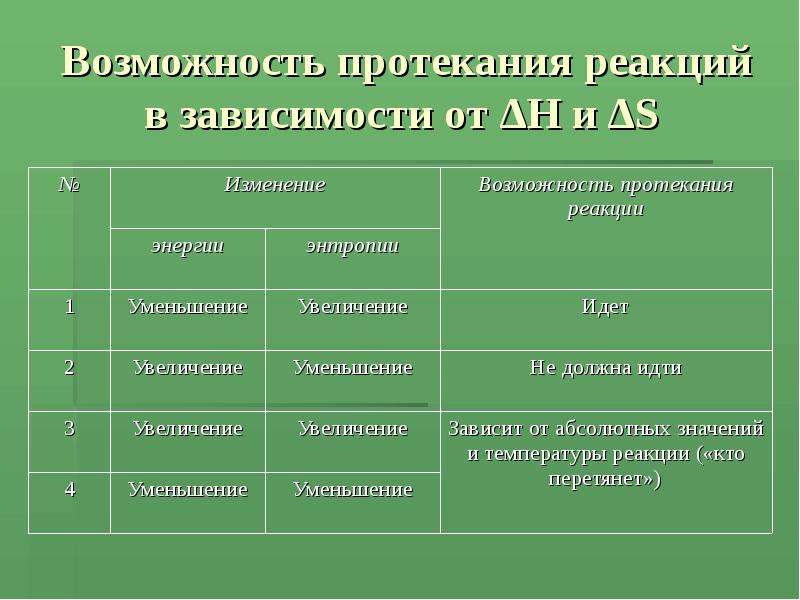
Содержание слайда: Возможность протекания реакций в зависимости от ΔH и ΔS
№16 слайд
Содержание слайда: Энергия Гиббса (G)
ΔG = ΔH – TΔS
T – абсолютная температура
ΔH – изменение энтальпии системы
ΔS – изменение энтропии системы
Самопроизвольно протекают лишь те процессы, в которых энергия Гиббса уменьшается
ΔG < 0
Процессы, при которых ΔG > 0 – невозможны.
Если ΔG = 0, то есть ΔH = TΔS, значит в системе установилось равновесие.