Презентация Протолитические равновесия и процессы. Лекция 3 онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Протолитические равновесия и процессы. Лекция 3 абсолютно бесплатно. Урок-презентация на эту тему содержит всего 23 слайда. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Протолитические равновесия и процессы. Лекция 3
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:23 слайда
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:661.60 kB
- Просмотров:63
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: Теория электролитической диссоциации Аррениуса пригодна лишь для водных растворов, в неводных растворителях она несостоятельна.
Теория электролитической диссоциации Аррениуса пригодна лишь для водных растворов, в неводных растворителях она несостоятельна.
Например, NH4Cl, ведущий себя как соль в водном растворе, при растворении в жидком аммиаке проявляет свойства кислоты, растворяя металлы с выделением водорода:
NH3
2NH4Cl + Ca = 2NH3 + CaCl2 + H2.
Мочевина CO(NH2)2, растворяясь в безводной уксусной кислоте, проявляет свойства основания, в жидком аммиаке – свойства кислоты, а ее водные растворы – нейтральны.
В связи с этим была выдвинута протолитическая теория, позволившая расширить класс кислот и оснований.
№4 слайд


Содержание слайда: Протонная теория объясняет кислотные и оснoвные свойства веществ происходящими между ними процессами протолиза - обмена протонами.
Протонная теория объясняет кислотные и оснoвные свойства веществ происходящими между ними процессами протолиза - обмена протонами.
Реакция обратима, что приводит всю систему в состояние протолитического равновесия.
№6 слайд


Содержание слайда: Жидкие протонсодержащие растворители вступают в обратимую реакцию автопротолиза. Например, для воды:
Жидкие протонсодержащие растворители вступают в обратимую реакцию автопротолиза. Например, для воды:
2Н2О = Н3О+ + ОН- или упрощенно Н2О = Н+ + ОН-
Состояние равновесия в этом случае характеризуется ионным произведением воды Kw:
K w = [OH-] х [H3O+]
При 25 оС K w = 10-14 и
[OH-] = [H3O+] = 10-7 моль/л
Содержание катионов оксония [H3O+] и гидроксид-ионов [OH-] удобно выражать через водородный показатель рН и гидроксидный показатель рОН.
№7 слайд


Содержание слайда: Водородный показатель рН – это отрицательный десятичный логарифм активности водородных ионов: рН = - lg cн+.
Водородный показатель рН – это отрицательный десятичный логарифм активности водородных ионов: рН = - lg cн+.
Аналогично, рОН – это отрицательный
десятичный логарифм активности ионов ОН-:
рОН = - lg cон-.
Логарифмируя уравнение КW = [Н+] [ОН-], получаем:
- lg cн+ + (- lg cон-) = -lg КW = -lg 10-14 или
рН + рОН = 14.
Шкала кислотности воды составляет 14 единиц.
рН нейтрального раствора равно 7.
При рН < 7 - кислая среда,
При рН > 7 - щелочная среда.
№8 слайд


Содержание слайда: Растворенные в воде вещества выполняющие по отношению к ней функции кислоты или основания, называют протолитами в водном растворе.
Растворенные в воде вещества выполняющие по отношению к ней функции кислоты или основания, называют протолитами в водном растворе.
Если протолит HA (молекула или ион) - кислота, то обратимая реакция протолиза имеет вид:
HA + H2O ↔ A- + H3O+ (1),
а состояние протолитического равновесия (1) характеризуется константой кислотности Kа:
Kа = ([A-] х [H3O+]) / [HA]
Значение Kа определяет силу кислоты в водном растворе.
10-1 < Ka < 10-1
сильные к-ты слабые к-ты
№9 слайд


Содержание слайда: Если протолит A- (молекула или ион) - основание, то обратимая реакция протолиза имеет вид:
Если протолит A- (молекула или ион) - основание, то обратимая реакция протолиза имеет вид:
A- + H2O ↔ HA + OH- (2),
а состояние протолитического равновесия (2) характеризуется константой основности Kb:
Kb = ([HA] х [OH-]) / [A-]
Значение Kb определяет силу основания в водном растворе.
10-1 < Kb < 10-1
сильные осн-я слабые осн-я
№10 слайд


Содержание слайда: Для каждой сопряженной пары кислота/основание значения Kа и Kb связаны соотношением:
Для каждой сопряженной пары кислота/основание значения Kа и Kb связаны соотношением:
Ka х Kb = Kw
Соотношение справедливо только в области разбавленных (от 0,0005 до 0,1 моль/л) водных растворов.
В растворах с концентрацией более 0,1 моль/л Kw зависит от количества растворенного вещества.
№13 слайд


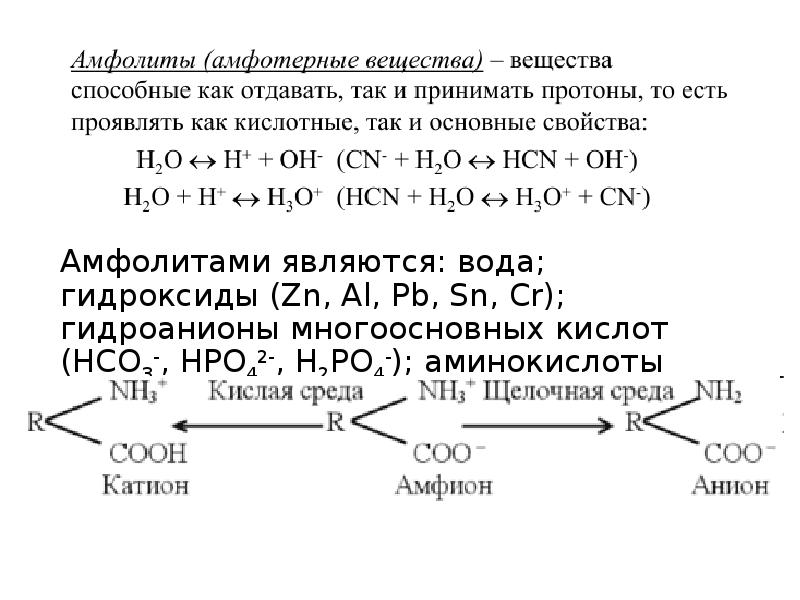
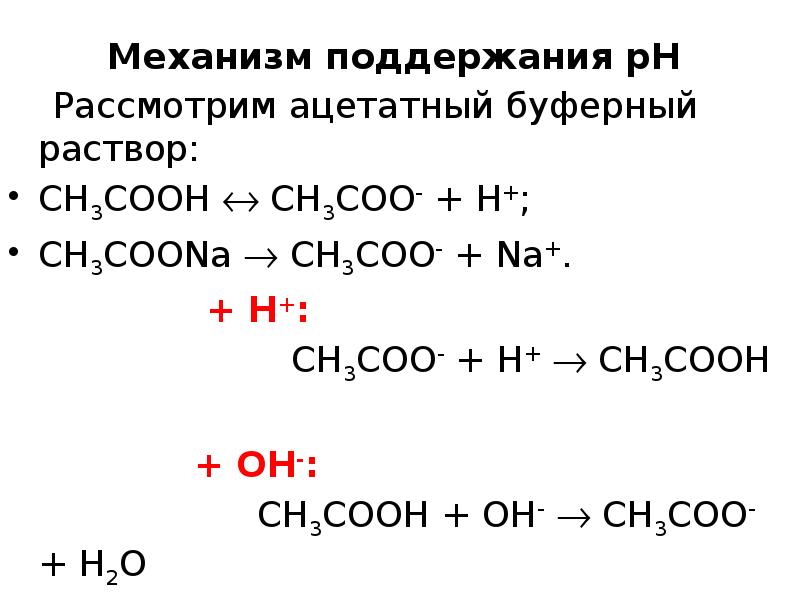
Содержание слайда: Буферные системы
Буферными называют растворы, способные сохранять значение рН при разбавлении или добавлении небольших количеств кислоты или щелочи. К таким растворам относят:
Растворы, содержащие слабую кислоту и соль этой кислоты и сильного основания (СН3СООН + СН3СООNa);
Растворы, содержащие слабое основание и соль этого основания и сильной кислоты (NH4OH + NH4Cl);
Растворы, содержащие соли многоосновных кислот (Na2HPO4 + NaH2PO4).
Растворы амфолитов (аминокислот, белков).
№16 слайд


Содержание слайда: Буферная емкость
Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочи, называют буферной ёмкостью раствора.
Буферная ёмкость (В) - количество моль эквивалентов сильной кислоты или щелочи, добавление которой к 1 л буферного раствора изменяет рН на единицу.
Буферная емкость по кислоте (моль/л или ммоль/л):
№17 слайд


Содержание слайда: Буферная ёмкость зависит от:
Буферная ёмкость зависит от:
природы добавляемых веществ и компонентов буферного раствора.
исходной концентрации компонентов буферной системы.
Чем больше количества компонентов кислотно-основной пары в растворе, тем больше буферная ёмкость этого раствора.
3) соотношения концентраций компонентов буферного раствора, а следовательно и от рН.
№18 слайд


Содержание слайда: Максимальная буферная емкость, т.е. наибольшая способность этой системы противостоять изменению рН, соответствует значению рН = рК. При этом Ссоли/Ск-та = 1.
Максимальная буферная емкость, т.е. наибольшая способность этой системы противостоять изменению рН, соответствует значению рН = рК. При этом Ссоли/Ск-та = 1.
Интервал рН = рК 1, называется зоной буферного действия системы.
Это соответствует интервалу соотношения Ссоли/Ск-ты от 1/10 до 10/1.
№20 слайд


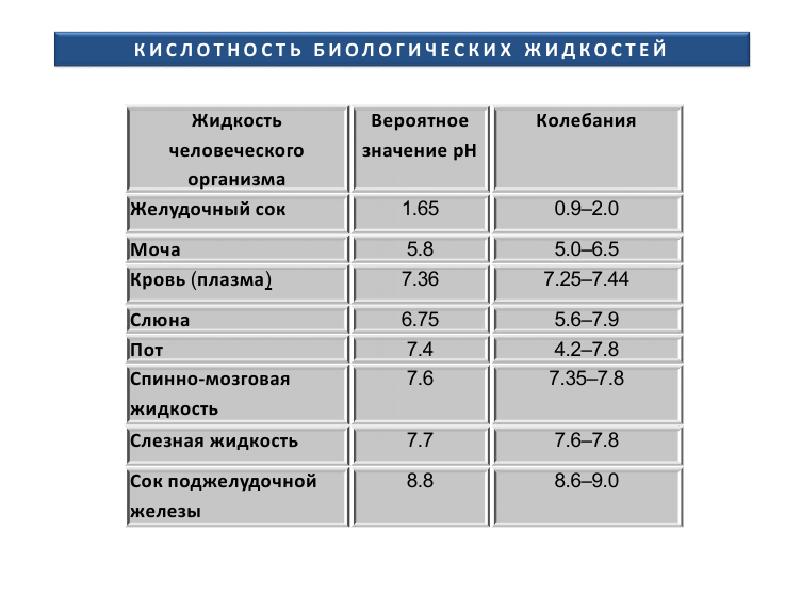
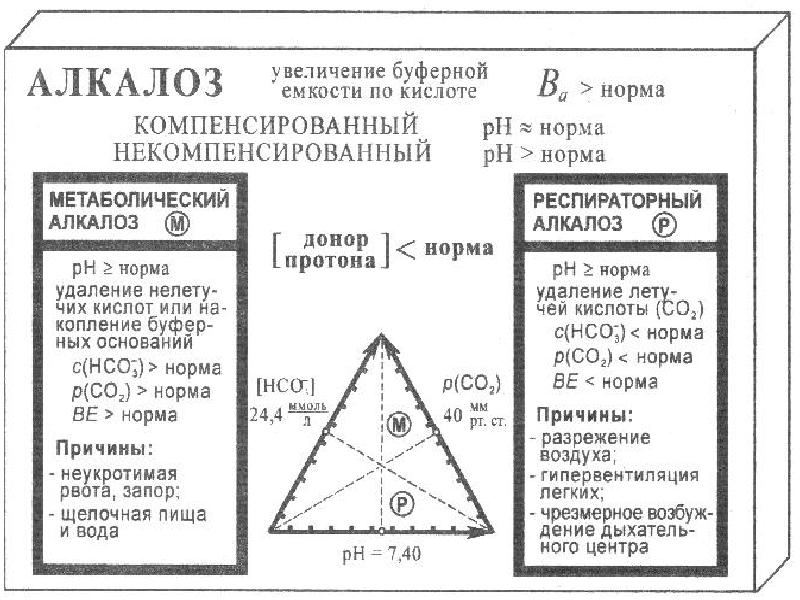
Содержание слайда: Кислотно-основное состояние организма (КОС)
Для оценки состояния буферных систем и выяснения причин сдвигов КОС предложены следующие показатели, которые определяются с помощью микрометода Аструпа:
Ва - буферная емкость по кислоте: крови – 0,05 моль/л; плазмы – 0,03 моль/л; сыворотки – 0,025 моль/л;
рН - концентрация водородных ионов - в норме 7,35-7,45.
рСО2 - парциальное давление СО2 - в норме 40±5 мм. рт. ст,
SB — стандартный бикарбонат, содержание НСОз- в крови при стандартных условиях — в норме 24,4±3 ммоль/л.
ВВ — буферные основания, общее содержание в крови всех буферных оснований — в норме 42±3 ммоль/л.
BE — избыток (или дефицит) буферных оснований, показывает изменение ВВ по сравнению с нормой — в норме ±3 ммоль/л.
№23 слайд


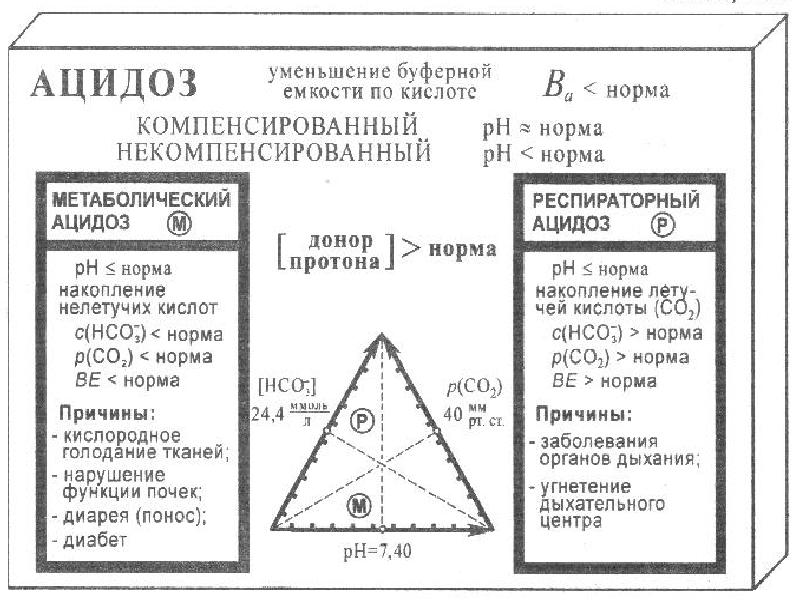
Содержание слайда: Коррекция КОС
Коррекция КОС
1. Выявление причин их возникновения: нарушение процессов дыхания (респираторный ацидоз или алкалоз) или процессов пищеварения и выделения (метаболический ацидоз или алкалоз).
2. При ацидозе: 4,5% NaHCO3,
V = ½ BE · mтела(кг) или V = mтела(кг)· tост. сердца(мин)
лучше
3,66% р-р трисамина или 11% р-р лактата натрия.
3. При алкалозе: 5% р-р аскорбиновой кислоты.
Скачать все slide презентации Протолитические равновесия и процессы. Лекция 3 одним архивом:
Похожие презентации
-
 Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы -
 Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов
Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов -
 Протолитические равновесия и процессы
Протолитические равновесия и процессы -
 Лекция 20 Тема: Окислительно-восстановительные равновесия в аналитической химии
Лекция 20 Тема: Окислительно-восстановительные равновесия в аналитической химии -
 Лекция 18 Тема: Равновесия комплексообразования и их роль в аналитической химии
Лекция 18 Тема: Равновесия комплексообразования и их роль в аналитической химии -
 Расчёт реакторов для гомогенных процессов. Лекция 10
Расчёт реакторов для гомогенных процессов. Лекция 10 -
 Термодинамика химических процессов. Лекция 01-1
Термодинамика химических процессов. Лекция 01-1 -
 Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5) -
 Сильные и слабые электролиты. Равновесие в растворах слабых электролитов. (Лекция 8)
Сильные и слабые электролиты. Равновесие в растворах слабых электролитов. (Лекция 8) -
 Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель