Презентация Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) абсолютно бесплатно. Урок-презентация на эту тему содержит всего 34 слайда. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1)
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:34 слайда
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:343.50 kB
- Просмотров:114
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№1 слайд


Содержание слайда: МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
«НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Кафедра инженерных проблем экологии
ЛАБОРАТОРНАЯ РАБОТА № 1
«Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты»
Выполнил: Проверил:
Студент гр. доцент каф. ИПЭ
______________ Ларичкина Н.И.
«___» ________ 2016г. «___» _____ 2016 г.
___________________ _______________
(подпись) (подпись)
НОВОСИБИРСК
2016
№5 слайд


Содержание слайда: 3. Оборудование и материалы
Коническая колба, емк. 250 мл – 2 шт.
Пипетка измерительная на 10 мл – 1 шт.
Бюретка, емк. *** мл – 1 шт.
Мензурка, емк. 250 мл – 1 шт.
Стакан термостойкий – 1 шт.
Капельница – 1 шт.
Бюкса стеклянная – 1 шт.
Весы аналитические (технические) марки – 1 шт.
№7 слайд


Содержание слайда: 4. Порядок выполнения работы
Приготовьте раствор щелочи заданной концентрации.
Для этого рассчитайте навеску щелочи, взвести её на аналитических весах и растворите в 50 мл дистиллированной воды.
В коническую колбу для титрования пипеткой отмерьте 10 мл, приготовленного Вами раствора щелочи, добавьте 50 мл дистиллированной воды и 1 - 2 капли метилового оранжевого, раствор тщательно перемешайте. Он приобретет желтый цвет.
Приведите в рабочее состояние бюретку, налейте в нее до отметки "0" приготовленный титрованный раствор НСl с концентрацией Сэ = 0,1 моль*экв/л
№8 слайд


Содержание слайда: К раствору щелочи медленно, небольшими порциями при тщательном перемешивании из бюретки приливайте раствор соляной кислоты до достижения точки эквивалентности. При этом окраска метилоранжа переходит из желтой в бледно-розовую.
К раствору щелочи медленно, небольшими порциями при тщательном перемешивании из бюретки приливайте раствор соляной кислоты до достижения точки эквивалентности. При этом окраска метилоранжа переходит из желтой в бледно-розовую.
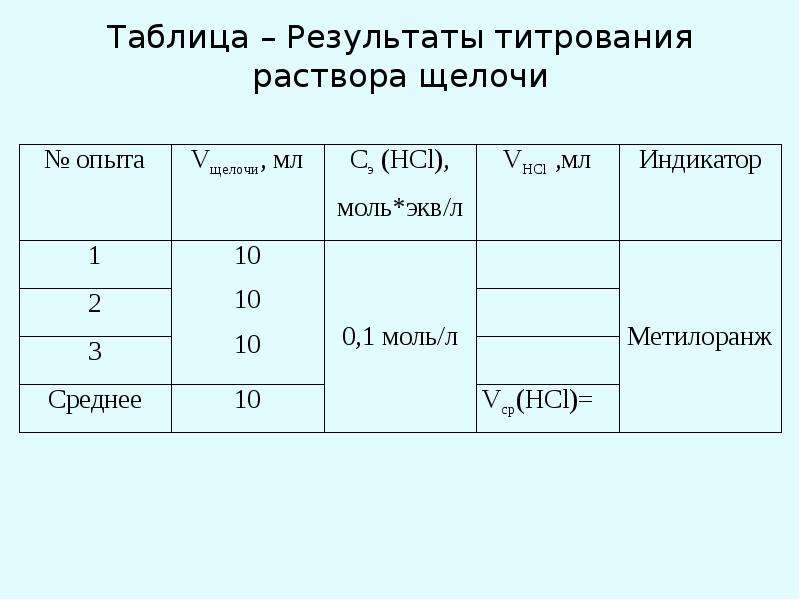
Заметьте по бюретке объем соляной кислоты, пошедшей на титрование. Титрование повторите три раза. Данные титрования занесите в таблицу.
№12 слайд


Содержание слайда: Защита лабораторной работы № 1
проводится
по теоретическим вопросам метода нейтрализации,
формулам пересчета концентраций растворов химических соединений,
решению задач, представленных в методических указаниях к выполнению лабораторных работ по «Неорганической и коллоидной химии».
№14 слайд


Содержание слайда: 1.1 Растворы. Способы выражения концентрации растворов
Растворы – гомогенные (однородные) системы переменного состава, которые содержат два или несколько химических компонента.
Водные растворы – это растворы, в которых растворителем является вода.
Растворы, применяемые на практике, могут быть различной концентрации. Существует несколько способов выражения концентрации растворенного вещества.
№15 слайд


Содержание слайда: Растворимость вещества выражают в граммах на литр (г/л). По растворимости в воде вещества делятся на три группы:
Растворимость вещества выражают в граммах на литр (г/л). По растворимости в воде вещества делятся на три группы:
- хорошо растворимые (Р),
- малорастворимые (М),
- практически нерастворимые (Н).
Хорошо растворимые вещества – это вещества, растворимость которых составляет более 10 г на 1 л воды. Например, в 1 л воды может раствориться до 2000 г сахара.
№16 слайд


Содержание слайда: Малорастворимые вещества – это вещества, растворимость которых составляет от 0,01 до 10 г на 1 л воды.
Малорастворимые вещества – это вещества, растворимость которых составляет от 0,01 до 10 г на 1 л воды.
Например, в 1 л воды растворяется не более 2 г гипса (CaSO4*2H2O).
Практически нерастворимые вещества – это вещества, растворимость которых составляет менее 0,01 г на 1 л воды.
Например, AgCl: в 1 л воды растворяется 1,5*10-3 г.
№17 слайд


Содержание слайда: Способы выражения концентрации
Молярная концентрация – это число молей растворенного вещества n(X) в 1 л раствора (V).
См=n(X)/V=m/M(X)*V.
Если объем измеряется в мл, тогда См=m*1000/M(X)*V.
Моль – это количество вещества, содержащее столько молекул (атомов) этого вещества, сколько атомов содержится в 12 г углерода (12С).
n(X)=m/M(X).
Молярная масса – это масса одного моля вещества.
г/моль; кг/кмоль
№18 слайд


Содержание слайда: Способы выражения концентрации
Молярная концентрация эквивалента (эквивалентная концентрация) – число эквивалентных масс (nэ(Х)), растворенного в 1 л раствора.
Сэ= nэ(Х)/V = m /M(X) *fэкв. *V.
Если объем раствора измеряется в мл, тогда
Сэ= m*1000/M(X) *fэкв. *V.
Молярная масса эквивалента - это масса моля эквивалента вещества X. Она равна произведению фактора эквивалентности на молярную массу вещества.
Мэ(Х) = fэкв.*М(Х).
Эквивалент - это некая реальная или условная частица, которая может присоединять или высвобождать один ион водорода (Н+) в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях.
Единицей количества вещества эквивалента является моль.
№19 слайд


Содержание слайда: Способы выражения концентрации
Фактор эквивалентности - число, показывающее, какая доля реальной частицы вещества X эквивалентна одному иону Н+ в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Фактор эквивалентности — безразмерная величина fэкв l. Его рассчитывают из формулы кислоты, основания, соли, кристаллогидрата или по стехиометрии указанной реакции.
Для
- кислоты fэкв=1/основность кислоты
- основания fэкв=1/кислотность основания
- соли fэкв=1/число атомов металла * валентность металла
№20 слайд


Содержание слайда: Способы выражения концентрации
Массовая доля (массовая процентная концентрация %) - отношение массы данного компонента в растворе (m) к общей массе этого раствора (mр-ра).
С%=m*100/mр-ра=m/ *V
mр-ра = *V
Титр раствора - это отношение массы вещества к объему раствора, т.е. это масса вещества в граммах, содержащаяся в 1 мл раствора.
Т = m / V
№22 слайд


Содержание слайда: Количественный анализ. Метод нейтрализации
Метод нейтрализации позволяет по результатам титрования определить точную концентрацию компонента кислотного или основного характера в исследуемом растворе и вычислить его содержание.
В основе метода лежит реакция нейтрализации между кислотой и основанием, кислотой и основной солью, основанием и кислой солью и др., т.е. реакция взаимодействия гидратированных ионов Н+ и ОН-:
Н+ + ОН– = Н2О
№23 слайд


Содержание слайда: Количественный анализ.
Метод нейтрализации
Теоретически основой метода является закон эквивалентов:
массы реагирующих веществ пропорциональны их молярным массам эквивалентов:
де: mк-ты и mоснов- массы реагирующих веществ кислотно-основного характера, г,
Мэ - молярные массы эквивалентов взаимодействующих веществ, г/моль.
Следствие из закона эквивалентов позволяет оперировать объемами реагирующих веществ:
Сэ(к-ты)*V(к-ты) = Сэ(основ )*V(основ),
где Сэ -молярные концентрации эквивалентов реагирующих веществ, моль/л,
V - объемы растворов реагирующих веществ, мл.
№24 слайд


Содержание слайда: Количественный анализ.
Метод нейтрализации
В качестве рабочих растворов в методе нейтрализации используют:
титрованный раствор НСl (или H2SO4) Сэ = 0,1 или 0,01 моль/л;
установочный раствор NaOH (или КОН).
Для установления точки эквивалентности в реакции нейтрализации используют индикаторы (метиловый оранжевый, фенолфталеин, и др.).
№25 слайд


Содержание слайда: Зная объем исследуемого раствора щелочи
Зная объем исследуемого раствора щелочи
(Vисслед. щелочи), молярную концентрацию эквивалента кислоты (Сэ(НСl)), экспериментально определив VHCl, можно рассчитать концентрацию исследуемого раствора щелочи Сэ(NaOH):
Сэ(NaOH) = Сэ(HCl)*V(HCl)/V(NaOH),
Содержание компонента кислотного или основного характера в определенном объеме раствора можно определить:
а) m= Сэ *Мэ (г) – масса в 1 литре раствора;
б) , (г) – масса в объеме V мл.
Зная Сэ, всегда можно выразить концентрацию вещества в виде См, С% и т.д.
№27 слайд


Содержание слайда: Порядок выполнения работы
Приготовьте раствор щелочи (KOH или NaOH) заданной преподавателем концентрации (Стеор.). Для этого рассчитайте навеску щелочи, взвести её на аналитических весах и растворите в 50 мл дистиллированной воды. Работы необходимо выполнять при включенной вентиляции, не допускать попадания щелочи на кожные покровы.
Приведите в рабочее состояние бюретку, налейте в нее до отметки "0" приготовленный титрованный раствор НСl с концентрацией Сэ = 0,1 моль/л.
№28 слайд


Содержание слайда: Порядок выполнения работы
В коническую колбу для титрования пипеткой отмерьте 10 мл, приготовленного Вами раствора щелочи заданной преподавателем концентрации, добавьте 50 мл дистиллированной воды и 1 - 2 капли метилового оранжевого, раствор тщательно перемешайте. Он приобретет желтый цвет.
К раствору щелочи медленно, небольшими порциями при тщательном перемешивании из бюретки приливайте раствор соляной кислоты до достижения точки эквивалентности. При этом окраска метилоранжа переходит из желтой в бледно-розовую.
Заметьте по бюретке объем соляной кислоты, пошедшей на титрование. Титрование повторите три раза. Данные титрования занесите в таблицу.
№30 слайд


Содержание слайда: По формуле:
По формуле:
Сэ(NaOH)*V(NaOH) = СЭ(НС1)*V(HC1) определите СЭ(NaOH), взяв Vcp(HCl) как среднее значение по результатам 3-х титрований, считая, что полученное значение является практическим (СЭ(NaOH)=Спракт.).
Оцените погрешность Ваших измерений:
= С теор. – С практ. * 100/С теор.
По формулам пересчета рассчитайте концентрацию приготовленного Вами раствора.
По проделанной работе и проведенным расчетам сделайте выводы.
№31 слайд


Содержание слайда: ВЫВОДЫ
1.Освоен метод объемного титрования с использованием кислотно-основного индикатора- метил-оранжевого
2. Установлена концентрация приготовленного раствора, которая составляе( Сэкв=…), при этом погрешность определения равна: (=…)
Если погрешность более 10%:
Погрешность превышает 10 % в следствии…
№32 слайд


Содержание слайда: Защита лабораторной работы № 1
проводится по теоретическим вопросам метода нейтрализации, формулам пересчета концентраций растворов химических соединений и решению задач, примеры которых приведены ниже.
Задача 1. Сколько мл НС1 с р = 1,18 г/мл и С% = 36 % необходимо взять для приготовления 300 мл раствора НС1 с Сэ= 0,15 моль/л? Ответ: 3.87 мл.
Задача 2. Как приготовить 250 г раствора H2SO4 с С% = 13 % (р=1,082 г/мл), если имеется концентрированная серная кислота с С% = 96% (р = 1,84 г/мл). Вычислите См и Сэ приготовленного раствора H2SO4. Ответ: 18.4 мл; 216.15 мл; 1,434 моль/л; 2,869 моль/л.
№33 слайд


Содержание слайда: Задача 3. Определите Сэ и Т раствора КОН с С% = 43% и р = 1,48 г/мл. Какой объем этого раствора нужно взять, чтобы приготовить 500 мл разбавленного раствора КОН с Сэ = 0,01 моль/л? Ответ: 11.36 моль/л; 0,6364 г/мл; 0,44 мл.
Задача 3. Определите Сэ и Т раствора КОН с С% = 43% и р = 1,48 г/мл. Какой объем этого раствора нужно взять, чтобы приготовить 500 мл разбавленного раствора КОН с Сэ = 0,01 моль/л? Ответ: 11.36 моль/л; 0,6364 г/мл; 0,44 мл.
Задача 4. При определении кислотности молока на титрование 25 мл его пошло 3.5 мл раствора едкого натра с С, = 0,1 моль/л. Определить Сэ молочной кислоты в молоке. Ответ: 0,014 моль/л.
Задача 5. Сколько граммов НСl содержится в 250 мл ее раствора, если на титрование 5 мл этого раствора расходуется 3,5 мл раствора КОН с Сэ = 0,01 моль/л? Ответ: 0,0639 г.
Задача 6. В колбе на 500 мл растворено 0,755 г технического (т.е., содержащего примеси) NaOH. На титрование 5 мл этого раствора пошло 16,3 мл раствора НС1 с Сэ(теор.) = 0,01 моль/л (К = 0,8). Определить массовую долю чистого NaOH в навеске. Ответ: 69,14%.
№34 слайд


Содержание слайда: Задача 7. Сколько граммов буры содержится в 250 мл, если 10 мл этого раствора оттитровываются 12,3 мл раствора НС1 с Т = 0,00365 г/мл? Ответ: 5,864 г.
Задача 7. Сколько граммов буры содержится в 250 мл, если 10 мл этого раствора оттитровываются 12,3 мл раствора НС1 с Т = 0,00365 г/мл? Ответ: 5,864 г.
Задача 8. Сколько граммов HCI оттитровываются 15 мл раствора КОН с С, = 0,2 моль/л? Ответ: 0,1095 г.
Задача 9. Для определения С, и Т раствора НС1 была взята навеска буры Na2B4O7 • 10Н2О, равная 0,525 г. На нейтрализацию ее раствора было израсходовано 18,3 мл раствора НСl. Чему равны Сэ и Т раствора НСl? Ответ: 0,1504 моль/л, 0,00549 г/мл.
Скачать все slide презентации Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) одним архивом:
Похожие презентации
-
 Определение массовой концентрации общего железа с сульфосалициловой кислотой. (Лабораторная работа 2)
Определение массовой концентрации общего железа с сульфосалициловой кислотой. (Лабораторная работа 2) -
 Моделирование процесса приготовления раствора уксусной кислоты различной концентрации
Моделирование процесса приготовления раствора уксусной кислоты различной концентрации -
 Практическая работа 1. Приготовление растворов с заданной молярной концентрацией
Практическая работа 1. Приготовление растворов с заданной молярной концентрацией -
 Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов -
 Название работы: «Выращивание кристаллов из водного раствора методом охлаждения »
Название работы: «Выращивание кристаллов из водного раствора методом охлаждения » -
 Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна
Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна -
 Научная работа по химии: «Создание рисунков на стекле методом травления плавиковой кислотой». Выполнила: Черникова Виктория 11 «
Научная работа по химии: «Создание рисунков на стекле методом травления плавиковой кислотой». Выполнила: Черникова Виктория 11 « -
 «Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к
«Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к -
 Характеристики раствора Вкус Цвет Что растворено (раствор сахара, соли, спирта, уксусной кислоты и т. д. ) Что является растворител
Характеристики раствора Вкус Цвет Что растворено (раствор сахара, соли, спирта, уксусной кислоты и т. д. ) Что является растворител -
 Влияние обработки семян фасоли растворами химических веществ на рост и развитие растений
Влияние обработки семян фасоли растворами химических веществ на рост и развитие растений