Презентация Характеристика элемента по Периодической системе Д. И. Менделеева онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Характеристика элемента по Периодической системе Д. И. Менделеева абсолютно бесплатно. Урок-презентация на эту тему содержит всего 23 слайда. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Характеристика элемента по Периодической системе Д. И. Менделеева
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:23 слайда
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:2.11 MB
- Просмотров:67
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№4 слайд


Содержание слайда: Если от элемента бора (В) провести условную линию к элементу астату (At), то в главных подгруппах окажутся: правее и выше линии «B – At» – неметаллы; левее и ниже – металлы. Элементы, оказавшиеся вблизи этой линии проявляют переходные свойства. Неметаллов, включая благородные газы, насчитывается 22, все остальные элементы, в том числе и вновь синтезируемые, относятся к металлам. В побочных подгруппах находятся только металлы. Для металлов характерно небольшое число электронов на внешнем энергетическом уровне (1-3) и электроотрицательность ниже 2. Неметаллам присуща высокая электроотрицательность, 4 и более электронов на внешнем уровне. При образовании химических связей атомы металлов отдают внешние электроны, а атомы неметаллов их захватывают.
Если от элемента бора (В) провести условную линию к элементу астату (At), то в главных подгруппах окажутся: правее и выше линии «B – At» – неметаллы; левее и ниже – металлы. Элементы, оказавшиеся вблизи этой линии проявляют переходные свойства. Неметаллов, включая благородные газы, насчитывается 22, все остальные элементы, в том числе и вновь синтезируемые, относятся к металлам. В побочных подгруппах находятся только металлы. Для металлов характерно небольшое число электронов на внешнем энергетическом уровне (1-3) и электроотрицательность ниже 2. Неметаллам присуща высокая электроотрицательность, 4 и более электронов на внешнем уровне. При образовании химических связей атомы металлов отдают внешние электроны, а атомы неметаллов их захватывают.
№5 слайд


Содержание слайда: СТРОЕНИЕ АТОМА
Атомы имеют сложное строение: вокруг положительно заряженного массивного ядра движутся по определённым орбитам с огромной скоростью практически невесомые отрицательно заряженные электроны.
Ядро состоит из нуклонов – протонов(+) и нейтронов(0). По форме орбиты электроны бывают 4 типов: s, p, d и f и образуют электронные облака (орбитали) 4 видов. Общее число электронов в атоме равно числу протонов в ядре, а число электронов на внешнем уровне (у элементов главных подгрупп) равно номеру группы. Число энергетических уровней (электронных слоёв) в атоме равно номеру периода.
№7 слайд


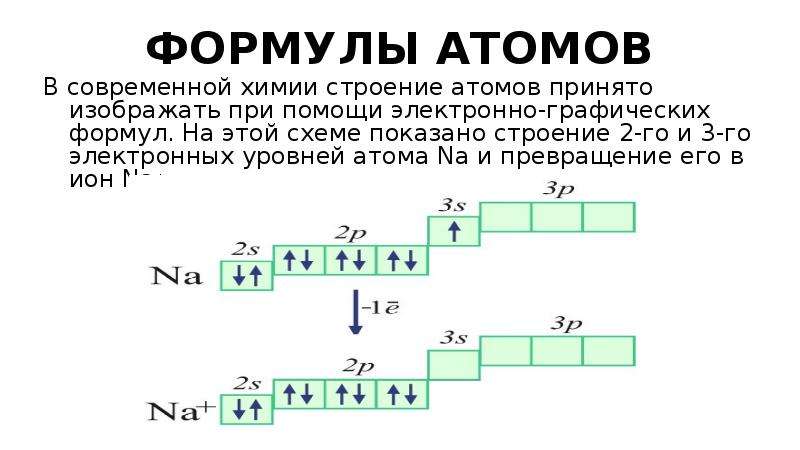
Содержание слайда: ФОРМУЛЫ АТОМОВ
На таких формулах квадратом обозначается электронная орбиталь, стрелки внутри квадрата символизируют электроны, этажное расположение обозначает уровни и подуровни электронов. Графическая часть формулы подтверждается буквенно-цифровым обозначением. Отсюда их название: электронно-графические формулы.
№8 слайд


Содержание слайда: ПОЛОЖЕНИЕ В СИСТЕМЕ
По положению в Системе можно определить:
Заряд ядра, число протонов в ядре и общее число электронов = порядковый номер элемента;
Число энергетических уровней (электронных оболочек) = номер периода;
Число электронов на внешнем уровне у элементов главных подгрупп = номер группы;
Металл или неметалл – по расположению относительно линии «B-At».
№9 слайд


Содержание слайда: ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА
Химический элемент можно характеризовать по следующим пунктам:
Положение в Периодической системе;
Металл или неметалл;
Электроотрицательность, то есть сила притяжения электронов к ядру;
Степень окисления, то есть число отданных или захваченных в процессе образования данного вещества, электронов (применяется к любым химическим элементам);
Валентность, то есть число образованных в данном веществе общих пар электронов (корректнее применять эту характеристику только к неметаллам).
№10 слайд


Содержание слайда: ВЗАИМОДЕЙСТВИЯ АТОМОВ
Для атомов присуще стремление приобрести более устойчивую и энергетически выгодную электронную конфигурацию, характерную для благородных газов (завершённый внешний энергетический уровень – «электронный октет»). В результате взаимодействия между собой, атомы более электроотрицательных элементов захватывают электроны на внешний уровень, а атомы менее электроотрицательных элементов – отдают свои внешние электроны.
№11 слайд


Содержание слайда: Каждый элемент занимает строго отведенную ему ячейку, которая расположена в определенном периоде и определенной группе.
Каждый элемент занимает строго отведенную ему ячейку, которая расположена в определенном периоде и определенной группе.
В каждой ячейке содержится информация об элементе:
- символ элемента
название элемента
порядковый номер
его атомная масса
№12 слайд


Содержание слайда: План – алгоритм характеристики элемента по его положению в ПСХЭ Д. И. Менделеева
1. Название
2. Химический знак, относительная атомная масса (Ar)
3. Порядковый номер
4. Номер периода (большой 4-7 или малый 1-3)
5. Номер группы, подгруппа (главная «А» или побочная «Б»)
6. Состав атома: число электронов, число протонов, число нейтронов
№14 слайд


Содержание слайда: 7. Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s- и p-элементами;
f- элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
№16 слайд


Содержание слайда: Подсказка! Для написания схемы нужно знать следующее:
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s- и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент. Например, Na+11)2)8)1=номеру группы
№17 слайд


Содержание слайда: 4. У d - элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
4. У d - элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1– исключение
№18 слайд


Содержание слайда: Максимальное возможное число электронов на уровнях определяют по формуле: Nэлектронов = 2n2, где n – номер энергоуровня.
Максимальное возможное число электронов на уровнях определяют по формуле: Nэлектронов = 2n2, где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV– 32 электрона и т.д.
№19 слайд


Содержание слайда: 9. Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
№20 слайд


Содержание слайда: 10. Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента - водород и гелий и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся: все d- и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
Скачать все slide презентации Характеристика элемента по Периодической системе Д. И. Менделеева одним архивом:
Похожие презентации
-
 Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева -
 Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева Составил: учитель хим
Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева Составил: учитель хим -
 Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д. И. Менделеева
Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д. И. Менделеева -
 Характеристика элемента по его положению в периодической системе химических элементов Д. И. Менделеева
Характеристика элемента по его положению в периодической системе химических элементов Д. И. Менделеева -
 Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д. И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д. И. Менделеева». «Химический дом и его обитат -
 По Химии "Характеристика химического элемента – неметалла на основании его положения в Периодической системе хими
По Химии "Характеристика химического элемента – неметалла на основании его положения в Периодической системе хими -
 По Химии "Элемент периодической системы химических элементов Д. И. Менделеева -АЛЮМИНИЙ" - скачать смотреть
По Химии "Элемент периодической системы химических элементов Д. И. Менделеева -АЛЮМИНИЙ" - скачать смотреть -
 Периодическая система химических элементов Д. И. Менделеева Учитель химии МБОУ СОШ 37 г. Шахты Ростовской области Вабищевич М. В.
Периодическая система химических элементов Д. И. Менделеева Учитель химии МБОУ СОШ 37 г. Шахты Ростовской области Вабищевич М. В. -
 Обобщающий урок по теме: «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома»
Обобщающий урок по теме: «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома» -
 ТЕМА: ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. Менделеева ПЛАН 1. История открытия Периодической системы химических элемен
ТЕМА: ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. Менделеева ПЛАН 1. История открытия Периодической системы химических элемен