Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
31 слайд
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
799.00 kB
Просмотров:
194
Скачиваний:
1
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
1. Метод валентных связей (ВС).
2. Теория кристаллического поля (ТКП).
3. Метод молекулярных орбиталей (ММО).
№2 слайд
Содержание слайда: Альфред Вернер – первым попытался объяснить химическую связь в комплексных соединениях.
Альфред Вернер – первым попытался объяснить химическую связь в комплексных соединениях.
1893 г. – статья Вернера «О строении неорганических соединений».
1913 г. – присуждение Вернеру Нобелевской премии.
Дальнейшее развитие химии КС связано с именем Чугаева. Созданная им школа объединила русских ученых Черняева, Гринберга, их учеников Яцимирского, Кукушкина.
№3 слайд
Содержание слайда: Теория валентных связей
Теория валентных связей
1. Связь между комплексообразователем и лигандами является донорно-акцепторной.
Лиганды предоставляют электронные пары, а центральный атом комплекса – свободные орбитали.
Мерой прочности связи служит степень перекрывания орбиталей.
№4 слайд
Содержание слайда: 2. Орбитали комплексообразователя подвергаются гибридизации.
2. Орбитали комплексообразователя подвергаются гибридизации.
Тип гибридизации зависит от природы и электронной структурой центрального атома (Ц.А.).
Геометрия комплекса определяется характером гибридизации орбиталей Ц.А.
Существует октаэдрические, тетраэдрические, квадратные и линейные комплексные ионы.
№5 слайд
Содержание слайда: 3. Магнитные свойства комплексного иона зависят от заселенности орбиталей комплексообразователя:
3. Магнитные свойства комплексного иона зависят от заселенности орбиталей комплексообразователя:
а) При наличии неспаренных электронов комплекс парамагнитен.
б) Полное отсутствие неспаренных электронов (все электроны спарены) обуславливает диамагнетизм комплексного соединения.
№6 слайд
Содержание слайда: 4. Наиболее прочные связи образуются при использовании комплексообразователем своих d–орбиталей.
4. Наиболее прочные связи образуются при использовании комплексообразователем своих d–орбиталей.
Типичные комплексообразователи - элементы, у которых d–орбитали заполнены электронами не полностью.
№7 слайд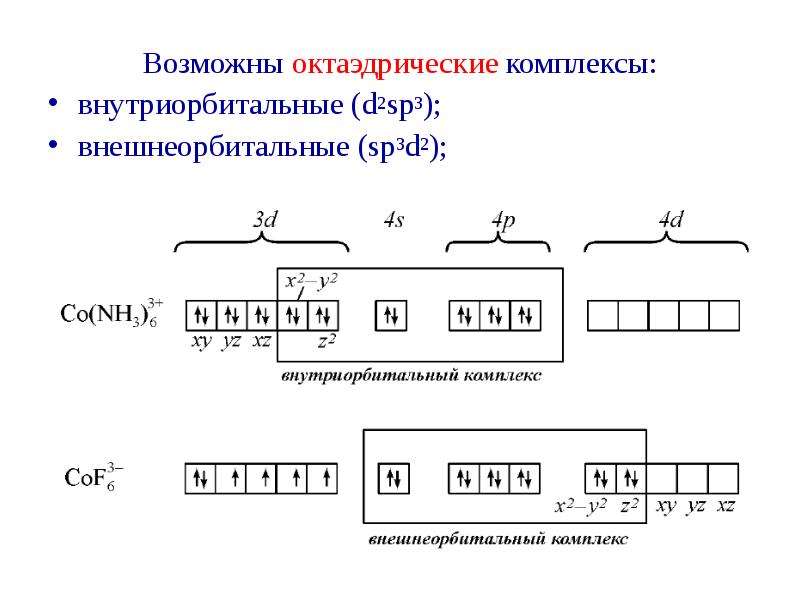
Содержание слайда: Возможны октаэдрические комплексы:
Возможны октаэдрические комплексы:
внутриорбитальные (d2sp3);
внешнеорбитальные (sp3d2);
№8 слайд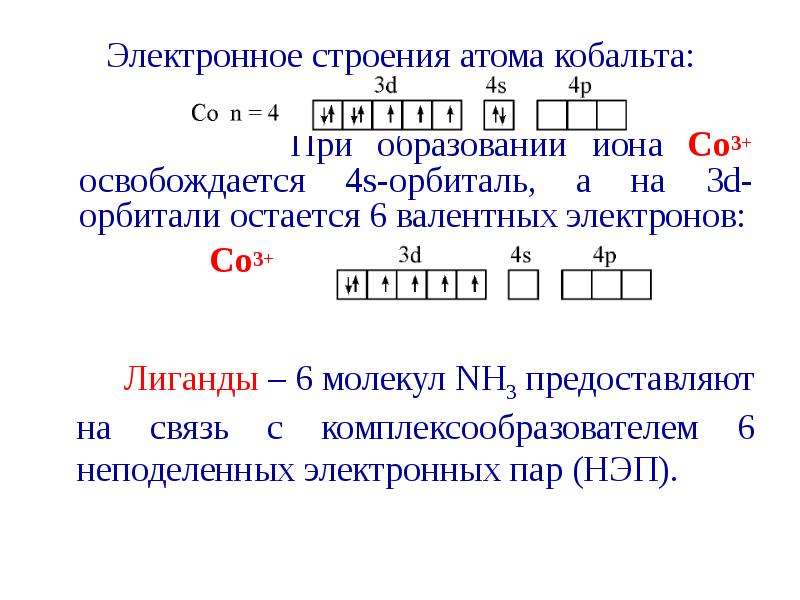
Содержание слайда: Электронное строения атома кобальта:
Электронное строения атома кобальта:
При образовании иона Со3+ освобождается 4s-орбиталь, а на 3d-орбитали остается 6 валентных электронов:
Со3+
№9 слайд
Содержание слайда: 1. Лиганды, создающие сильное поле, могут влиять на комплексообразователь. Электроны Ц.А. могут спариваться и освобождать две 3d-орбитали, которые заселяются электронными парами лигандов (внутриорбитальная гибридизация).
NH3 – создает сильное поле.
№10 слайд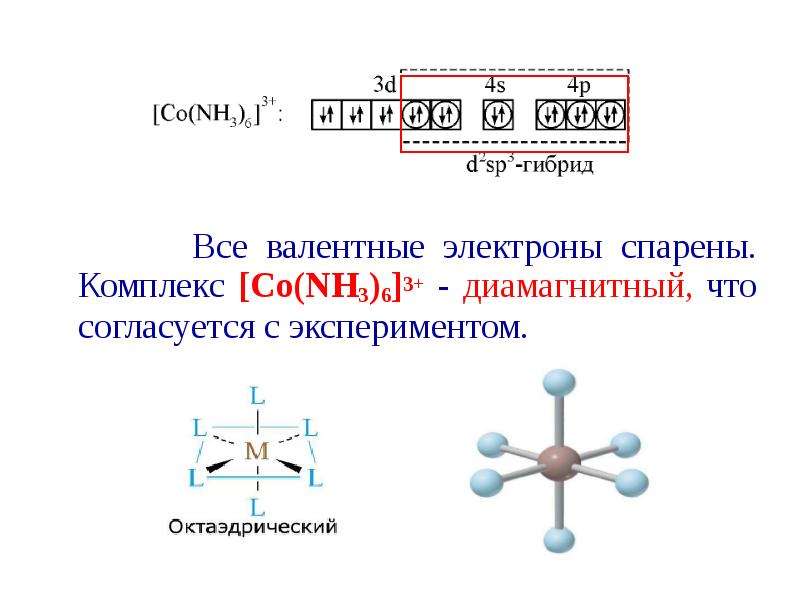
Содержание слайда: Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согласуется с экспериментом.
№11 слайд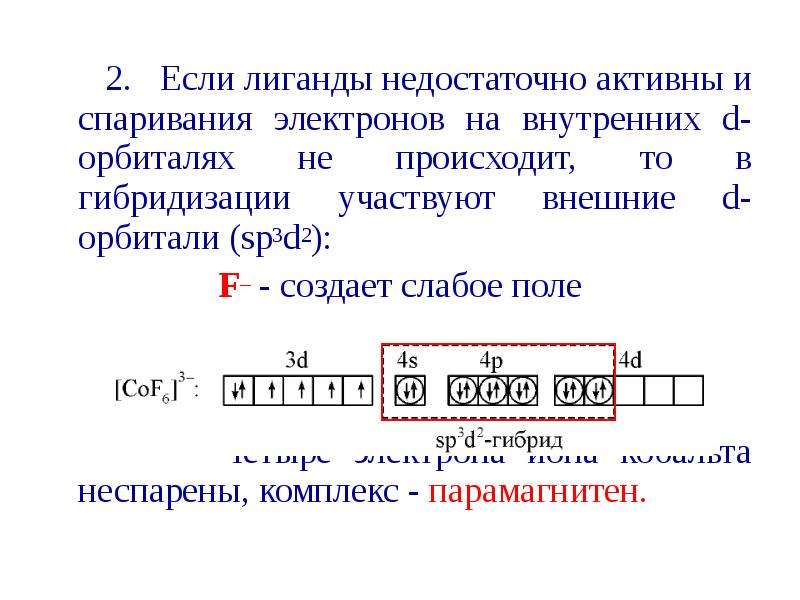
Содержание слайда: 2. Если лиганды недостаточно активны и спаривания электронов на внутренних d-орбиталях не происходит, то в гибридизации участвуют внешние d-орбитали (sp3d2):
2. Если лиганды недостаточно активны и спаривания электронов на внутренних d-орбиталях не происходит, то в гибридизации участвуют внешние d-орбитали (sp3d2):
F– - создает слабое поле
Четыре электрона иона кобальта неспарены, комплекс - парамагнитен.
№12 слайд
Содержание слайда: 3. Если комплексообразователь при спаривании валентных электронов на внутренних d-орбиталях может освободить только одну квантовую ячейку, то d2sp3-гибридизация осуществиться не может.
3. Если комплексообразователь при спаривании валентных электронов на внутренних d-орбиталях может освободить только одну квантовую ячейку, то d2sp3-гибридизация осуществиться не может.
№13 слайд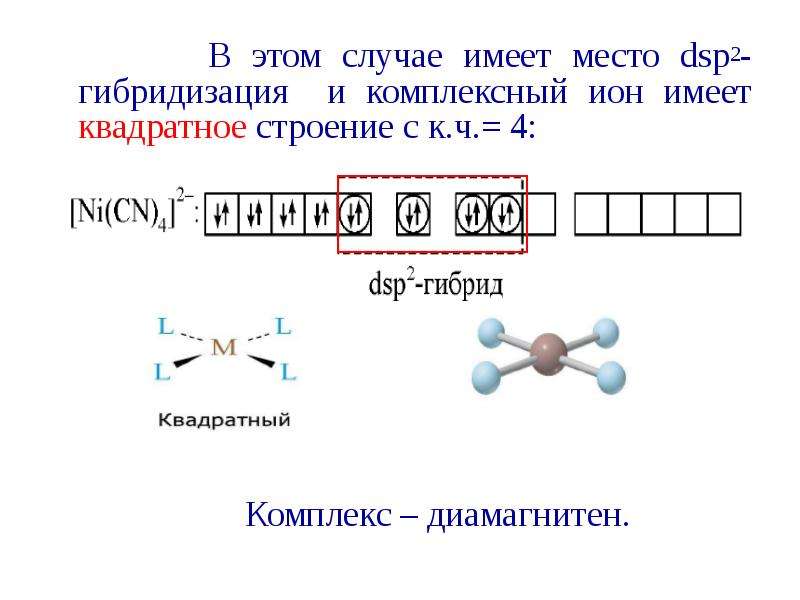
Содержание слайда: В этом случае имеет место dsp2-гибридизация и комплексный ион имеет квадратное строение с к.ч.= 4:
В этом случае имеет место dsp2-гибридизация и комплексный ион имеет квадратное строение с к.ч.= 4:
№14 слайд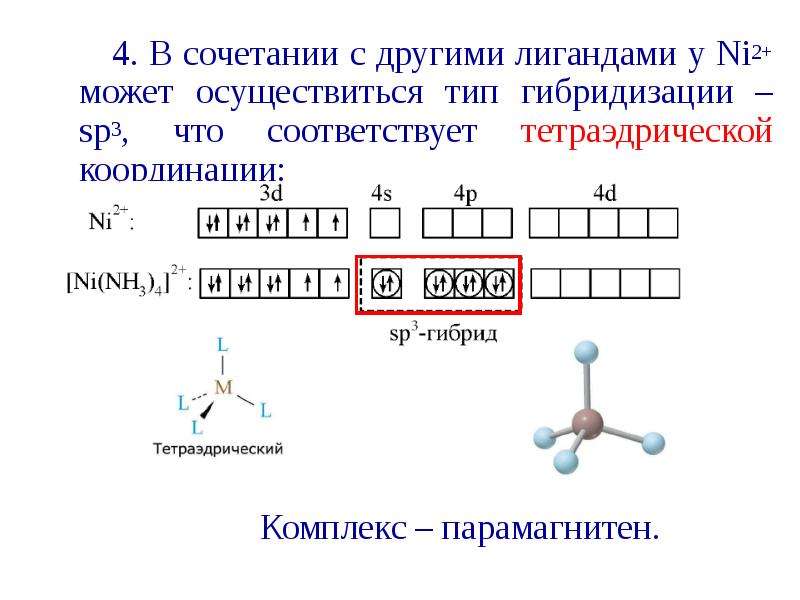
Содержание слайда: 4. В сочетании с другими лигандами у Ni2+ может осуществиться тип гибридизации – sp3, что соответствует тетраэдрической координации:
4. В сочетании с другими лигандами у Ni2+ может осуществиться тип гибридизации – sp3, что соответствует тетраэдрической координации:
№15 слайд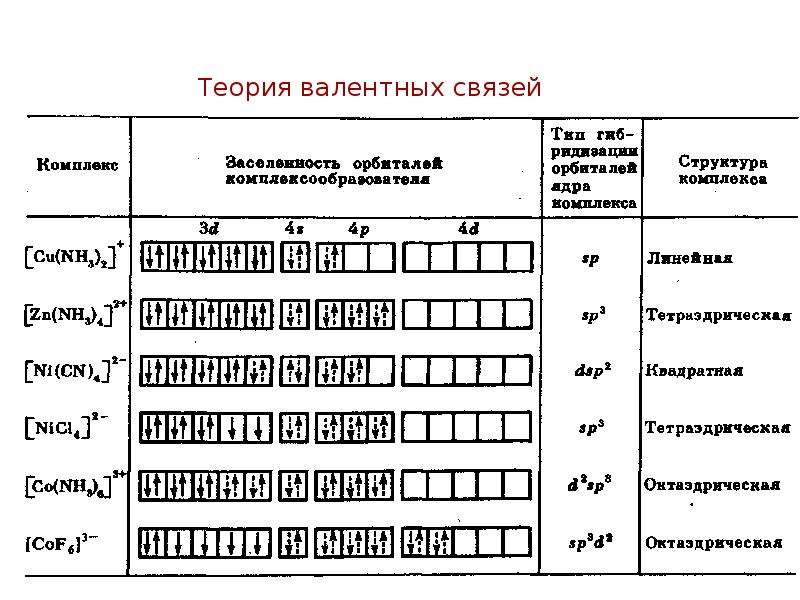
Содержание слайда: Теория валентных связей
Теория валентных связей
№16 слайд
Содержание слайда: Недостатки метода ВС:
Недостатки метода ВС:
Не объясняет и не предсказывает оптические свойства (цветность).
Не объясняет силу лигандов, т.е. способность их спаривать или не спаривать орбитали комплексообразователя.
Не позволяет определить конкуренцию между тетраэдрическими и квадратными комплексами.
№17 слайд
Содержание слайда: 2. Теория кристаллического поля
2. Теория кристаллического поля
Химическая связь между комплек-сообразователем и лигандами ионная или иондипольная.
Лиганды считаются точечными электрическими зарядами, не имеющими пространственной структуры.
Комплексообразователь рассматривается как квантовохимическая система, состоящая из ядра и электронов.
№18 слайд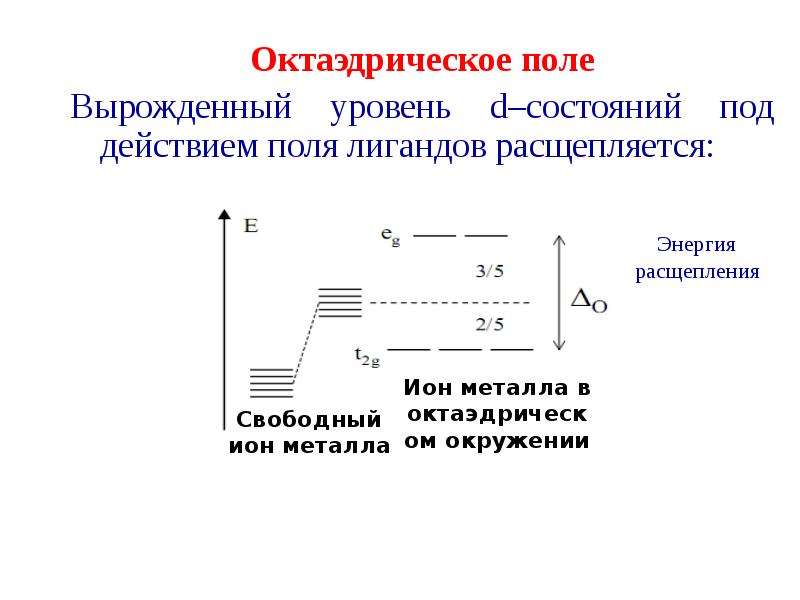
Содержание слайда: Октаэдрическое поле
Октаэдрическое поле
Вырожденный уровень d–состояний под действием поля лигандов расщепляется:
№19 слайд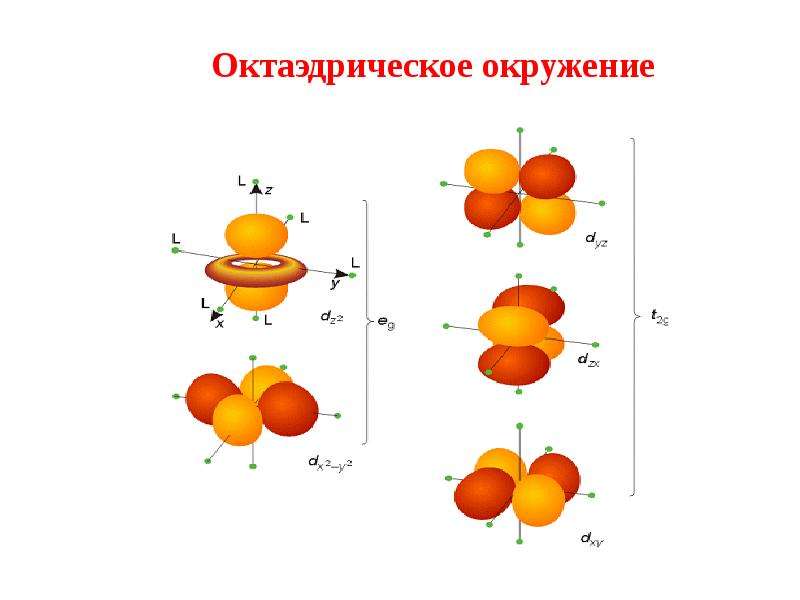
Содержание слайда: Октаэдрическое окружение
№20 слайд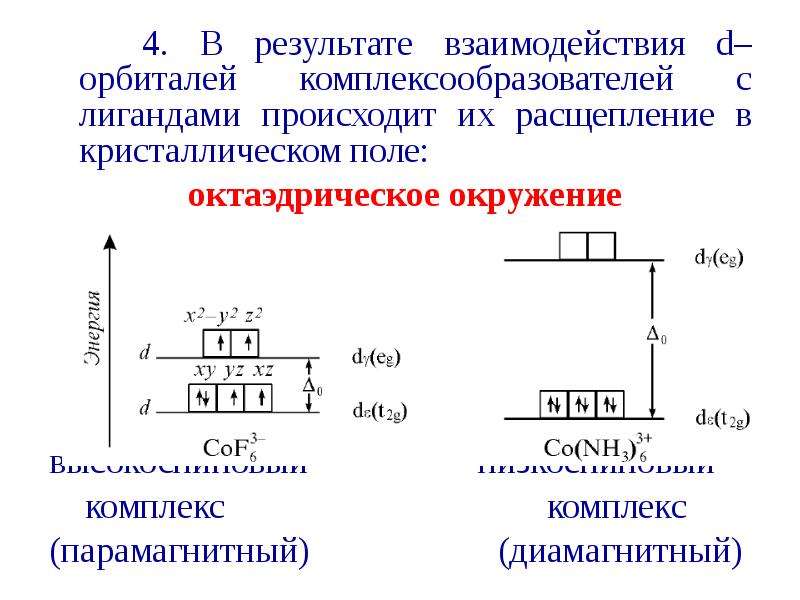
Содержание слайда: 4. В результате взаимодействия d–орбиталей комплексообразователей с лигандами происходит их расщепление в кристаллическом поле:
4. В результате взаимодействия d–орбиталей комплексообразователей с лигандами происходит их расщепление в кристаллическом поле:
октаэдрическое окружение
высокоспиновый низкоспиновый
комплекс комплекс
(парамагнитный) (диамагнитный)
№21 слайд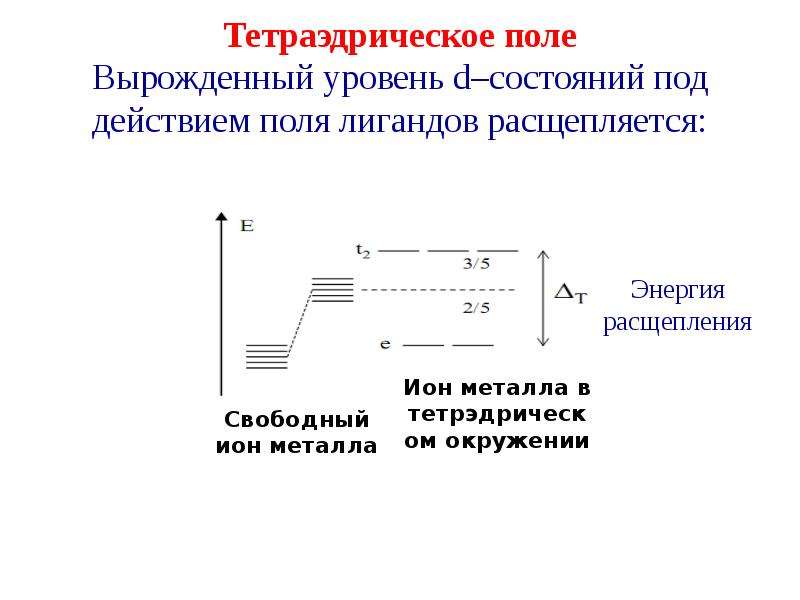
Содержание слайда: Тетраэдрическое поле
Вырожденный уровень d–состояний под действием поля лигандов расщепляется:
№22 слайд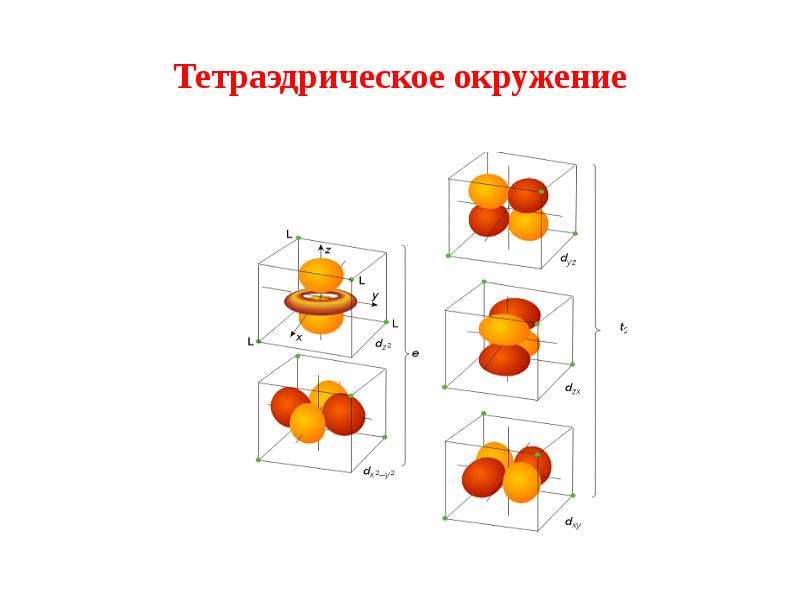
Содержание слайда: Тетраэдрическое окружение
№23 слайд
Содержание слайда: 5. Значение энергии расщепления (∆) тем больше, чем сильнее воздействие лиганда.
5. Значение энергии расщепления (∆) тем больше, чем сильнее воздействие лиганда.
В спектрохимическом ряду лиганды расположены в порядке убывания воздействия на ион d-элемента:
CО>CN->NO2->NH3>NCS->H2O>F->OH->Cl->Br->I-
№24 слайд
Содержание слайда: 6. Заполнение орбиталей происходит в соответствии с правилом Хунда:
6. Заполнение орбиталей происходит в соответствии с правилом Хунда:
а) если имеются лиганды со слабым расщепляющим воздействием (создают слабое поле), то электроны заполняют все орбитали по одному.
б) в комплексах с лигандами с большим расщепляющим воздействием (создают сильное поле) сначала заполняются электронами орбитали с меньшей энергией:
№25 слайд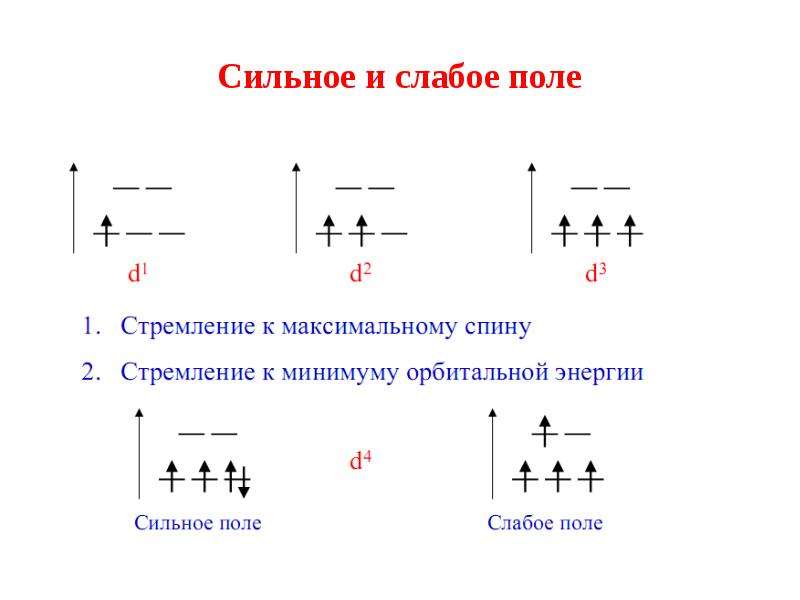
Содержание слайда: Сильное и слабое поле
№26 слайд
Содержание слайда: Окраску комплексов теория кристаллического поля объясняет поглощением света комплексными соединениями, при котором происходит переход электронов в возбужденного состояние.
Окраску комплексов теория кристаллического поля объясняет поглощением света комплексными соединениями, при котором происходит переход электронов в возбужденного состояние.
Поглощается квант света, энергия которого равна параметру расщепления:
Δ=hν
№27 слайд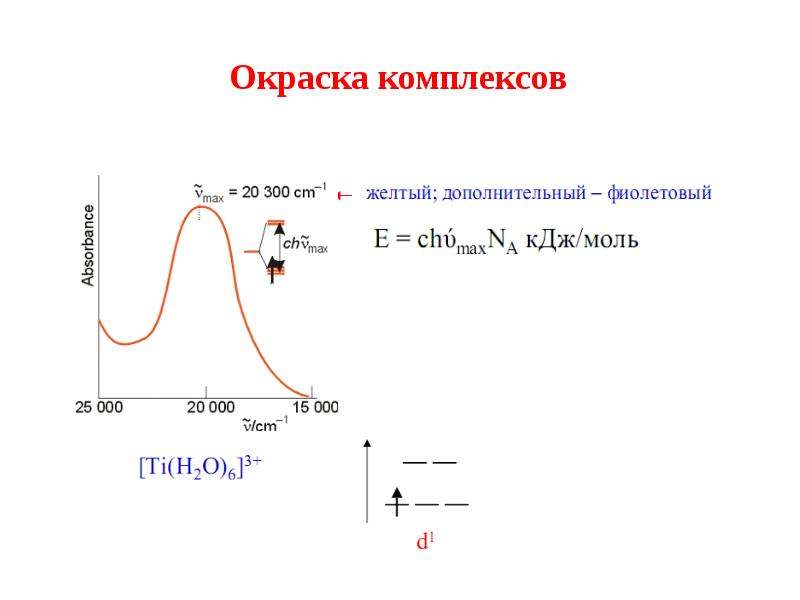
Содержание слайда: Окраска комплексов
№28 слайд
Содержание слайда: Теория кристаллического поля
Теория кристаллического поля
№29 слайд
Содержание слайда: 3. Метод молекулярных орбиталей
3. Метод молекулярных орбиталей
1. В ММО учитывается детальная электронная структура не только комплексообразователя, но и лигандов.
2. Комплекс рассматривается как единая квантово-механическая система, в которой отдельные атомы и молекулы теряют свои индивидуальные черты.
3. Валентные электроны системы располагаются на многоцентровых МО, охватывающих ядра комплексообразователя и всех лигандов, входящих в состав комплекса.
№30 слайд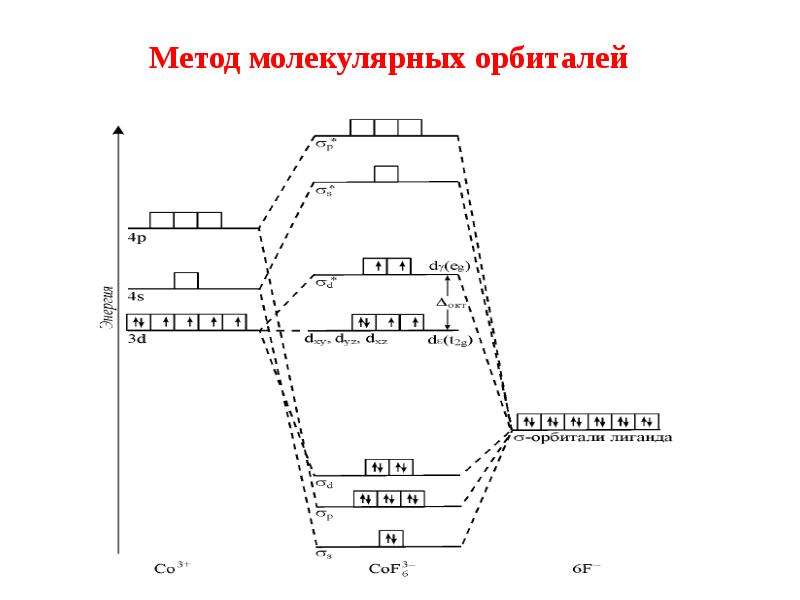
Содержание слайда: Метод молекулярных орбиталей
Метод молекулярных орбиталей
№31 слайд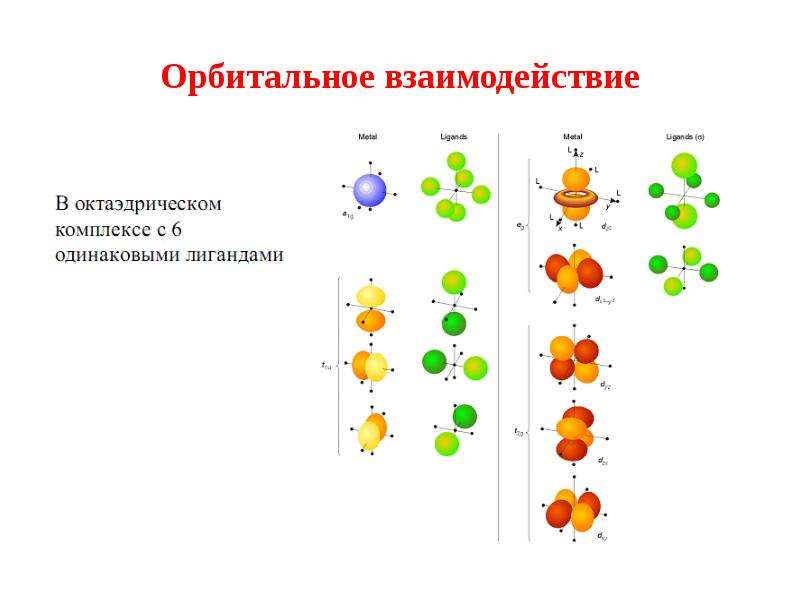
Содержание слайда: Орбитальное взаимодействие








































