Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
17 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
3.83 MB
Просмотров:
84
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Планетарная модель атома. Постулаты Бора
Подготовила: Порошина Лидия Владимировна, студентка очной формы обучения юридического факультета, группы Ю-102
№2 слайд
Содержание слайда: Понятие атома
Атом (от др.-греч. ἄτομος — неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств.
Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов.
№3 слайд
Содержание слайда: Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом.
Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом.
Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
№4 слайд
Содержание слайда: Рассеяние a-частиц при прохождении через фольгу вызывается кулоновскими силами, т.е. электрическим взаимодействием частицы и заряда атома. Гравитационное взаимодействие в 10 33 раз меньше, поэтому фактически роли не играет.
Какие же заряды в атоме вызывают рассеяние a-частиц? Электроны не могут этого сделать, так как их масса много меньше массы частицы: ma=7350me.При взаимодействии с электронами быстро движущаяся частица не изменяет направление своего движения.
Рассеяние a-частиц при прохождении через фольгу вызывается кулоновскими силами, т.е. электрическим взаимодействием частицы и заряда атома. Гравитационное взаимодействие в 10 33 раз меньше, поэтому фактически роли не играет.
Какие же заряды в атоме вызывают рассеяние a-частиц? Электроны не могут этого сделать, так как их масса много меньше массы частицы: ma=7350me.При взаимодействии с электронами быстро движущаяся частица не изменяет направление своего движения.
№5 слайд
Содержание слайда: Причиной рассеяния a-частицы является их взаимодействие с положительно заряженными частицами атома, занимающими очень малую область атома. Резерфорд назвал эту область ядром. В ядре сосредоточена почти вся масса атома и весь положительный заряд. Обобщив результаты опытов, Резерфорд предложил следующую модель строения атома:
Причиной рассеяния a-частицы является их взаимодействие с положительно заряженными частицами атома, занимающими очень малую область атома. Резерфорд назвал эту область ядром. В ядре сосредоточена почти вся масса атома и весь положительный заряд. Обобщив результаты опытов, Резерфорд предложил следующую модель строения атома:
№6 слайд
Содержание слайда: 1. В центре атома - положительно заряженное ядро:
заряд ядра q = Z·e, где Z-порядковый номер элемента в таблице Менделеева, e =1.6·10-19 Кл - элементарный заряд;
размер ядра 10-13 см;
масса ядра фактически равна массе атома.
№7 слайд
Содержание слайда: 2. Электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца:
электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение.
число электронов в атоме равно Z
(порядковый номер элемента)
электроны движутся с большой скоростью, образуя электронную оболочку атома.
Модель атома, предложенная Резерфордом, называется планетарной.
№8 слайд
Содержание слайда: Квантовые постулаты Бора
Планетарная модель атома является внутренне противоречивой. Движущийся с ускорением заряд излучает электромагнитную волну. При этом энергия атома уменьшается: электрон должен упасть на ядро, а атом прекратить свое существование.
На самом деле атомы химических элементов представляют собой устойчивые структуры, существующие десятки тысяч лет без изменения. Поэтому модель атома Резерфорда была дополнена рядом положений, автором которых является датский физик Бор.
№9 слайд
Содержание слайда: В 1913 году Бор показал, что несовпадение с экспериментом выводов, основанных на модели Резерфорда, возникла потому, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира - квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и "спасающих") атом Резерфорда.
В 1913 году Бор показал, что несовпадение с экспериментом выводов, основанных на модели Резерфорда, возникла потому, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира - квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и "спасающих") атом Резерфорда.
№10 слайд
Содержание слайда: Первый постулат
Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1, Е2...En. Находясь в стационарном состоянии, атом энергии не излучает, несмотря на движение электронов.
№11 слайд
Содержание слайда: Второй постулат
В стационарном состоянии атома электроны движутся по стационарным орбитам, для которых выполняется квантовое соотношение:
m·V·r = n·h/2·p
где m·V·r =L - момент импульса, n=1,2,3..., h-постоянная Планка.
№12 слайд
Содержание слайда: Третий постулат
Излучение или поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое. При этом излучается или поглощается порция энергии (квант), равная разности энергий стационарных состояний, между которыми происходит переход:
e = h·u = Em-En
№13 слайд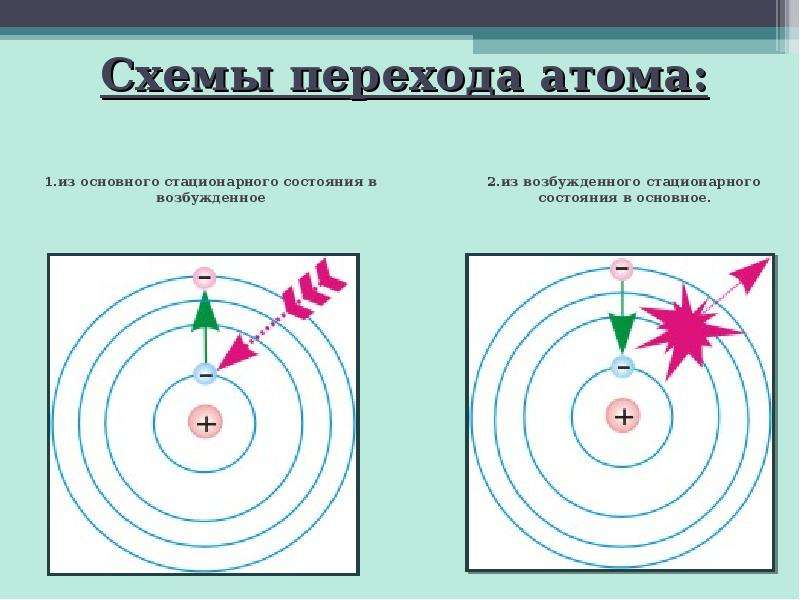
Содержание слайда: Схемы перехода атома:
1.из основного стационарного состояния в возбужденное
№14 слайд
Содержание слайда: Постулаты Бора противоречат законам классической физики. Они выражают характерную особенность микромира - квантовый характер происходящих там явлений. Выводы, основанные на постулатах Бора, хорошо согласуются с экспериментом. Например, объясняют закономерности в спектре атома водорода, происхождение характеристических спектров рентгеновских лучей и т.д. На рисунке на следующем слайде показана часть энергетической диаграммы стационарных состояний атома водорода.
Постулаты Бора противоречат законам классической физики. Они выражают характерную особенность микромира - квантовый характер происходящих там явлений. Выводы, основанные на постулатах Бора, хорошо согласуются с экспериментом. Например, объясняют закономерности в спектре атома водорода, происхождение характеристических спектров рентгеновских лучей и т.д. На рисунке на следующем слайде показана часть энергетической диаграммы стационарных состояний атома водорода.
№15 слайд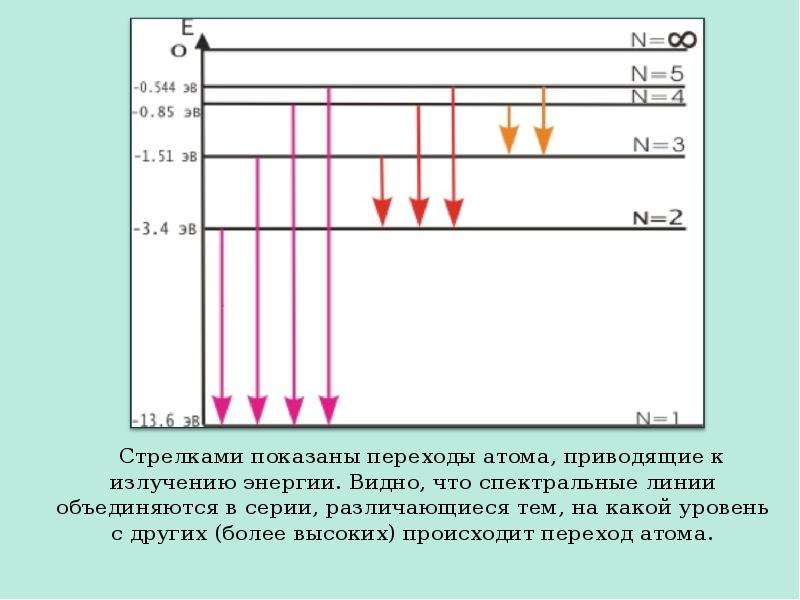
Содержание слайда: Стрелками показаны переходы атома, приводящие к излучению энергии. Видно, что спектральные линии объединяются в серии, различающиеся тем, на какой уровень с других (более высоких) происходит переход атома.
Стрелками показаны переходы атома, приводящие к излучению энергии. Видно, что спектральные линии объединяются в серии, различающиеся тем, на какой уровень с других (более высоких) происходит переход атома.
№16 слайд
Содержание слайда: Использованные источники
www.e-science.ru
www.wikipedia.ru
№17 слайд
Содержание слайда: Спасибо за внимание!


























