Презентация Организация крупного фармпроизводства в соответствии со стандартом GMP онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Организация крупного фармпроизводства в соответствии со стандартом GMP абсолютно бесплатно. Урок-презентация на эту тему содержит всего 104 слайда. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Машиностроение » Организация крупного фармпроизводства в соответствии со стандартом GMP
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:104 слайда
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:7.34 MB
- Просмотров:249
- Скачиваний:1
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ
Государственное образовательное учреждение высшего профессионального образования «ПЯТИГОРСКАЯ ГОСУДАРСТВЕННАЯ ФАРМАЦЕВТИЧЕСКАЯ АКАДЕМИЯ Федерального агентства по здравоохранению и социальному развитию» ГОУ ВПО Пятигорская ГФА Росздрава
«Pjatigorsk state pharmaceutical academy (PSPA)»
Организация крупного фармпроизводства в соответствии со стандартом GMP
Учебное пособие на компакт-диске
Авторы: проф. Погорелов В.И., доц. Шевченко А.М., асс. Пантюхин А.В., Петров А.Ю.
Рецензенты: проф. Степанова Э.Ф., доц. Джумаев М.А. (Хабаровский ГМУ)
РЕКОМЕНДОВАНО к использованию в учебном процессе ЦМС ГОУ ВПО «Пятигорская государственная фармацевтическая академия» (протокол №2 от 14 сентября 2005 г.)
Учебное пособие на компакт-диске « Организация крупного фармпроизводства в соответствии со стандартом GMP» соответствует действующей примерной программе по дисциплине «Фармацевтическая технология» (специальность 060180 «Фармация»), утвержденной департаментом образовательных программ и стандартов профессионального образования Министерства образования России (М.: 2002 г.).
Предназначено для студентов фармацевтических ВУЗов и фармацевтических факультетов ВУЗов РФ. Может быть использовано для слушателей факультетов повышения квалификации и работниками фармпроизводств при обучении правилам работы в условиях GMP.
Редакционный совет: проф. Е.Н. Вергейчик, проф. В.Г. Беликов, проф. В.И. Погорелов, проф. М.А. Галкин, проф. В.А. Челомбитько, проф. Э.Т. Оганесян, доц. В.В. Гацан, проф. М.Н. Ивашев, доц. В.И. Шульженко.
№4 слайд


Содержание слайда: Сведения о стандарте
1. Подготовлен Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ) по собственному аутентичному переводу, указанному в пункте 4.
2. Внесен Техническим комитетом по стандартизации ТК 458 "Производство и контроль качества лекарственных средств".
3. Утвержден и введен в действие Постановлением Госстандарта России от 10 марта 2004 г. N 160-ст.
4. Настоящий стандарт идентичен Правилам производства лекарственных средств Европейского Союза (ЕС Guide to Good Manufacturing Practice for Medicinal Products).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации.
5. Введен впервые.
№5 слайд


Содержание слайда: ВВЕДЕНИЕ
В мировой практике одним из важнейших документов, определяющим требования к производству и контролю качества лекарственных средств для человека и животных, являются
"Правила производства лекарственных средств"
"Good Manufacturing Practice for Medicinal Products (GMP)".
№8 слайд


Содержание слайда: ОБЛАСТЬ ПРИМЕНЕНИЯ
Настоящий стандарт устанавливает требования к производству и контролю качества лекарственных средств для человека и животных.
Стандарт распространяется на все виды лекарственных средств и устанавливает общие требования к их производству и контролю качества, а также специальные требования к производству отдельных видов лекарственных средств (Приложения 1-18).
Стандарт не распространяется на обеспечение промышленной безопасности, пожарной безопасности, взрывобезопасности, химической безопасности и безопасности других видов при производстве лекарственных средств, требования к которым приведены в других нормативных документах.
№10 слайд


Содержание слайда: Управление качеством
Принципы
Производитель лекарственных средств должен организовать их производство так, чтобы лекарственные средства гарантированно соответствовали своему назначению и предъявляемым к ним требованиям и не создавали риска для потребителей из-за нарушения условий безопасности, качества или эффективности. Ответственность за выполнение этих требований несут руководители и все работники предприятия-производителя, а также поставщики и дистрибьюторы.
Для достижения этой цели на предприятии на основе настоящего стандарта (Правил GMP) должна быть создана система обеспечения качества, включающая в себя организацию контроля качества.
Следует документально оформить в полном объеме требования к системе обеспечения качества и организовать контроль эффективности ее функционирования. Все звенья этой системы следует укомплектовать квалифицированным персоналом, обеспечить необходимыми помещениями, оборудованием и пр. Ответственность за функционирование системы возлагается, в первую очередь, на руководителей и Уполномоченных лиц.
Основные принципы обеспечения качества, Правил GMP и контроля качества взаимосвязаны и имеют первостепенное значение в организации производства лекарственных средств.
№16 слайд


Содержание слайда: 2. Персонал
Предприятие должно быть укомплектовано персоналом необходимой численности и квалификации. Должностные обязанности каждого сотрудника должны быть оформлены документально и усвоены каждым сотрудником. Все сотрудники также должны знать требования настоящего стандарта (Правил GMP), относящиеся к сфере их деятельности, и проходить начальное и повторное обучение в необходимом объеме, в т.ч. по правилам личной гигиены
№17 слайд


Содержание слайда: Руководящие работники
2.3. Руководители производства, руководитель службы (отдела) контроля качества и Уполномоченное лицо (лица) должны быть заняты на предприятии полный рабочий день. Руководители производства и службы (отдела) контроля качества должны быть независимыми друг от друга. На больших предприятиях часть функций, перечисленных в 2.5.-2.7., передается, при необходимости, другим сотрудникам.
Квалификация Уполномоченного лица должна соответствовать установленным требованиям. Уполномоченное лицо должно входить в штат предприятия-производителя лекарственных средств. Его обязанности могут быть переданы только лицам, имеющим статус Уполномоченного лица.
№23 слайд


Содержание слайда: Гигиена персонала
2.13. На предприятии должны быть разработаны правила личной гигиены персонала с учетом особенностей конкретного производства. Правила должны содержать инструкции, регламентирующие требования к состоянию здоровья, соблюдению гигиены и порядку ношения одежды. Инструкции должны соблюдать все сотрудники, которые связаны с нахождением в производственных помещениях и помещениях контроля качества. Руководство предприятия несет ответственность за выполнение персоналом правил гигиены и организацию необходимого обучения.
2.14. Все лица, принимаемые на работу, должны проходить медицинский осмотр. На предприятии должны быть инструкции с перечнем показателей состояния здоровья, которые могут оказать влияние на качество продукции. В случаях, связанных с производственной необходимостью или состоянием здоровья, сотрудники должны проходить повторный медицинский осмотр.
2.15. Лица с инфекционными заболеваниями и повреждениями на открытых участках тела не допускаются к производству лекарственных средств.
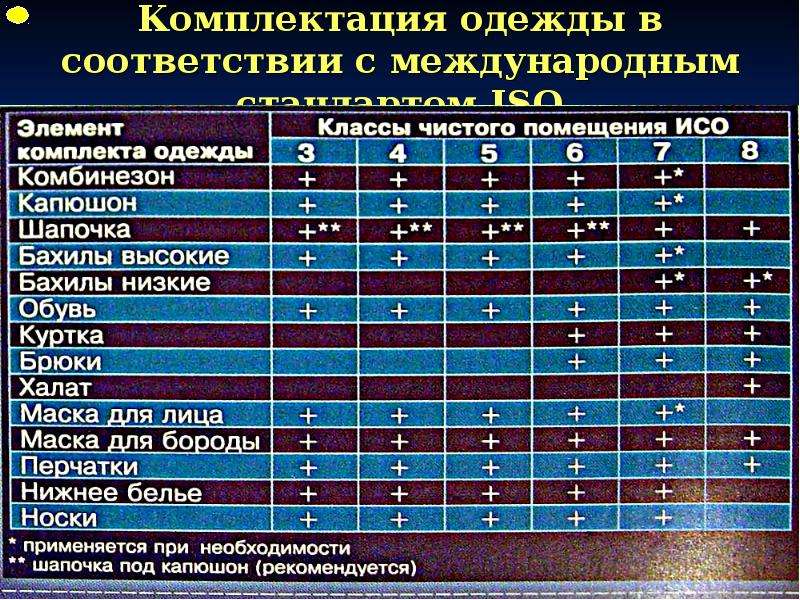
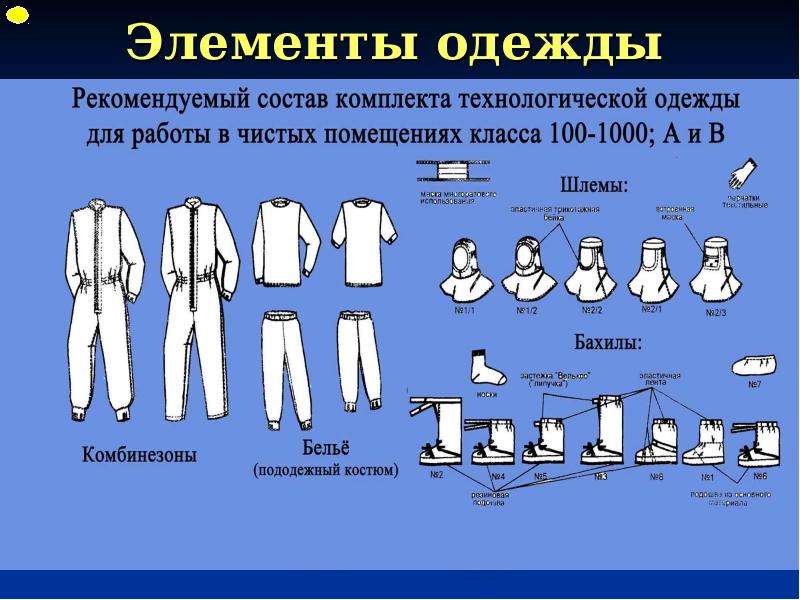
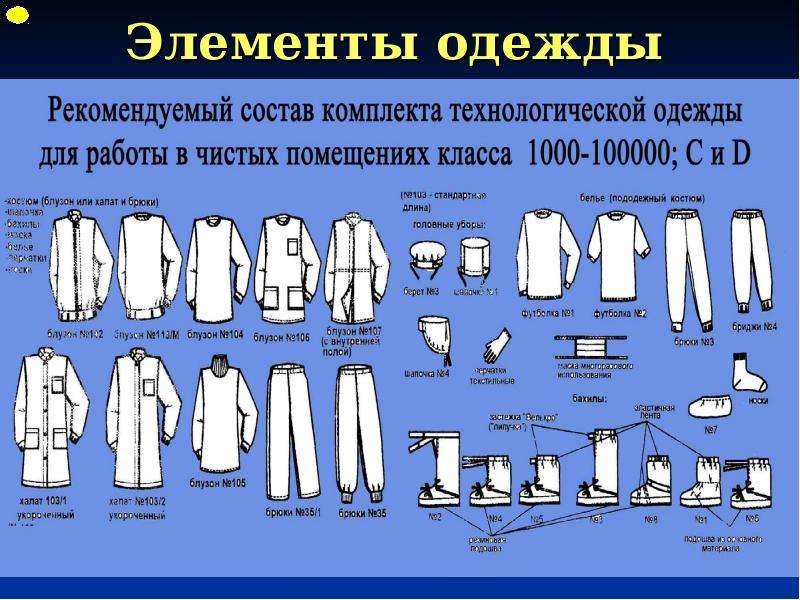
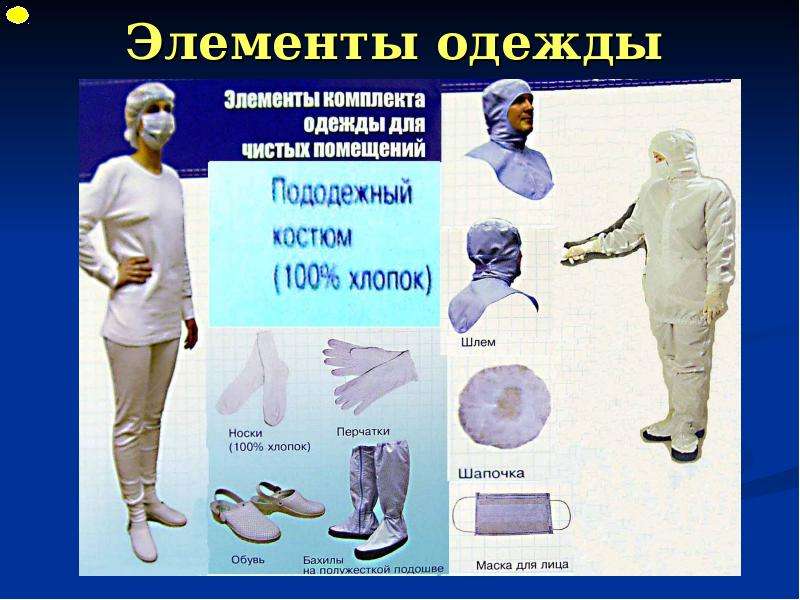
2.16. Одежда входящего в производственные помещения должна соответствовать назначению этого помещения.
2.17. В производственных и складских зонах запрещаются курение, прием пищи или питье, жевание резинки, а также хранение пищевых продуктов, напитков, табачных изделий и личных лекарственных средств. Не допускается любая деятельность, нарушающая правила гигиены в производственных помещениях или других местах, которая может оказать отрицательное влияние на качество продукции.
2.18. Непосредственный контакт операторов с открытой продукцией или любыми деталями оборудования, контактирующими с продукцией, не допускается.
2.19. Персонал должен пройти инструктаж по правилам мытья рук.
2.20. Специальные требования, относящиеся к производству отдельных видов продукции, например стерильных препаратов, даны в Приложениях к настоящему стандарту.
№31 слайд


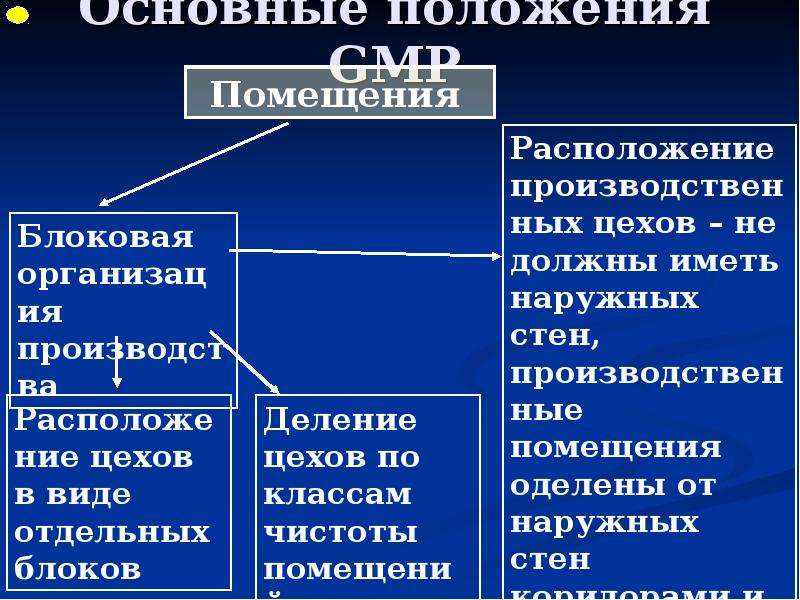
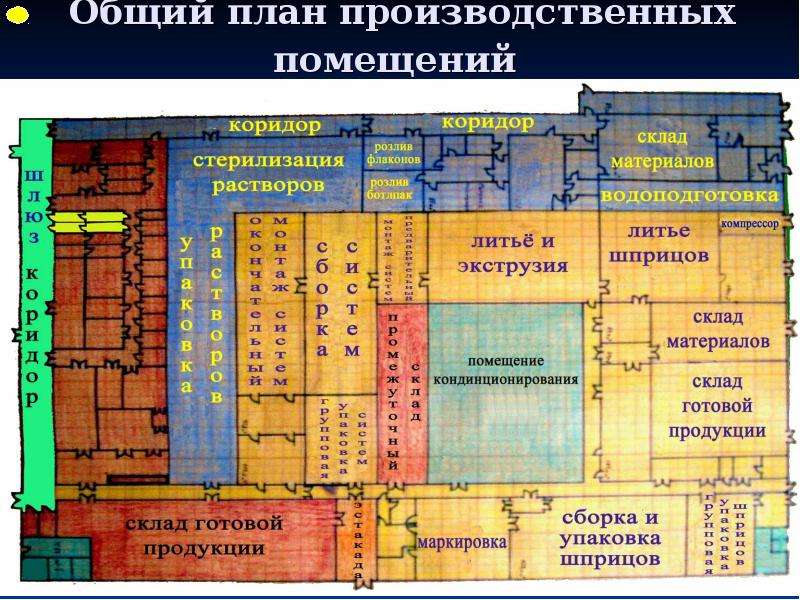
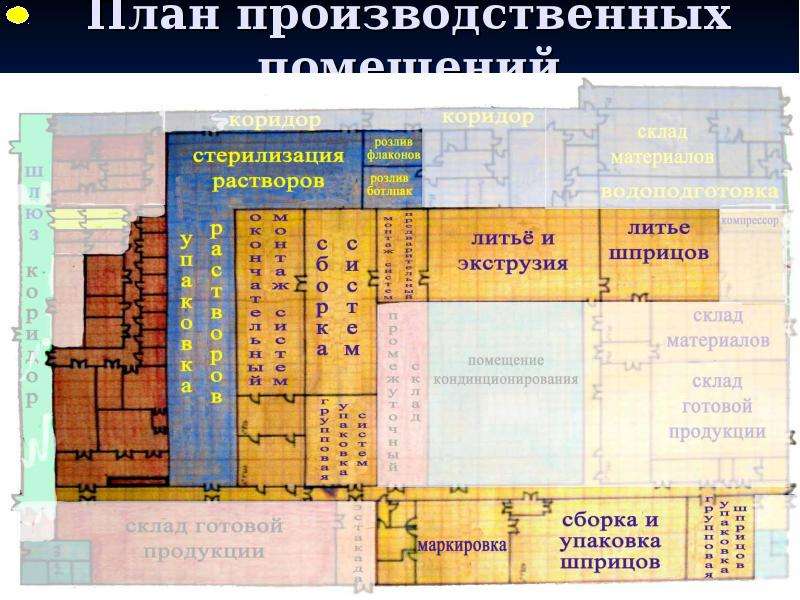
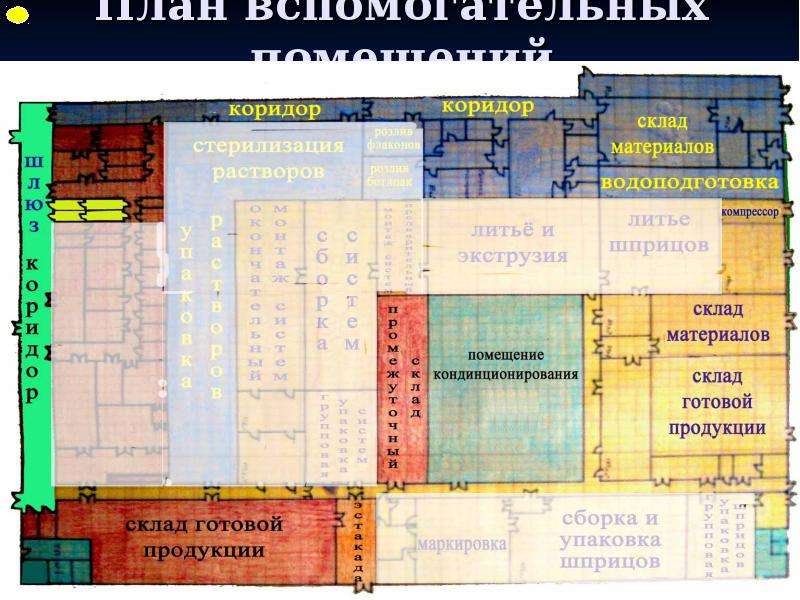
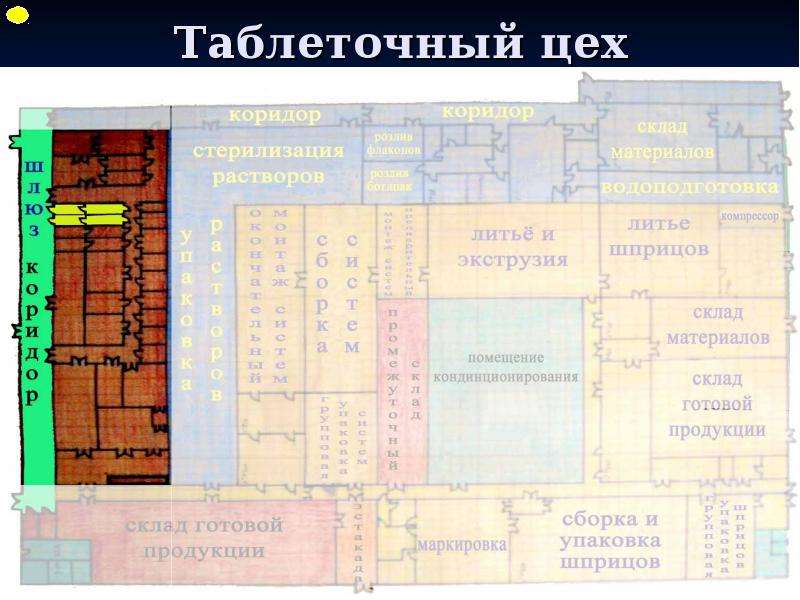
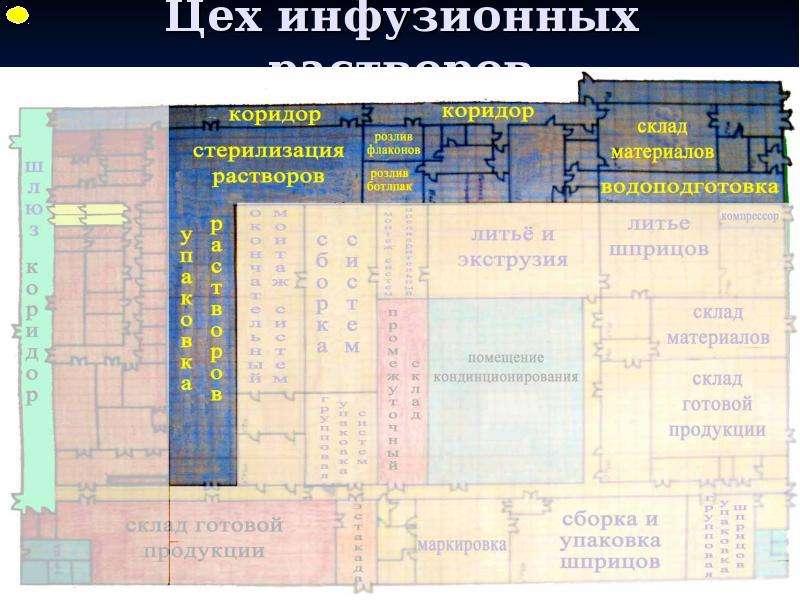
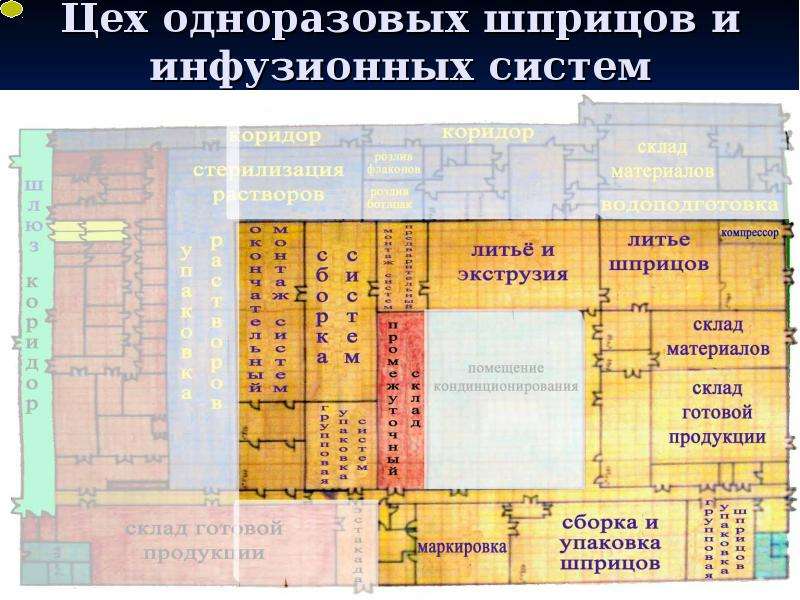
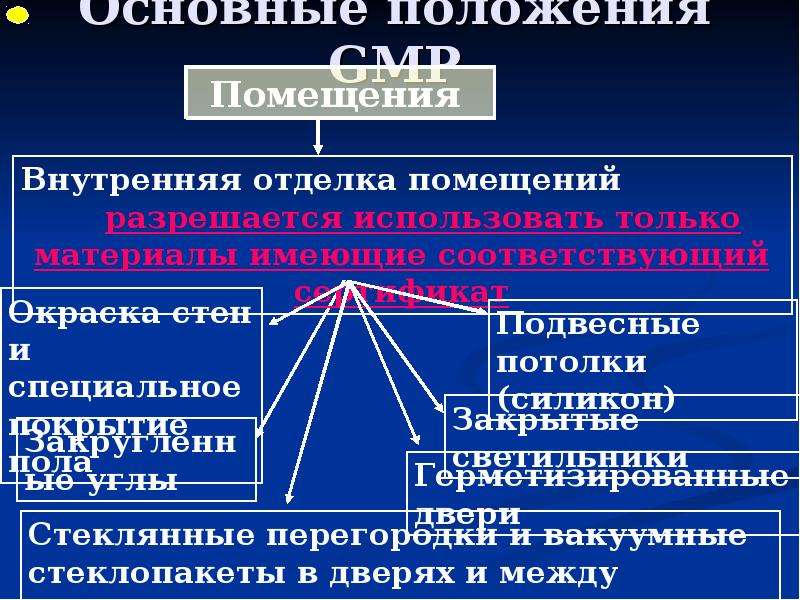
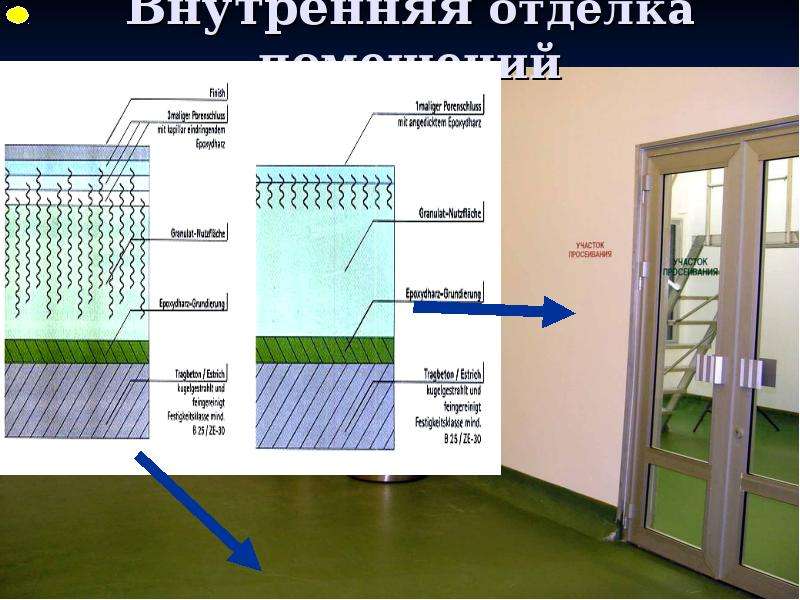
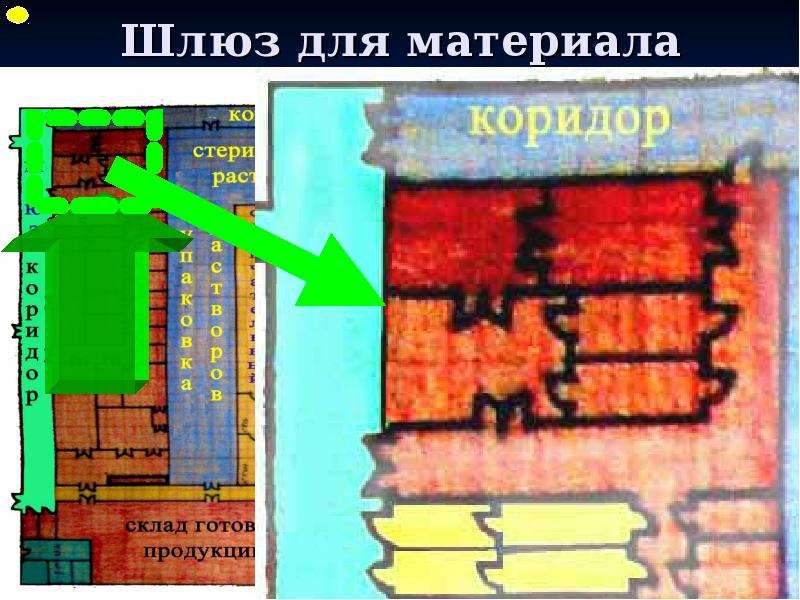
Содержание слайда: 3. Помещения и оборудование
Принципы
Место расположения, проект, строительство, монтаж, оснащение и обслуживание помещений и оборудования должны соответствовать характеру выполняемых работ. Планировка помещений и конструкция оборудования должны минимизировать риск ошибок, предусматривать проведение эффективной уборки и обслуживания с целью предотвращения перекрестного загрязнения, появления пыли или грязи и, в общем случае, устранения любого фактора, ухудшающего качество продукции.
Помещения. Общие положения
3.1. Риск загрязнения материалов и продукции, создаваемый окружающей средой производственных помещений (зданий), должен быть минимальным при условии соблюдения всех мер защиты.
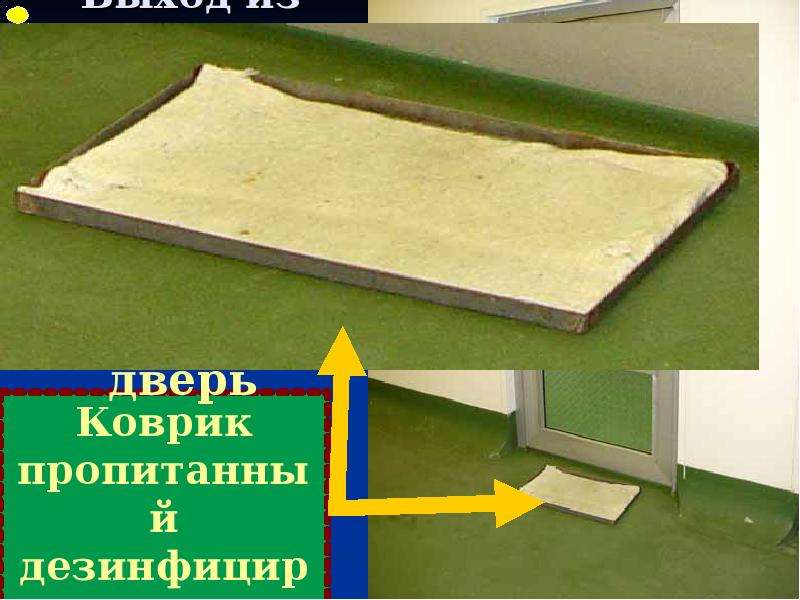
3.2. При эксплуатации помещений следует выполнять меры предосторожности, при этом проведение технического обслуживания и ремонта не должно оказывать вредного влияния на качество продукции. Уборка и дезинфекция помещений должны выполняться в соответствии с письменными инструкциями.
3.3. Освещение, температурный режим, влажность и вентиляция должны соответствовать назначению помещения и не оказывать прямого или косвенного отрицательного влияния на работу оборудования и лекарственные средства во время их изготовления и хранения.
3.4. При проектировании и эксплуатации помещений следует предусмотреть максимальную защиту от проникания в них насекомых или животных.
3.5. В помещения не допускаются лица, не имеющие права доступа в них. Производственные, складские помещения и помещения контроля качества не должны использоваться для сквозного прохода персонала, не работающего в них.
№32 слайд


Содержание слайда: Оборудование
3.34. Конструкция, монтаж и порядок технического обслуживания оборудования должны соответствовать его назначению.
3.35. Работы по ремонту и техническому обслуживанию оборудования не должны оказывать отрицательного влияния на качество продукции.
3.36. Конструкция производственного оборудования должна обеспечивать удобство и возможность его очистки. Операции по очистке оборудования должны выполняться в соответствии с подробными письменными инструкциями. Оборудование следует содержать в сухом и чистом состоянии.
3.37. Инвентарь и материалы для очистки не должны быть источниками загрязнения.
3.38. Оборудование должно быть установлено так, чтобы, по возможности, исключить риск загрязнения или выполнения ошибочных действий.
3.39. Технологическое оборудование не должно влиять на качество продукции и представлять какую-либо опасность. Части технологического оборудования, контактирующие с продукцией, не должны вступать с ней в реакцию, выделять или абсорбировать вещества, оказывающие влияние на качество продукции, в такой степени, чтобы это могло представлять опасность.
3.40. Погрешность приборов для измерения массы и другого измерительного оборудования должна соответствовать производственным и контрольным операциям, в которых они используются.
3.41. Периодичность калибровки (поверки) измерительных, регистрирующих, контрольных приборов и оборудования для измерения массы должна соответствовать указанной в соответствующих методиках. Результаты калибровки (поверки) должны быть документированы.
3.42. Стационарные трубопроводы должны быть маркированы с указанием проходящих по ним веществ и, если требуется, направления потока.
3.43. Системы трубопроводов для воды очищенной и воды для инъекций (дистиллированной, деионизованной и др.) следует обрабатывать в соответствии с инструкциями, в которых указаны уровни действия по микробному загрязнению и требуемые корректирующие меры.
3.44. Неисправное оборудование должно быть изъято из зоны производства и контроля качества или обозначено соответствующим образом.
№67 слайд


Содержание слайда: 4. Документация
Принципы
Правильно составленная документация является важной частью системы обеспечения качества. Четкое оформление документации позволяет предотвратить ошибки, возможные при устном общении, и проследить все этапы производства конкретной серии продукции. Спецификации, промышленные регламенты, инструкции, методики и протоколы серии продукции должны быть оформлены надлежащим образом и не должны содержать ошибок.
Общие положения
4.2. Следует ввести четкую систему разработки, оформления, распространения и пересмотра документов. Должен быть установлен порядок их выдачи, внесения изменений и изъятия. Документы должны соответствовать регистрационному досье.
4.3. Документы должны быть подписаны и утверждены лицами, имеющими право подписи, с указанием даты.
4.4. Документ не должен допускать двусмысленного толкования. Название, вид и назначение документа должны быть четкими и ясными. Документ должен иметь логичную структуру, обеспечивающую простоту его проверки. Копии с документов должны быть ясными и четкими. Способ снятия копий с рабочих документов должен исключать возможность появления ошибок.
№69 слайд


Содержание слайда: документ, содержащий требования к материалам и продуктам, используемым или получаемым при производстве, являющийся основой для оценки качества лекарственных средств;
документ, содержащий требования к материалам и продуктам, используемым или получаемым при производстве, являющийся основой для оценки качества лекарственных средств;
4.10. Спецификации составляются и утверждаются на исходные, упаковочные материалы и готовую продукцию. При необходимости составляются спецификации на промежуточную и нерасфасованную продукцию.
№70 слайд


Содержание слайда: документы, определяющие все используемые исходные материалы и операции по производству и упаковке продукции;
документы, определяющие все используемые исходные материалы и операции по производству и упаковке продукции;
Для каждого вида продукции и размера серии продукции должен быть разработан и утвержден промышленный регламент.
Промышленный регламент включает в себя данные о продукте и технологические инструкции.
Промышленный регламент может содержать инструкции по упаковке и другие разделы.
4.14. Данные о продукте включают в себя:
a) наименование и код в соответствии со спецификацией;
b) описание лекарственной формы, ее дозировки и размер серии;
c) перечень всех исходных материалов с точным наименованием в соответствии с принятой номенклатурой и указанием их кодов, а также указанием всех веществ, которые могут преобразовываться в ходе технологического процесса;
d) ожидаемый выход готовой продукции с указанием допустимых пределов и выход промежуточных продуктов (при необходимости).
№71 слайд


Содержание слайда: 4.15. Технологические инструкции включают в себя:
4.15. Технологические инструкции включают в себя:
a) данные о месте нахождения производства и основном оборудовании;
b) инструкции по подготовке основного оборудования (например, по очистке, сборке, калибровке (поверке), стерилизации) или ссылки на них;
c) подробное постадийное описание технологического процесса (например, по контролю материалов, предварительной обработке, последовательности внесения материалов, времени перемешивания, температуре и т.д.);
d) описание всех видов внутрипроизводственного контроля с указанием допустимых пределов;
e) условия хранения нерасфасованной продукции (в т.ч. требования к упаковке, маркировке) и специальные условия хранения (при необходимости);
f) специальные меры предосторожности
№72 слайд


Содержание слайда: документ, содержащий указания по выполнению отдельных видов операций (например, по очистке, переодеванию, контролю окружающей среды, отбору проб, проведению испытаний, эксплуатации оборудования);
документ, содержащий указания по выполнению отдельных видов операций (например, по очистке, переодеванию, контролю окружающей среды, отбору проб, проведению испытаний, эксплуатации оборудования);
№73 слайд


Содержание слайда: документ, отражающий ход производства каждой серии продукции, в т.ч. разрешение на ее реализацию, и все факторы, влияющие на качество готовой продукции.
документ, отражающий ход производства каждой серии продукции, в т.ч. разрешение на ее реализацию, и все факторы, влияющие на качество готовой продукции.
Протоколы на серию продукции
На каждую серию продукции составляется протокол (протокол на серию продукции). Протоколы хранятся в установленном порядке. Протоколы должны быть составлены в соответствии с промышленными регламентами и технологическими инструкциями. Методика составления протоколов должна исключать ошибки при их заполнении. В протоколе должен быть указан номер произведенной серии продукции.
Перед началом любого технологического процесса необходимо проверить и оформить протокол о том, что оборудование и рабочее место находятся в чистом состоянии, не содержат остатков предыдущего продукта, документации и материалов, не относящихся к данному процессу, и готовы к использованию.
Протоколы на упаковку серии продукции
Для каждой серии или части серии продукции должны составляться протоколы на упаковку, которые хранятся в установленном порядке. Протоколы должны быть основаны на действующих инструкциях по упаковке. Методика составления протоколов должна исключать ошибки при заполнении. В протоколах указываются номер серии и количество нерасфасованной продукции, подлежащей упаковке, а также номер серии и планируемое количество готовой продукции.
№74 слайд


Содержание слайда: 4.5. Документы следует регулярно пересматривать и актуализировать. При пересмотре документа необходимо исключить использование устаревшей версии.
4.5. Документы следует регулярно пересматривать и актуализировать. При пересмотре документа необходимо исключить использование устаревшей версии.
4.6. Не допускается оформление документов в рукописном виде. При необходимости данные в документ вносят четким, разборчивым почерком так, чтобы внесенные данные нельзя было удалить. Для внесения данных в документе должно быть предусмотрено достаточно свободного места.
4.7. При внесении изменений в документы следует проставлять дату внесения изменения и подпись лица, сделавшего это изменение. При необходимости следует указать причину внесения изменений. Внесенные изменения не должны препятствовать восприятию исходного текста.
4.8. Протоколы следует оформлять одновременно с выполнением соответствующих действий таким образом, чтобы можно было проследить все основные операции при производстве лекарственных средств. Протоколы следует хранить не менее одного года со дня окончания срока годности готовой продукции.
4.9. Запись данных может выполняться с использованием электронной техники, фотографирования или других средств, обеспечивающих надежное хранение информации в соответствии с инструкциями по использованию этих средств. Следует проверять точность записей. При ведении документации в электронном виде право доступа или изменения данных в компьютере могут иметь только лица с соответствующими полномочиями, при этом следует вести протокол изменений и изъятий. Для ограничения доступа к электронной базе данных следует использовать систему паролей или других средств; внесение особо важных данных должно проверяться независимым способом. При хранении протоколов на серии продукции в электронном виде для защиты от потери информации необходимо создавать резервные копии на магнитных носителях, микрофильмах, бумаге или иных надежных средствах. В период хранения эти данные должны быть доступными.
№75 слайд


Содержание слайда: 5. Производство
Принципы
Для получения продукции требуемого качества технологические операции следует выполнять согласно промышленному регламенту и соответствующим инструкциям, требованиям настоящего стандарта, нормативных документов и регистрационного досье.
Общие положения
5.1. Производственный процесс и его контроль должны выполняться квалифицированным персоналом.
5.2. Все операции с материалами и продукцией (например, приемка, карантин, отбор проб, хранение, маркировка, подготовка, приготовление, упаковка и отгрузка) должны выполняться согласно письменным инструкциям или методикам и, при необходимости, протоколироваться.
5.3. Все поступающие материалы должны быть проверены на соответствие заказу. Тару и упаковку следует очищать и маркировать.
5.4. Факты повреждения тары и упаковки, которые могут оказать отрицательное влияние на качество материалов, следует расследовать и протоколировать с последующим сообщением в отдел контроля качества.
5.5. Поступающие материалы и произведенная готовая продукция должны немедленно помещаться в карантин, действующий по принципу раздельного хранения или за счет организационных мер, и содержаться в нем до получения разрешения на использование или отгрузку.
5.6. Приемка промежуточной и нерасфасованной продукции выполняется по правилам, действующим для исходных материалов.
5.7. Все материалы и продукцию следует хранить в соответствующих условиях, определяемых производителем, в порядке, обеспечивающем разделение серий продукции и ее оборот на складе.
№76 слайд


Содержание слайда: 5.8. Для гарантии отсутствия отклонений за допустимые пределы следует обеспечить контроль выхода продукции и количественное сопоставление его с данными промышленного регламента.
5.8. Для гарантии отсутствия отклонений за допустимые пределы следует обеспечить контроль выхода продукции и количественное сопоставление его с данными промышленного регламента.
5.9. Не допускается одновременное или последовательное проведение операций с различными продуктами в одном и том же помещении при отсутствии защиты от риска перепутывания или перекрестного загрязнения.
5.10. Продукция и материалы должны быть защищены от микробного и других видов загрязнений на всех этапах производства.
5.11. При работе с сухими материалами и продуктами необходимо принимать особые меры предосторожности по предотвращению образования и распространения пыли, особенно при работе с сильнодействующими и сенсибилизирующими веществами.
5.12. В ходе выполнения технологического процесса на всех материалах, упаковках с нерасфасованной продукцией, основном оборудовании и помещениях должны быть обозначения (маркировка) с указанием производимой продукции или материала, его дозировкой (при необходимости) и номера серии. При необходимости следует указывать стадию технологического процесса.
5.13. Обозначения (маркировка) на упаковке, оборудовании или помещениях должны быть четкими, однозначными, установленной формы. Кроме применения буквенных обозначений рекомендуется использовать цветовую маркировку, указывающую статус продукции (например, "Карантин", "Принято", "Отклонено", "Чистое" и т.п.).
5.14. Следует контролировать правильность соединения трубопроводов и другого оборудования, служащего для транспортирования продукции из одной зоны в другую.
5.15. Не допускается отклонение от инструкций. При необходимости письменное разрешение на отклонение от инструкций должно быть получено от компетентных лиц и отдела контроля качества.
5.16. В производственные помещения может входить только персонал, имеющий право доступа в них.
5.17. Как правило, в помещениях и на оборудовании, предназначенных для производства лекарственных средств, не допускается изготовление продукции немедицинского назначения.
№79 слайд


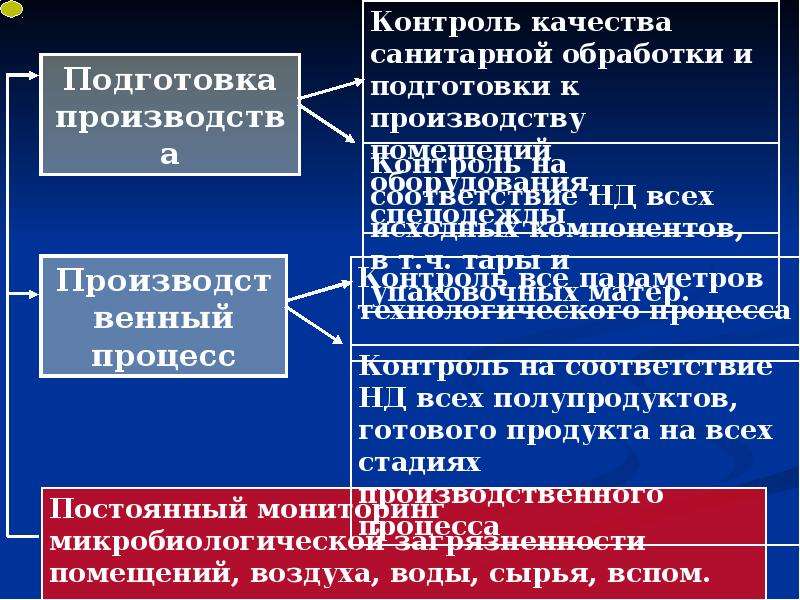
Содержание слайда: 6. Контроль качества
Принципы
Контроль качества связан с отбором проб, проведением испытаний и проверок на соответствие требованиям спецификаций, инструкций и других документов, с организацией работы, документированием и процедурами выдачи разрешений на реализацию. Цель контроля качества - не допустить к использованию или реализации материалы или продукцию, не удовлетворяющие требованиям качества. Служба контроля качества выполняет исследования, проверки и участвует в принятии любых решений, касающихся качества продукции. Основополагающим принципом обеспечения контроля качества является независимость отдела контроля качества (раздел 1).
Общие положения
6.1. На каждом предприятии, выпускающем лекарственные средства, должен быть отдел контроля качества, независимый от других подразделений. Руководитель этого отдела должен иметь необходимый опыт и квалификацию. К отделу контроля качества относятся одна или несколько контрольных лабораторий. Для выполнения своих функций отдел должен быть обеспечен всеми необходимыми ресурсами.
6.2. Основные обязанности начальника отдела контроля качества изложены в разделе 2. На отдел возлагаются также обязанности по разработке, аттестации (валидации), внедрению всех инструкций (методик) по контролю качества; хранению контрольных образцов материалов и продукции; контролю правильности маркировки упаковок с материалами и продукцией; обеспечению контроля стабильности продукции; участию в расследовании рекламаций, связанных с качеством продукции, и т.п. Все эти функции должны выполняться в соответствии с утвержденными инструкциями с оформлением протоколов (при необходимости).
6.3. При оценке качества готовой продукции следует рассматривать все сопутствующие факторы, в т.ч. условия производства, результаты внутрипроизводственного контроля, анализ производственной документации (в т.ч. документации на упаковку), соответствие спецификациям на готовую продукцию и состояние окончательной упаковки готовой продукции.
6.4. Сотрудники отдела контроля качества должны иметь доступ в производственные зоны для отбора проб и проведения анализа.
№80 слайд


Содержание слайда: К документации по контролю качества относятся:
К документации по контролю качества относятся:
- спецификации;
- методики отбора проб;
- методики и протоколы проведения испытаний (в т.ч. аналитические операционные листы и/или лабораторные журналы);
- аналитические отчеты и/или паспорта;
- результаты контроля окружающей среды в производственных помещениях;
- протоколы аттестации (валидации) аналитических методов;
- методики и протоколы калибровки (поверки) приборов и обслуживания аппаратуры.
№88 слайд


Содержание слайда: 7. Работа по контрактам на производство
продукции и проведение анализов
Принципы
Во избежание разночтений, способных привести к ухудшению качества продукции или выполнения работ, следует тщательно составлять, согласовывать и контролировать выполнение контрактов на производство продукции и проведение анализов. Контракт между заказчиком и исполнителем должен быть составлен в письменной форме с указанием четко определенных обязанностей каждой из сторон. Контракт должен устанавливать порядок действий и ответственность Уполномоченного лица за выдачу разрешения на реализацию каждой серии продукции.
Примечание. Настоящий раздел рассматривает только ответственность производителей за выполнение требований настоящего стандарта.
Общие положения
7.1. Контракт должен быть составлен в письменной форме и должен включать в себя перечень производственных операций и/или анализов, выполняемых на основании контракта, и проводимых технических мероприятий.
7.2. Выполнение контракта на производство и/или проведение анализов, в т.ч. с учетом предложенных изменений технического или другого характера, должно соответствовать требованиям нормативных документов на производство и регистрационного досье на данную продукцию.
№89 слайд


Содержание слайда: 8. Рекламации и отзыв продукции
Принципы
Все рекламации и информация, касающиеся продукции с предполагаемыми нарушениями качества, должны быть тщательно проанализированы в соответствии с инструкциями. На предприятии должна быть создана система быстрого и эффективного отзыва с рынка продукции с явными или предполагаемыми нарушениями качества в следующих случаях:
a) продукция оказалась опасной при обычных условиях применения;
b) продукция терапевтически неэффективна;
c) по качественному и количественному составу продукция не соответствует составу, указанному в регистрационном досье;
d) контроль готового лекарственного средства и/или ингредиентов, контроль промежуточных стадий производственного процесса не проводился или не выполнялись требования или обязательства, относящиеся к условиям выдачи разрешения на производство лекарственных средств;
e) при других непредвиденных обстоятельствах.
№90 слайд


Содержание слайда: 9. Самоинспекция
Принципы
Самоинспекция должна проводиться с целью проверки выполнения предприятием требований настоящего стандарта и принятия необходимых мер по устранению недостатков.
9.1. С целью выполнения принципов обеспечения качества вопросы, связанные с работой персонала, содержанием помещений, эксплуатацией оборудования, документацией, производством, контролем качества и реализацией лекарственных средств, мероприятиями по работе с рекламациями и отзыву продукции, а также проведению самоинспекций, должны регулярно рассматриваться в соответствии с утвержденной программой.
9.2. Самоинспекция должна проводиться независимо и тщательно специально назначенным лицом (лицами) из штата предприятия. Полезно проводить независимый аудит экспертами сторонних организаций.
9.3. Результаты проведения самоинспекций должны быть оформлены документально. Протоколы, составленные по результатам проведения самоинспекции, должны включать в себя всю полученную информацию и необходимые корректирующие действия (при необходимости). Действия, принимаемые по результатам самоинспекции, следует оформлять документально.
№102 слайд


Содержание слайда: ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ Государственное образовательное учреждение высшего профессионального образования «ПЯТИГОРСКАЯ ГОСУДАРСТВЕННАЯ ФАРМАЦЕВТИЧЕСКАЯ АКАДЕМИЯ Федерального агентства по здравоохранению и социальному развитию» ГОУ ВПО Пятигорская ГФА Росздрава
«Pjatigorsk state pharmaceutical academy (PSPA)»
Организация крупного фармпроизводства в соответствии со стандартом GMP
Учебное пособие на компакт-диске
Авторы: проф. Погорелов В.И., доц. Шевченко А.М., асс. Пантюхин А.В., Петров А.Ю.
Компьютерная графика, фото- и видеомонтаж, дизайн: Пантюхин А.В.
Учебное пособие на компакт-диске « Организация крупного фармпроизводства в соответствии со стандартом GMP» соответствует действующей примерной программе по дисциплине «Фармацевтическая технология» (специальность 060180 «Фармация»), утвержденной департаментом образовательных программ и стандартов профессионального образования Министерства образования России (М.: 2002 г.).
Предназначено для студентов фармацевтических ВУЗов и фармацевтических факультетов ВУЗов РФ. Может быть использовано для слушателей факультетов повышения квалификации и работниками фармпроизводств при обучении правилам работы в условиях GMP.
Формат: презентация
Объем: 145 Мб, слайдов 103, видеофрагментов 14, цифровых фото 67, анимированных схем 19
Пятигорская государственная фармацевтическая академия
357532, г. Пятигорск, пр. Калинина, 11.
Запись на лазерные диски
Скачать все slide презентации Организация крупного фармпроизводства в соответствии со стандартом GMP одним архивом:
Похожие презентации
-
 Организация технического обслуживания и диагностики с разработкой шиномонтажного стенда
Организация технического обслуживания и диагностики с разработкой шиномонтажного стенда -
 Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем
Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем -
 Совершенствование организации и технологии ремонта МТП в условиях ОАО «Птицефабрика Атемарская»
Совершенствование организации и технологии ремонта МТП в условиях ОАО «Птицефабрика Атемарская» -
 Организация а технологического процесса обслуживания и ремонта кривошипно-шатунного механизма двигателя автомобиля Kalina1119
Организация а технологического процесса обслуживания и ремонта кривошипно-шатунного механизма двигателя автомобиля Kalina1119 -
 Организация и планирование ТО и ремонта автомобилей с разработкой технологии ремонта картеров КПП
Организация и планирование ТО и ремонта автомобилей с разработкой технологии ремонта картеров КПП -
 Организация транспортного процесса перевозки грузов в условиях ООО «РусМетСтрой» г. Рязань
Организация транспортного процесса перевозки грузов в условиях ООО «РусМетСтрой» г. Рязань -
 ВКР: Организация ремонта электрооборудования в условиях ЗАО «Белый Ручей»
ВКР: Организация ремонта электрооборудования в условиях ЗАО «Белый Ручей» -
 Организация и выполнение слесарных работ
Организация и выполнение слесарных работ -
 Организация и управление производством технического обслуживания и ремонта автомобилей
Организация и управление производством технического обслуживания и ремонта автомобилей -
 Организация подъёмных систем в горном туризме
Организация подъёмных систем в горном туризме