Презентация Физико-химические основы горения и взрыва онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Физико-химические основы горения и взрыва абсолютно бесплатно. Урок-презентация на эту тему содержит всего 67 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Физика » Физико-химические основы горения и взрыва
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:67 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:173.41 kB
- Просмотров:108
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: Горение — один из сложных физико-химических процессов, с которым встречался человек еще на пороге развития цивилизации.
Горение — один из сложных физико-химических процессов, с которым встречался человек еще на пороге развития цивилизации.
С тех пор оно используется человечеством и является одной из древнейших технологий. Процессами горения в настоящее время обеспечивается около 90% всей энергии, потребляемой нашей цивилизацией (выработка электроэнергии, получение теплоты, работа транспорта и т.д.). Очень часто, особенно в неуправляемых условиях, горение может завершаться взрывом.
№3 слайд


Содержание слайда: Процесс горения как физическое явление изучен достаточно полно, но дать ему единое определение трудно. Все зависит от того, с какой позиции подходят к его изучению — энергетической, теплофизической и т.д. Общим во всех определениях является то, что в основе процессов горения лежат быстротекущие экзотермические обратимые окислительно-восстановительные реакции, которые подчиняются законам химической кинетики, химической термодинамики, фундаментальным физическим законам.
Процесс горения как физическое явление изучен достаточно полно, но дать ему единое определение трудно. Все зависит от того, с какой позиции подходят к его изучению — энергетической, теплофизической и т.д. Общим во всех определениях является то, что в основе процессов горения лежат быстротекущие экзотермические обратимые окислительно-восстановительные реакции, которые подчиняются законам химической кинетики, химической термодинамики, фундаментальным физическим законам.
№4 слайд


Содержание слайда: Российским физикам (Семенов Н.Н., Зельдович Я.Б. и др.) в первую очередь принадлежит разработка основных вопросов теории горения и взрыва (цепное и тепловое самовоспламенение, распространение пламени, возникновение и распространение детонационной волны и т.д.).
Российским физикам (Семенов Н.Н., Зельдович Я.Б. и др.) в первую очередь принадлежит разработка основных вопросов теории горения и взрыва (цепное и тепловое самовоспламенение, распространение пламени, возникновение и распространение детонационной волны и т.д.).
№5 слайд


Содержание слайда: Для специалистов, занимающихся прекращением горения на пожаре, инженерно-технической экспертизой по расследованию возникновения, распространения горения и взрыва, можно дать следующее определение процесса горения.
Для специалистов, занимающихся прекращением горения на пожаре, инженерно-технической экспертизой по расследованию возникновения, распространения горения и взрыва, можно дать следующее определение процесса горения.
№6 слайд


Содержание слайда: Горение — сложный физико-химический процесс, при котором горючие вещества и материалы под воздействием высоких температур вступают в химическое взаимодействие с окислителем, превращаясь в продукты горения, и который сопровождается интенсивным выделением теплоты и световым излучением.
Горение — сложный физико-химический процесс, при котором горючие вещества и материалы под воздействием высоких температур вступают в химическое взаимодействие с окислителем, превращаясь в продукты горения, и который сопровождается интенсивным выделением теплоты и световым излучением.
№7 слайд


Содержание слайда: Химической составляющей данного процесса является окислительно-восстановительная реакция, протекающая между горючим и окислителем:
Химической составляющей данного процесса является окислительно-восстановительная реакция, протекающая между горючим и окислителем:
Г + O→ПГ + Q,
где Г — горючее; О — окислитель; ΠГ — продукты горения; Q — выделяющая тепловая энергия, кДж/моль.
№9 слайд


Содержание слайда: Восстановителями являются: металлы, Η2, С, Si, бескислородные кислоты (НСl, HBr, HJ, H2S) и их соли, ΝΗ3 др.
Восстановителями являются: металлы, Η2, С, Si, бескислородные кислоты (НСl, HBr, HJ, H2S) и их соли, ΝΗ3 др.
Окислителями, атомы которых принимают электроны, являются: O2, O3, галогены (Сl2, F2, Br2, J2), оксиды металлов, имеющих переменную валентность, кислородосодержашие кислоты (НСlO — хлорноватистая, НСlO3 —хлорноватая, НСlO4 — хлорная, H2SO4, HNO3, ΗMnO4 и др.) и их соли.
№10 слайд


Содержание слайда: При расчете процесса горения (расчет массы сгоревшего горючего, объема окислителя на горение, объема и состава выделившихся продуктов горения, теплоты и температуры горения) необходимо использовать правильно записанное уравнение реакции горения.
При расчете процесса горения (расчет массы сгоревшего горючего, объема окислителя на горение, объема и состава выделившихся продуктов горения, теплоты и температуры горения) необходимо использовать правильно записанное уравнение реакции горения.
4Аl(Г) + 3О2(O) → 2Аl2О3(ПГ) + Q
Первым уравниваем атомы С, затем атомы Н, в последнюю очередь атомы О (проверку ведем по О).
№11 слайд


Содержание слайда: При горении в воздухе на один моль кислорода, участвующего в реакциях окисления, приходится примерно 3,76 моля азота, химически не участвующего в реакциях горения. Однако присутствие азота в зоне реакции горения обязательно следует учитывать, газ как он участвует в физических процессах.
При горении в воздухе на один моль кислорода, участвующего в реакциях окисления, приходится примерно 3,76 моля азота, химически не участвующего в реакциях горения. Однако присутствие азота в зоне реакции горения обязательно следует учитывать, газ как он участвует в физических процессах.
№12 слайд


Содержание слайда: Во-первых, на его нагревание в зоне горения затрачивается большое количество теплоты, выделяемой при горении, чем в значительной степени определяется температура продуктов горения.
Во-первых, на его нагревание в зоне горения затрачивается большое количество теплоты, выделяемой при горении, чем в значительной степени определяется температура продуктов горения.
Во-вторых, его присутствие в зоне протекания химических реакций окисления горючего влияет на их скорость, так как азот воздуха выступает в роли нейтрального разбавителя реагирующих компонентов горючей смеси.
№13 слайд


Содержание слайда: Уравнение реакции горения в воздухе следует записывать, прибавляя в левую и правую части этих уравнении по 3,76 моля азота на каждый реагирующий моль кислорода.
Уравнение реакции горения в воздухе следует записывать, прибавляя в левую и правую части этих уравнении по 3,76 моля азота на каждый реагирующий моль кислорода.
Например, уравнение реакции горения пропанов в воздухе можно записать так:
C3H8 + 5(O2 + 3,76N2) = 3СO2 + 4Н2O + 18,8N2 + Q
№14 слайд


Содержание слайда: Для осуществления процесса горения по этому уравнению необходимо, чтобы в зоне горения на 1 м3 горючего газа приходилось примерно 23,8 м3 воздуха (в которых и будут содержаться требуемые 5 м3 кислорода) и чтобы горючей смеси (или ее части) был сообщен тепловой импульс достаточной мощности для начала реакции горения. Тогда в результате полного сгорания 1 м3 пропана образуется более 25,8 м3 продуктов горения (смеси двуокиси углерода, паров воды) и азота.
Для осуществления процесса горения по этому уравнению необходимо, чтобы в зоне горения на 1 м3 горючего газа приходилось примерно 23,8 м3 воздуха (в которых и будут содержаться требуемые 5 м3 кислорода) и чтобы горючей смеси (или ее части) был сообщен тепловой импульс достаточной мощности для начала реакции горения. Тогда в результате полного сгорания 1 м3 пропана образуется более 25,8 м3 продуктов горения (смеси двуокиси углерода, паров воды) и азота.
№15 слайд


Содержание слайда: Для количественного описания горения недостаточно рассматривать этот процесс только в виде конечного уравнения реакции горения, отражающего состав горючей смеси, состав основных продуктов полного сгорания и количество выделившейся тепловой энергии.
Для количественного описания горения недостаточно рассматривать этот процесс только в виде конечного уравнения реакции горения, отражающего состав горючей смеси, состав основных продуктов полного сгорания и количество выделившейся тепловой энергии.
№16 слайд


Содержание слайда: Горение углеводородов является чрезвычайно сложным процессом, протекающим через ряд последовательных стадий.
Горение углеводородов является чрезвычайно сложным процессом, протекающим через ряд последовательных стадий.
В составе продуктов окисления содержатся СО, СO2, Н2O, спирты, альдегиды, кислоты, сложные эфиры, кетоны и ряд нестойких перекисей различного состава: RCO(OO), RCH2OOH, RCO(OOH) и др.
№17 слайд


Содержание слайда: Для объяснения сложных процессов окисления различных видов топлива в 1897г. А.Н. Бах предложил пероксидную теорию. В том же году независимо от него немецкий ученый К. Энглер выдвинул те же положения пероксидной теории.
Для объяснения сложных процессов окисления различных видов топлива в 1897г. А.Н. Бах предложил пероксидную теорию. В том же году независимо от него немецкий ученый К. Энглер выдвинул те же положения пероксидной теории.
№18 слайд


Содержание слайда: Согласно этой теории молекулы кислорода перед вступлением в реакцию должны активироваться. Они либо распадаются на отдельные атомы, обладающие высокой реакционной способностью, либо присоединяются к окисляемому веществу, образуя перекисные соединения — пероксиды. А.Н. Бах и К. Энглер, считая второй случай более вероятным, подробно рассмотрели его в своих работах.
Согласно этой теории молекулы кислорода перед вступлением в реакцию должны активироваться. Они либо распадаются на отдельные атомы, обладающие высокой реакционной способностью, либо присоединяются к окисляемому веществу, образуя перекисные соединения — пероксиды. А.Н. Бах и К. Энглер, считая второй случай более вероятным, подробно рассмотрели его в своих работах.
№19 слайд


Содержание слайда: При замещении двух атомов водорода в перекиси водорода органическими радикалами образуются органические перекиси, при замещении одного — гидроперекиси.
При замещении двух атомов водорода в перекиси водорода органическими радикалами образуются органические перекиси, при замещении одного — гидроперекиси.
№20 слайд


Содержание слайда: Перекиси и гидроперекиси, образующиеся из различных классов органических соединений, в большинстве случаев легко разлагаются с вспышкой или взрывом. Энергия разрыва в связи —О—О— в пероксидах и гидропероксидах значительно ниже (125 – 167 кДж/моль), чем в молекуле кислорода (488,3 кДж/моль). При нагревании и механических воздействиях они легко распадаются с образованием радикалов.
Перекиси и гидроперекиси, образующиеся из различных классов органических соединений, в большинстве случаев легко разлагаются с вспышкой или взрывом. Энергия разрыва в связи —О—О— в пероксидах и гидропероксидах значительно ниже (125 – 167 кДж/моль), чем в молекуле кислорода (488,3 кДж/моль). При нагревании и механических воздействиях они легко распадаются с образованием радикалов.
№21 слайд


Содержание слайда: Образующиеся при распаде перекисей радикалы являются активными центрами реакции окисления. Начальная температура окисления (tо) зависит от структуры молекул горючего вещества и его молярной массы (М). Чем больше М, тем меньше температура окисления. В гомологическом ряду предельных углеводородов наиболее устойчивым к окислению является метан (tо > 400 °С), tо октана равна 250 °С.
Образующиеся при распаде перекисей радикалы являются активными центрами реакции окисления. Начальная температура окисления (tо) зависит от структуры молекул горючего вещества и его молярной массы (М). Чем больше М, тем меньше температура окисления. В гомологическом ряду предельных углеводородов наиболее устойчивым к окислению является метан (tо > 400 °С), tо октана равна 250 °С.
№22 слайд


Содержание слайда: Окисление ароматических углеводородов происходит при более высоких температурах, чем предельных и непредельных. Вещества с низкой начальной температурой (tо) представляют наибольшую пожарную опасность, так как они способны к окислению и самонагреванию уже при низких температурах. Накопление в веществах пероксидных соединений увеличивает потенциальную пожарную опасность веществ.
Окисление ароматических углеводородов происходит при более высоких температурах, чем предельных и непредельных. Вещества с низкой начальной температурой (tо) представляют наибольшую пожарную опасность, так как они способны к окислению и самонагреванию уже при низких температурах. Накопление в веществах пероксидных соединений увеличивает потенциальную пожарную опасность веществ.
№23 слайд


Содержание слайда: Пероксидная теория позволяет уяснить механизм окислительного действия кислорода на органические соединения в начальной стадии окисления.
Пероксидная теория позволяет уяснить механизм окислительного действия кислорода на органические соединения в начальной стадии окисления.
Однако эта теория не в состоянии объяснить некоторые особенности процесса окисления, предшествующего видимой реакции окисления, резкое действие следов примесей на скорость процесса и др. Эти особенности процесса окисления объяснены теорией цепных реакций.
№24 слайд


Содержание слайда: Механизм химической реакции горения необходимо рассматривать с позиций основных законов химической кинетики. Для кинетического описания процесса горения такого простого топлива, как водород (суммарная реакция 2Н2 + О2 → 2Н2О), требуется механизм, включающий около сорока элементарных реакций, метана — значительно больше. В случае самовоспламенения дизельного топлива (основной компонент цетан — С16Н34) суммарный процесс включает несколько тысяч элементарных реакций.
Механизм химической реакции горения необходимо рассматривать с позиций основных законов химической кинетики. Для кинетического описания процесса горения такого простого топлива, как водород (суммарная реакция 2Н2 + О2 → 2Н2О), требуется механизм, включающий около сорока элементарных реакций, метана — значительно больше. В случае самовоспламенения дизельного топлива (основной компонент цетан — С16Н34) суммарный процесс включает несколько тысяч элементарных реакций.
№25 слайд


Содержание слайда: Однако скорость процесса определяется лишь несколькими элементарными реакциями, контролирующими его лимитирующие стадии (протекающие с наименьшей скоростью), т.е. многими элементарными реакциями можно пренебречь в зависимости от решаемой задачи.
Однако скорость процесса определяется лишь несколькими элементарными реакциями, контролирующими его лимитирующие стадии (протекающие с наименьшей скоростью), т.е. многими элементарными реакциями можно пренебречь в зависимости от решаемой задачи.
№28 слайд


Содержание слайда: Согласно закону Эйнштейна при фотохимических процессах каждая вступающая в реакцию молекула поглощает один квант лучистой энергии. Так как грамм-молекула вещества содержит 6,06 · 1023 молекул, то для того чтобы в реакцию вступили все молекулы, они должны по закону Эйнштейна поглотить 6,06 · 1023 квантов лучистой энергии.
Согласно закону Эйнштейна при фотохимических процессах каждая вступающая в реакцию молекула поглощает один квант лучистой энергии. Так как грамм-молекула вещества содержит 6,06 · 1023 молекул, то для того чтобы в реакцию вступили все молекулы, они должны по закону Эйнштейна поглотить 6,06 · 1023 квантов лучистой энергии.
Однако при исследовании широкого ряда фотохимических реакций были установлены отклонения от этого закона как в сторону уменьшения, так и в сторону значительного увеличения.
№29 слайд


Содержание слайда: Например, поглощение смесью водорода с хлором только одного кванта лучистой энергии при длине волны 4000—4360 Å может вызвать реакцию не одной, а примерно 100 000 молекул, при этом реакции протекает за доли секунды и происходит взрыв. Эта чисто фотохимическая реакция является типичной реакцией горения.
Например, поглощение смесью водорода с хлором только одного кванта лучистой энергии при длине волны 4000—4360 Å может вызвать реакцию не одной, а примерно 100 000 молекул, при этом реакции протекает за доли секунды и происходит взрыв. Эта чисто фотохимическая реакция является типичной реакцией горения.
№30 слайд


Содержание слайда: Изучая механизм данного химического процесса, М. Боденштейн разработал новую теорию для таких быстропротекающих реакций. Согласно этой теории возбужденная молекула, вступая в химическую реакцию, дает новые возбужденные молекулы, которые, прореагировав, дают, в свою очередь, ряд новых возбужденных молекул и т.д. Такие реакции получили название цепных реакций.
Изучая механизм данного химического процесса, М. Боденштейн разработал новую теорию для таких быстропротекающих реакций. Согласно этой теории возбужденная молекула, вступая в химическую реакцию, дает новые возбужденные молекулы, которые, прореагировав, дают, в свою очередь, ряд новых возбужденных молекул и т.д. Такие реакции получили название цепных реакций.
№31 слайд


Содержание слайда: Цепными называются реакции, протекающие через ряд промежуточных стадий, в которых образуются соединения, обладающие избыточной энергией, необходимой для дальнейшего развития последующих быстропротекающих реакций.
Цепными называются реакции, протекающие через ряд промежуточных стадий, в которых образуются соединения, обладающие избыточной энергией, необходимой для дальнейшего развития последующих быстропротекающих реакций.
№33 слайд


Содержание слайда: Активный радикал может представлять собой атом, молекулу или группу молекул. Иными словами, цепными называются такие реакции, при которых наблюдается регенерация активных частиц. Они могут быть разветвляющимися и неразветвляющимися.
Активный радикал может представлять собой атом, молекулу или группу молекул. Иными словами, цепными называются такие реакции, при которых наблюдается регенерация активных частиц. Они могут быть разветвляющимися и неразветвляющимися.
№34 слайд


Содержание слайда: Примером неразветвляющейся цепной реакции является реакция взаимодействия хлора с водородом.
Примером неразветвляющейся цепной реакции является реакция взаимодействия хлора с водородом.
С12 + hv = Сl• + Сl•
Сl• + Н2 → НС1 + H•
H• +С12 → НС1 + Сl•
Сl• + Н2 → НС1 + H• и т.д.
№35 слайд


Содержание слайда: Неразветвляюшаяся цепная реакция может самоускоряться только при повышенных температурах, а разветвленная — при постоянной температуре.
Неразветвляюшаяся цепная реакция может самоускоряться только при повышенных температурах, а разветвленная — при постоянной температуре.
№36 слайд


Содержание слайда: Кинетика цепных реакций получила развитие в работах зарубежных и советских ученых и имеет большое значение при объяснении горения и взрывов газовых смесей и взрывчатых веществ. В 1927 г. теория цепных реакций была широко развита и подтверждена многочисленными работами советских ученых школы академика Н.Н. Семенова, а также чуть позже в лаборатории Кембриджского университета школой С. Хиншельвуда.
Кинетика цепных реакций получила развитие в работах зарубежных и советских ученых и имеет большое значение при объяснении горения и взрывов газовых смесей и взрывчатых веществ. В 1927 г. теория цепных реакций была широко развита и подтверждена многочисленными работами советских ученых школы академика Н.Н. Семенова, а также чуть позже в лаборатории Кембриджского университета школой С. Хиншельвуда.
№37 слайд


Содержание слайда: Радикально-цепные реакции лежат в основе процессов горения. Общие закономерности таких реакций детально изучены. Схема наиболее важных реакций разветвленной цепной реакции, лежащей и основе воспламенения водородо-кислородной смеси, может быть представлена следующим образом:
Радикально-цепные реакции лежат в основе процессов горения. Общие закономерности таких реакций детально изучены. Схема наиболее важных реакций разветвленной цепной реакции, лежащей и основе воспламенения водородо-кислородной смеси, может быть представлена следующим образом:
№38 слайд


Содержание слайда: (0) Н2 + O2 → 2OН• зарождение цепи;
(0) Н2 + O2 → 2OН• зарождение цепи;
(1) ОН• + Н2 → Н2O + Н• распространение цепи;
(2) Н• + O2 → ОН• + О• разветвление цепи;
(3) О• + Н2 → ОН• + Н• разветвление цепи;
(4) Н• —> ½Н2 гибель цепи (гетерогенная);
(5) Н• + O2 → НO2 гибель цепи (гомогенная);
(6) Н• + ОН• → Н2O рекомбинация радикалов;
(1+2 + 3) 2Н2 + O2 → 2Н2O.
№40 слайд


Содержание слайда: Самовоспламенение возможно, когда число образующихся радикалов превышает число гибнущих радикалов. Условие цепного самовоспламенения (взрыва):
Самовоспламенение возможно, когда число образующихся радикалов превышает число гибнущих радикалов. Условие цепного самовоспламенения (взрыва):
Wроста цепи > Wобрыва цепи,
где W — скорость.
№42 слайд


Содержание слайда: Это качественная сторона явления. Количественный подход требует более глубокого понимания физической сущности процессов горения, физики и химии горения. Более полное представление о процессах воспламенения, распространения пламени, условиях прекращения горения и многих других явлениях, сопровождающих горение (например, взрыв), можно получить при рассмотрении процессов с позиций молекулярно-кинетической теории — законов химической кинетики, термодинамики.
Это качественная сторона явления. Количественный подход требует более глубокого понимания физической сущности процессов горения, физики и химии горения. Более полное представление о процессах воспламенения, распространения пламени, условиях прекращения горения и многих других явлениях, сопровождающих горение (например, взрыв), можно получить при рассмотрении процессов с позиций молекулярно-кинетической теории — законов химической кинетики, термодинамики.
№43 слайд


Содержание слайда: Химической реакции взаимодействия горючего с окислителем должен предшествовать процесс смешения горючего с окислителем и физический акт сближения молекул реагирующих веществ до расстояния Г1-2 = = Г1 + Г2: — радиусов реагирующих молекул.
Химической реакции взаимодействия горючего с окислителем должен предшествовать процесс смешения горючего с окислителем и физический акт сближения молекул реагирующих веществ до расстояния Г1-2 = = Г1 + Г2: — радиусов реагирующих молекул.
№44 слайд


Содержание слайда: Расчеты показывают, что для смеси стехиометрического состава водорода с кислородом (2Н2 + O2), находящейся при комнатной температуре и атмосферном давлении, число соударений молекул Н2 и O2 за 1 с в 1 см3 достигает величины 8,3 · 1028 см-3с-1. Если бы все эти соударения были эффективны и приводили к химическому взаимодействию, то вся смесь прореагировала бы за малое время, так как число молекул водорода в этом объеме n1 ≈ 1,7 · 1019 см-3. Однако в этих условиях реакция горения отсутствует.
Расчеты показывают, что для смеси стехиометрического состава водорода с кислородом (2Н2 + O2), находящейся при комнатной температуре и атмосферном давлении, число соударений молекул Н2 и O2 за 1 с в 1 см3 достигает величины 8,3 · 1028 см-3с-1. Если бы все эти соударения были эффективны и приводили к химическому взаимодействию, то вся смесь прореагировала бы за малое время, так как число молекул водорода в этом объеме n1 ≈ 1,7 · 1019 см-3. Однако в этих условиях реакция горения отсутствует.
№45 слайд


Содержание слайда: Это означает, что число эффективных соударений молекул при этих условиях ничтожно мало. Молекулы, которые при соударении с другими молекулами способны вступать в реакцию, должны находиться в возбужденном состоянии.
Это означает, что число эффективных соударений молекул при этих условиях ничтожно мало. Молекулы, которые при соударении с другими молекулами способны вступать в реакцию, должны находиться в возбужденном состоянии.
№46 слайд


Содержание слайда: По своей природе такое возбуждение может быть химическим — наличие у атомов или молекул вещества свободных валентностей (радикалы) или физическим, когда в результате медленного нагревания газа часть молекул приобретает кинетическую энергию выше критического значения. Молекулы, обладающие необходимым запасом энергии, достаточным для разрыва или ослабления связей, являются активными центрами химических реакций.
По своей природе такое возбуждение может быть химическим — наличие у атомов или молекул вещества свободных валентностей (радикалы) или физическим, когда в результате медленного нагревания газа часть молекул приобретает кинетическую энергию выше критического значения. Молекулы, обладающие необходимым запасом энергии, достаточным для разрыва или ослабления связей, являются активными центрами химических реакций.
№47 слайд


Содержание слайда: Разность между средним уровнем запаса энергии молекул в возбужденном состоянии и средним уровнем энергии неактивных молекул называется энергией активации (Еакт).
Разность между средним уровнем запаса энергии молекул в возбужденном состоянии и средним уровнем энергии неактивных молекул называется энергией активации (Еакт).
№48 слайд


Содержание слайда: Чем выше численное значение Еакт, тем труднее вступают в реакцию компоненты реакционной смеси. Поэтому величина Еакт является косвенным показателем степени пожарной опасности вещества.
Чем выше численное значение Еакт, тем труднее вступают в реакцию компоненты реакционной смеси. Поэтому величина Еакт является косвенным показателем степени пожарной опасности вещества.
№49 слайд


Содержание слайда: Энергия расходуется на ослабление или разрыв существующих связей в молекулах горючего и окислителя, чтобы они вступили в химическое взаимодействие. Вследствие этого взаимодействия выделится количество энергии, значительно превышающее энергию, утраченную на активацию молекул горючего и окислителя. В дальнейшем этот процесс поддерживается самопроизвольно, за счет передачи части тепловой энергии, выделившийся в результате реакции трения, новым молекулам горючего и окислителя.
Энергия расходуется на ослабление или разрыв существующих связей в молекулах горючего и окислителя, чтобы они вступили в химическое взаимодействие. Вследствие этого взаимодействия выделится количество энергии, значительно превышающее энергию, утраченную на активацию молекул горючего и окислителя. В дальнейшем этот процесс поддерживается самопроизвольно, за счет передачи части тепловой энергии, выделившийся в результате реакции трения, новым молекулам горючего и окислителя.
№51 слайд


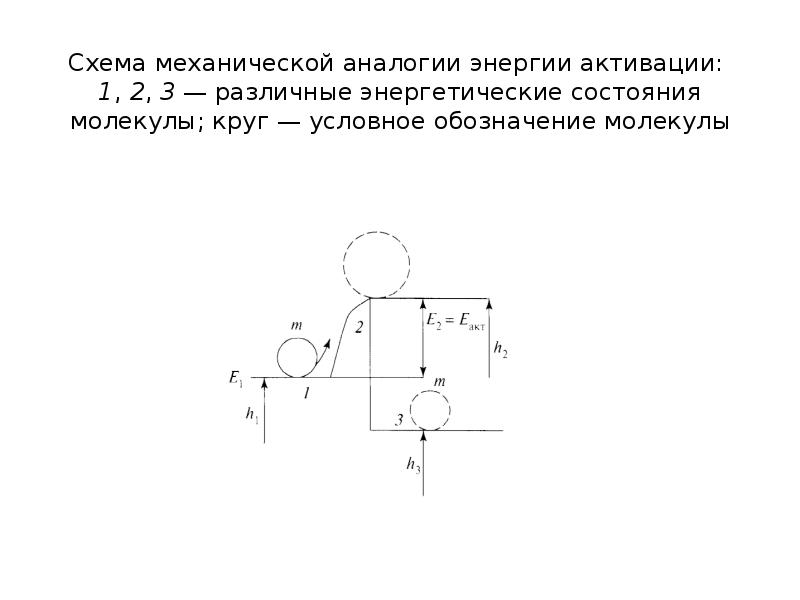
Содержание слайда: Энергетическая модель процесса воспламенения с механической точки зрения может быть представлена в следующем виде.
Энергетическая модель процесса воспламенения с механической точки зрения может быть представлена в следующем виде.
Представим «холодную» водород-кислородную смесь, молекулы которой находятся в устойчивом равновесии. Для того чтобы между ними произошло взаимодействие, их необходимо перевести в возбужденное состояние, т.е. преодолеть энергетический барьер с затратой определенного количества энергии.
№52 слайд


Содержание слайда: Чтобы вывести молекулу из состояния 1 в состояние 2 (возбужденное), характеризующееся уровнем энергии h2, необходимо затратить энергию Е2 = Еакт = = h2 – h1. Согласно законам статистической физики, в соответствии с законом Больцмана, для молекул, имеющих энергию, близкую к Еакт, энергия равна е —E/RT.
Чтобы вывести молекулу из состояния 1 в состояние 2 (возбужденное), характеризующееся уровнем энергии h2, необходимо затратить энергию Е2 = Еакт = = h2 – h1. Согласно законам статистической физики, в соответствии с законом Больцмана, для молекул, имеющих энергию, близкую к Еакт, энергия равна е —E/RT.
№53 слайд


Содержание слайда: Перейдя в состояние 2, молекула активизируется, переходит в неустойчивое состояние и получает возможность перейти на новый, более низкий и устойчивый уровень энергии h3.
Перейдя в состояние 2, молекула активизируется, переходит в неустойчивое состояние и получает возможность перейти на новый, более низкий и устойчивый уровень энергии h3.
№54 слайд


Содержание слайда: Новые связи более прочны, чтобы их разорвать, надо подвести большую дополнительную энергию, чем прежде. При таком переходе выделится энергия в количестве h1 – h3 — это та энергия, которая выделяется при химическом взаимодействии молекул горючего и окислителя, т.е. при реакциях горения.
Новые связи более прочны, чтобы их разорвать, надо подвести большую дополнительную энергию, чем прежде. При таком переходе выделится энергия в количестве h1 – h3 — это та энергия, которая выделяется при химическом взаимодействии молекул горючего и окислителя, т.е. при реакциях горения.
№55 слайд


Содержание слайда: Чтобы молекулы горючей смеси стали химически активными, необходимо повысить температуру горючей смеси внешним подогревом или вводом внутрь рассматриваемого объема источника тепловой энергии: нагретого тела, электрической искры, открытого пламени и др.
Чтобы молекулы горючей смеси стали химически активными, необходимо повысить температуру горючей смеси внешним подогревом или вводом внутрь рассматриваемого объема источника тепловой энергии: нагретого тела, электрической искры, открытого пламени и др.
№56 слайд


Содержание слайда: При этом скорость движения молекул возрастает, увеличивается число и энергия их соударений. Две соударяющиеся молекулы, переходя в возбужденное состояние, ослабевают или даже разрываются связи между атомами, появляются атомарные водород и кислород, так как молекулы перешли в неустойчивое положение.
При этом скорость движения молекул возрастает, увеличивается число и энергия их соударений. Две соударяющиеся молекулы, переходя в возбужденное состояние, ослабевают или даже разрываются связи между атомами, появляются атомарные водород и кислород, так как молекулы перешли в неустойчивое положение.
№57 слайд


Содержание слайда: Происходит взаимодействие между молекулами водорода и кислорода — молекулы переходят на более низкий и устойчивый уровень энергии. При этом выделяется большое количество свободной энергии (тепловой эффект реакции) и образуется новое более стабильное соединение — вода.
Происходит взаимодействие между молекулами водорода и кислорода — молекулы переходят на более низкий и устойчивый уровень энергии. При этом выделяется большое количество свободной энергии (тепловой эффект реакции) и образуется новое более стабильное соединение — вода.
№58 слайд


Содержание слайда: Энергия, выделившаяся в результате взаимодействия первых прореагировавших молекул, передается соседним молекулам. Они возбуждаются еще больше, и процесс начинает повторяться вокруг прореагировавших молекул с большей частотой и интенсивностью.
Энергия, выделившаяся в результате взаимодействия первых прореагировавших молекул, передается соседним молекулам. Они возбуждаются еще больше, и процесс начинает повторяться вокруг прореагировавших молекул с большей частотой и интенсивностью.
№59 слайд


Содержание слайда: Происходит самоподдерживающийся, самоускоряющийся и самораспространяющийся на всю реакционную смесь процесс химического взаимодействия водорода с кислородом, сопровождающийся образованием молекул воды и выделением в окружающее пространство тепла и светового излучения, т.е. возникает и распространяется процесс горения.
Происходит самоподдерживающийся, самоускоряющийся и самораспространяющийся на всю реакционную смесь процесс химического взаимодействия водорода с кислородом, сопровождающийся образованием молекул воды и выделением в окружающее пространство тепла и светового излучения, т.е. возникает и распространяется процесс горения.
№60 слайд


Содержание слайда: При исследовании процесса горения скорость химической реакции горения необходимо рассматривать с позиций конечных эффектов химических превращений горючей системы, т.е. с учетом брутто-процесса.
При исследовании процесса горения скорость химической реакции горения необходимо рассматривать с позиций конечных эффектов химических превращений горючей системы, т.е. с учетом брутто-процесса.
№61 слайд


Содержание слайда: Если горючее и окислитель, условно Г и О, вступают в реакцию, в результате которой образуются два новых вещества, продукты горения, условно ΠГ1 и ПГ2, и при этом возникает тепловой эффект ±Q, то можно записать
Если горючее и окислитель, условно Г и О, вступают в реакцию, в результате которой образуются два новых вещества, продукты горения, условно ΠГ1 и ПГ2, и при этом возникает тепловой эффект ±Q, то можно записать
Г + О ↔ ПГ1 + ПГ2 +Q.
В этом уравнении ставится знак (↔), так как реакции горения могут быть обратимыми при достаточно высоких температурах (> 1700 °С), когда происходит диссоциация продуктов горения.
№62 слайд


Содержание слайда: Следовательно, перед Q будет знак +. Если концентрация реагентов и продуктов реакции соответственно равны a, b, т, n, то можно записать
Следовательно, перед Q будет знак +. Если концентрация реагентов и продуктов реакции соответственно равны a, b, т, n, то можно записать
где k — константа равновесия.
Эта константа характеризует соотношение компонентов в зоне реакции и по закону Вант-Гоффа зависит от температуры и теплового эффекта реакции:
№63 слайд


Содержание слайда: Скорость химических реакций горения можно выразить через скорость превращения исходных компонентов горючей смеси или через скорость возникновения продуктов горения. Если изменение концентрации (С) того или иного вещества в рассматриваемом объеме происходит только в результате химической реакции, то скорость реакции определяется по формуле
Скорость химических реакций горения можно выразить через скорость превращения исходных компонентов горючей смеси или через скорость возникновения продуктов горения. Если изменение концентрации (С) того или иного вещества в рассматриваемом объеме происходит только в результате химической реакции, то скорость реакции определяется по формуле
№64 слайд


Содержание слайда: Так как реакции горения, как правило, идут в сторону образования продуктов горения и количество тепла, выделившегося в результате реакции пропорционально количеству прореагировавших dm веществ, то численное значение скорости реакции
Так как реакции горения, как правило, идут в сторону образования продуктов горения и количество тепла, выделившегося в результате реакции пропорционально количеству прореагировавших dm веществ, то численное значение скорости реакции
есть в то же время и показатель скорости тепловыделения при горении:
№65 слайд


Содержание слайда: Справедливы те количественные соотношения, которые записаны для числа соударений молекул и для скорости протекания химических реакций в зависимости от температуры и концентрации реагентов, описываемой уравнением Аррениуса:
Справедливы те количественные соотношения, которые записаны для числа соударений молекул и для скорости протекания химических реакций в зависимости от температуры и концентрации реагентов, описываемой уравнением Аррениуса:
где k0 — константа скорости химической реакции; Са, Св — концентрации реагентов;
ν1, ν2 — показатели порядка реакции по реагирующим веществам; Eакт — энергия активации реакции, кДж/моль; R — универсальная газовая постоянная; T — температура, К.
№66 слайд


Содержание слайда: В этом случае скорость процесса горения зависит от кинетики химических реакций и горение называется кинетическим. Однако скорость химической реакции зависит не только от концентрации реагирующих веществ, температуры, но и от давления в зоне реакции.
В этом случае скорость процесса горения зависит от кинетики химических реакций и горение называется кинетическим. Однако скорость химической реакции зависит не только от концентрации реагирующих веществ, температуры, но и от давления в зоне реакции.
№67 слайд


Содержание слайда: В физике горения установлено, что скорость химических реакций пропорциональна давлению в степени порядка реакции:
В физике горения установлено, что скорость химических реакций пропорциональна давлению в степени порядка реакции:
• для реакций первого порядка —
• для реакций второго порядка —
• для реакций третьего порядка —
Скачать все slide презентации Физико-химические основы горения и взрыва одним архивом:
Похожие презентации
-
 Физико-химические основы спекания ультра- и- нанодисперсных порошков TiC- Mo, полученных в процессе плазменной переконденсации
Физико-химические основы спекания ультра- и- нанодисперсных порошков TiC- Mo, полученных в процессе плазменной переконденсации -
 Майкл Фарадей (1791-1867) ФАРАДЕЙ (Faraday) Майкл (1791-1867), английский физик, основоположник учения об электромагнитном поле, иностранный поч
Майкл Фарадей (1791-1867) ФАРАДЕЙ (Faraday) Майкл (1791-1867), английский физик, основоположник учения об электромагнитном поле, иностранный поч -
 Основные положения МКТ (молекулярная физика)
Основные положения МКТ (молекулярная физика) -
 Хочешь стать отличником? «Основы молекулярно-кинетической теории» Автор: Богомолова Н. В. учитель физики МОУ СОШ 3 г. Бийска Алт
Хочешь стать отличником? «Основы молекулярно-кинетической теории» Автор: Богомолова Н. В. учитель физики МОУ СОШ 3 г. Бийска Алт -
 Физика – одна из основных наук о природе
Физика – одна из основных наук о природе -
 Физико-механические свойства древесины Цель: познакомиться с основными физико-механическими свойствами древесины и способами их
Физико-механические свойства древесины Цель: познакомиться с основными физико-механическими свойствами древесины и способами их -
 ФИЗИКА В ЭПОХУ АНТИЧНОСТИ В свете современных историко-научных исследований считается, что основы физических знаний закладывал
ФИЗИКА В ЭПОХУ АНТИЧНОСТИ В свете современных историко-научных исследований считается, что основы физических знаний закладывал -
 Химическое действие света 11 кл учитель физики МОУ Солнцевская СОШ Турова О. Р.
Химическое действие света 11 кл учитель физики МОУ Солнцевская СОШ Турова О. Р. -
 МОУ Первомайская средняя общеобразовательная школа. Презентация урока по физике в 11 классе. Тема: «Основные понятия и величины
МОУ Первомайская средняя общеобразовательная школа. Презентация урока по физике в 11 классе. Тема: «Основные понятия и величины -
 Почему физику считают основой техники? 12f720 «Заряд»
Почему физику считают основой техники? 12f720 «Заряд»