Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
21 слайд
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
485.00 kB
Просмотров:
87
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Строение атома
№2 слайд
Содержание слайда: МОДЕЛИ АТОМА
Открытие электрона и предположение о существовании протона уже позволяли выдвигать гипотезы о внутреннем устройстве атомов на основе этих "строительных деталей". Именно тогда появилась модель атома, которую предложил Дж. Дж. Томсон («сливовый пудинг»), а чуть позже - модель атома, предложенная Э. Резерфордом («электронный рой»), позже планетарная модель Бора (рис. а, б, в).
№3 слайд
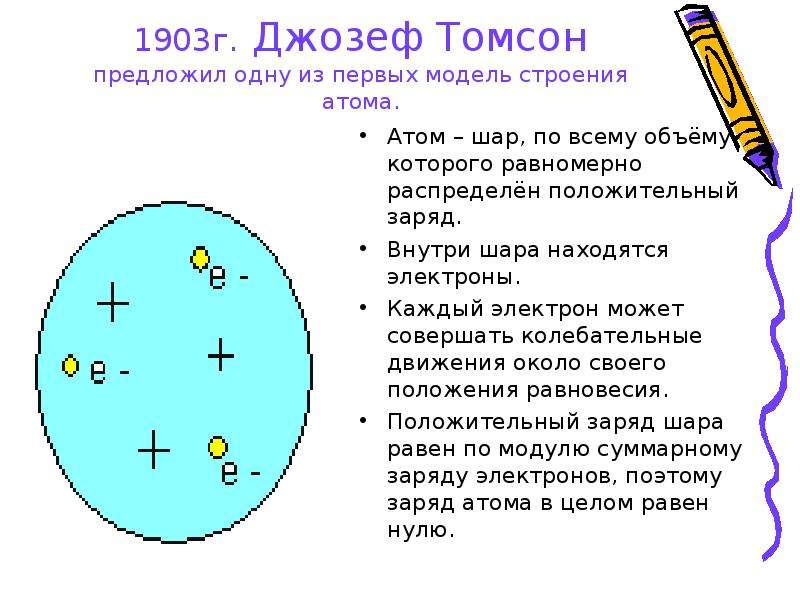
Содержание слайда: Модель Томсона
«Пудинг с изюмом», «сливовый пудинг»
В 1904 году Томсон представил свою модель атома. Она представляла собой также равномерно заряженную положительным электричеством сферу, внутри которой вращались отрицательно заряженные корпускулы, число и расположение которых зависело от природы атома
№4 слайд
Содержание слайда: Схема опыта Резерфорда
№5 слайд
Содержание слайда: Эксперимент Резерфорда
№6 слайд
№7 слайд
Содержание слайда: Модель Резерфорда
В этой модели Резерфорд на основании своих экспериментов описывает строение атома, состоящим из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны, — подобно тому, как планеты движутся вокруг Солнца
№8 слайд
Содержание слайда: Модель Нильса Бора
Большое значение в развитии представлений о строении атома сыграла модель
Н. Бора, которая представляла собой введение квантовых условий в модель Резерфорда, построенную на основе классических представлений.
В 1913 г. Н. Бор
сформулировал свои знаменитые постулаты.
№9 слайд
Содержание слайда: Постулаты Бора
Атом и атомные системы могут длительно пребывать только в особенных стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн.
Излучение света происходит при переходе электрона из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.
№10 слайд
Содержание слайда: Постулаты Бора
№11 слайд
Содержание слайда: Недостатки модели Бора
№12 слайд
Содержание слайда: Волновая модель атома де Бройля
№13 слайд
Содержание слайда: Де Бройль первым понял, что если волны могут вести себя как частицы, то и частицы могут вести себя как волны. Он применил теорию Эйнштейна - Бора о дуализме волна-частица к материальным объектам. По аналогии с соотношением между длиной волны света и энергией фотона де Бройль высказал гипотезу о существовании соотношения между длиной волны и импульсом частицы (массы, умноженной на скорость частицы). Импульс непосредственно связан с кинетической энергией. Таким образом, быстрый электрон соответствует волне с более высокой частотой (более короткой длиной волны), чем медленный электрон.
Де Бройль первым понял, что если волны могут вести себя как частицы, то и частицы могут вести себя как волны. Он применил теорию Эйнштейна - Бора о дуализме волна-частица к материальным объектам. По аналогии с соотношением между длиной волны света и энергией фотона де Бройль высказал гипотезу о существовании соотношения между длиной волны и импульсом частицы (массы, умноженной на скорость частицы). Импульс непосредственно связан с кинетической энергией. Таким образом, быстрый электрон соответствует волне с более высокой частотой (более короткой длиной волны), чем медленный электрон.
№14 слайд
Содержание слайда: Двойственная природа электрона
№15 слайд
Содержание слайда: Квантово-механическая модель Э. Шредингера
№16 слайд
Содержание слайда: В 1926 г. Э. Шредингер предложил для описания движения электрона в атоме волновое уравнение, получившее название уравнения Шредингера. Решением уравнения Шредингера является волновая функция ψ, называемая также орбиталью. Волновая функция может иметь как действительные, так и мнимые решения. Поэтому физический смысл имеет только квадрат модуля волновой функции |ψ|2, который характеризует вероятность нахождения электрона в данном объеме пространства. Термином орбиталь обозначают также область пространства, в которой наиболее вероятно нахождение электрона. Орбиталь может быть представлена, в частности, с помощью так называемых граничных поверхностей, т.е. пространственных фигур, внутри которых вероятность нахождения электрона составляет 95 %.
В 1926 г. Э. Шредингер предложил для описания движения электрона в атоме волновое уравнение, получившее название уравнения Шредингера. Решением уравнения Шредингера является волновая функция ψ, называемая также орбиталью. Волновая функция может иметь как действительные, так и мнимые решения. Поэтому физический смысл имеет только квадрат модуля волновой функции |ψ|2, который характеризует вероятность нахождения электрона в данном объеме пространства. Термином орбиталь обозначают также область пространства, в которой наиболее вероятно нахождение электрона. Орбиталь может быть представлена, в частности, с помощью так называемых граничных поверхностей, т.е. пространственных фигур, внутри которых вероятность нахождения электрона составляет 95 %.
Решение уравнения Шредингера определяется набором четырех чисел, получивших название квантовых чисел.
№17 слайд
Содержание слайда: Орбитальная модель атома
№18 слайд
Содержание слайда: Орбитали
№19 слайд
Содержание слайда: Кольцегранная модель атома Снельсена
В кольцегранных моделях пары электронов с различными знаками спин обозначаются парами колец, располагаемыми симметрично, относительно ядра атома. Разные цвета колец обозначают различную ориентацию электронов (их вектора спин) относительно ядра
№20 слайд
Содержание слайда: ХАРАКТЕРИСТИКИ ЭЛЕКТРОНА
№21 слайд