Презентация Определение биохимии История развития биохимии Понятие «жизнь» Живой организм Строение и функции белков онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Определение биохимии История развития биохимии Понятие «жизнь» Живой организм Строение и функции белков абсолютно бесплатно. Урок-презентация на эту тему содержит всего 80 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Без категории » Определение биохимии История развития биохимии Понятие «жизнь» Живой организм Строение и функции белков
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:80 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:9.95 MB
- Просмотров:107
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: Биохимия – это наука о химическом составе живой материи, химических процессах, происходящих в живых организмах, а также связи этих превращений с деятельностью органов и тканей.
1) статическая биохимия - это анализ химического состава живых организмов;
2) динамическая биохимия - изучает совокупность превращения веществ и энергии в организме;
3) функциональная биохимия - исследует процессы, лежащие в основе различных проявлений жизнедеятельности.
№3 слайд


Содержание слайда: Современная биохимия решает следующие задачи:
1. Создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы с вредителями, пищевых добавок (биотехнология).
2. Разработка новых методов и средств диагностики и лечения наследственных заболеваний, канцерогенеза, природы онкогенов и онкобелков.
3. Разработка методов генной и клеточной инженерии для получения принципиально новых пород животных и форм растений с более ценными признаками.
4. Изучение молекулярных основ памяти, психики, биоэнергетики, питания .
и целый ряд других задач.
№4 слайд


Содержание слайда: История развития биохимии
В 1903 г. немецкий химик Карл Нойберг впервые использовал термин «биохимия»
Однако корни уходят в глубокую древность: на основе биохимических процессов развивались производства сыроварения, хлебопечения, виноделия, выделка кожи и многое другое
Необходимость борьбы с болезнями заставила задуматься о превращении веществ в организме , и поиске объяснения целебным свойствам растений
Авиценна ( 10-11 век) – разработал первую химическую классификацию веществ, применяемых в медицине – «Канон врачебной науки»
Средние века – «алхимия» - попытки создания химическим путем «панацеи» от всех болезней
№5 слайд


Содержание слайда: История развития биохимии
16-17 вв – немецкий врач- ятрохимик Парацельс выдвинул прогрессивное по тем временам предположение о тесной связи химии и медицины
Валь-Гель-Монт высказался о наличии в живых организмах факторов, участвующих в различных химических процессах
17-18 вв – М.В. Ломоносов и Лавуазье открыли законы сохранения массы. Лавуазье показал, что при горении , так и при дыхании поглощается кислород и выделяется углекислый газ
Выделено огромное количество органических соединений растительного и животного происхождения
Реомюр и Спалланцони положили начало изучению ферментов пищеварительных соков
№6 слайд


Содержание слайда: История развития биохимии
В 1814 г. – русский ученый Кирхгофф описал осахаривание крахмала под действием фермента амилазы
В 1839 г. – Либих выяснил, что главные компоненты животных и растений – это белки , жиры и углеводы
В 1854 г. – Бертло провел синтез жиров
В 1861 г. – Бутлеров – синтез углеводов
Открытие аминокислот при изучении продуктов гидролиза белков
в 1869 г. - открытие швейцарским ученым Мишером ДНК привело к изучению нуклеиновых кислот .
Поставлены первые опыты по взаимопревращению жиров, белков, углеводов.
Возникло учение о витаминах (Лунин, Эйкман, Функ и другие), о ферментах (Манасеина, Павлов), гормонах (Бернар).
№7 слайд


Содержание слайда: История развития биохимии
20 в. - Фишер обосновал пептидная теория строения белков
Кнооп, Ленинджер – обосновали окисление и биосинтез жирных кислот
Кребс, Мейергоф – созданы схемы биохимических превращений углеводов и образования АТФ.
Заложены серьезные основы к развитию таких направлений как биоэнергетика, генная инженерия, молекулярная биология и др.
Достижения биохимии широко применяются в народном хозяйстве, фармации и в медицине .
№8 слайд


Содержание слайда: Биохимия – теоретическая основа биологии и медицины.
Цель биохимии – применять знания, полученные при изучении биохимии, для изучения других дисциплин (физиология, патофизиология, фармакология, микробиология и мн. др.), а также в профессиональной деятельности врача для выявления нормы и патологии.
№11 слайд


Содержание слайда: Нормальная биохимия – наука, которая с помощью биохимических методов на уровне молекул , клеточных органелл , клеток и органов , организма в целом, их взаимосвязи изучает нормальное течение физиологических процессов
Нормальная биохимия – наука, которая с помощью биохимических методов на уровне молекул , клеточных органелл , клеток и органов , организма в целом, их взаимосвязи изучает нормальное течение физиологических процессов
Патологическая биохимия – экспериментально- теоретическая наука, которая с помощью биохимических методов на уровне молекул , клеточных органелл , клеток и органов , организма в целом, их взаимосвязи изучает этиологию, патогенез, течение заболевания, особенности процесса выздоровления и реабилитации
Клиническая биохимия – это клинико - диагностическая наука, в задачи которой входят разработка и использование стандартных методов диагностики, контроля над течением заболевания с позиции биохимии.
№12 слайд


Содержание слайда: «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней средой. причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка» Ф. Энгельс
"Живые тела, существующие на Земле, представляют собой открытые, саморегулирующиеся и самовоспроизводящиеся системы, построенные из биополимеров — белков и нуклеиновых кислот"
М. В. Волькенштейн
На основании последних научных достижений современной биологической науки дано следующее определение жизни: "Жизнь — это открытые саморегулирующиеся и самовоспроизводящиеся системы совокупностей живых организмов, построенные из сложных биологических полимеров — белков и нуклеиновых кислот".
№13 слайд


Содержание слайда: Основная структурная единица всех форм жизни – клетка. При большом разнообразии клеток их объединяет наличие обязательных надмолекулярных образований , которые необходимы для реализации воспроизведения и обмена: мембрана, митохондрии , ядро и т.д.
При изучении химического состава этих обязательных образований обнаружено большое разнообразие молекулярных структур: макромолекулы: белки, углеводы, липиды, низкомолекулярные биологически активные органические вещества и минеральные вещества.
В живых клетках происходит синтез множества органических молекул, среди которых главную роль играют полимерные макромолекулы – белки, нуклеиновые кислоты и полисахариды. Особая роль в жизнедеятельности живых организмов принадлежит белкам
№16 слайд

Содержание слайда: Физико-химические свойства
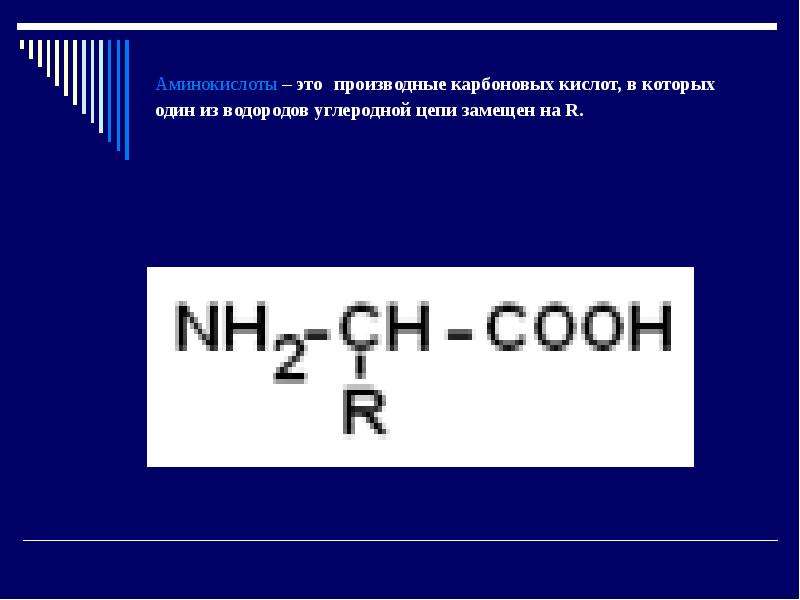
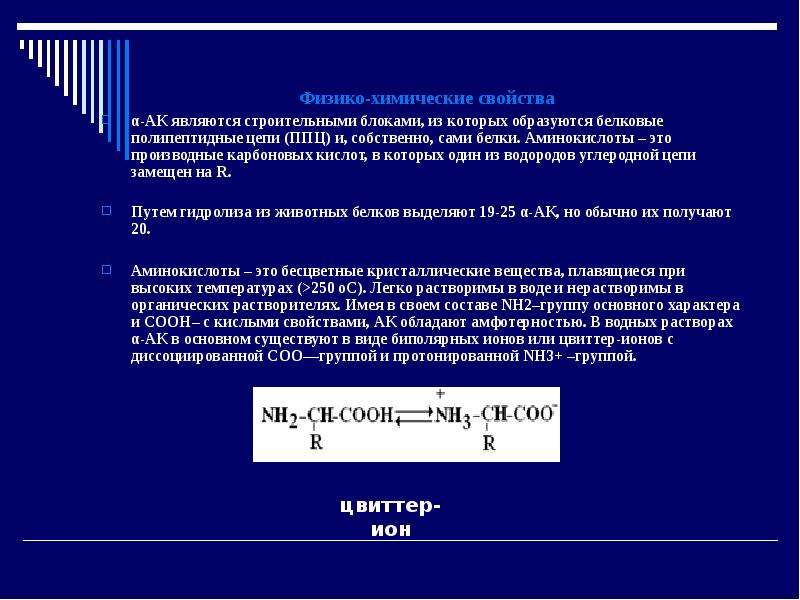
α-АК являются строительными блоками, из которых образуются белковые полипептидные цепи (ППЦ) и, собственно, сами белки. Аминокислоты – это производные карбоновых кислот, в которых один из водородов углеродной цепи замещен на R.
Путем гидролиза из животных белков выделяют 19-25 α-АК, но обычно их получают 20.
Аминокислоты – это бесцветные кристаллические вещества, плавящиеся при высоких температурах (>250 oС). Легко растворимы в воде и нерастворимы в органических растворителях. Имея в своем составе NH2–группу основного характера и COOH– с кислыми свойствами, АК обладают амфотерностью. В водных растворах α-АК в основном существуют в виде биполярных ионов или цвиттер-ионов с диссоциированной COO––группой и протонированной NH3+ –группой.
№18 слайд


Содержание слайда: Что такое изоэлектрическая точка белка?
Величина рН, при которой в водном растворе преобладает цвиттер-ион, т.е. равновесная концентрация «+» и «–» q аминокислот, а также белков, называется изоэлектрической точкой (pI). При достижении такой рН белок становится неподвижным в электрическом поле и выпадает в осадок, что используется в электрофоретических методах анализа белков и аминокислот.
№19 слайд


Содержание слайда: Стереохимия аминокислот
Важным свойством АК является их оптическая активность в водных растворах. Это свойство АК обусловлено наличием в их структуре хирального атома С.
Хиральным атомом или хиральным центром называется атом, у которого все связи замещены различными радикалами (R):
Оптически неактивной является только АК глицин, которая не имеет хирального центра.
Существуют два вида изомеров – структурные и стереоизомеры.
№22 слайд


Содержание слайда: Если 2 стереоизомера относятся друг к другу как предмет и его зеркальное отражение, их называют энантиомерами.
Энантиомеры всегда проявляют одинаковые химические и физические свойства за исключением одного – направления вращения плоскости поляризованного луча. Энантиомер, вращающий плоскость поляризации по часовой стрелке, называется правовращающим («+»), а против часовой стрелки – левовращающим («–»).
Природные аминокислоты являются как «+», так и «–».
Смесь равного количества молекул правого и левого энантиомеров называется рацемической смесью.
№23 слайд
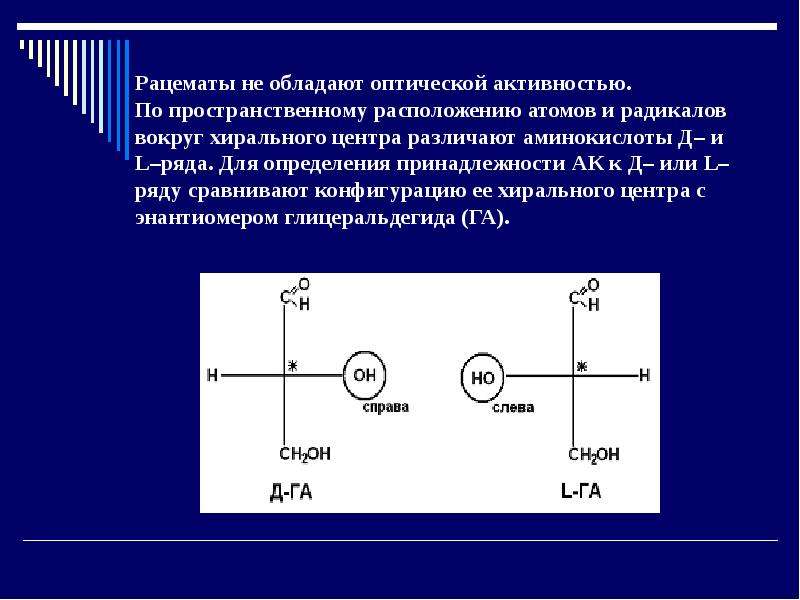

Содержание слайда: Рацематы не обладают оптической активностью.
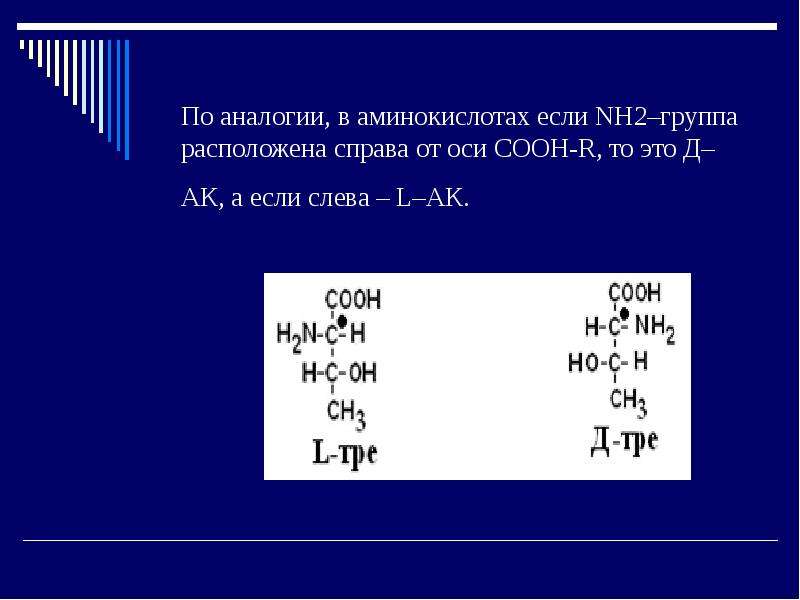
По пространственному расположению атомов и радикалов вокруг хирального центра различают аминокислоты Д– и L–ряда. Для определения принадлежности АК к Д– или L–ряду сравнивают конфигурацию ее хирального центра с энантиомером глицеральдегида (ГА).
№29 слайд


Содержание слайда: II. Биологическая классификация.
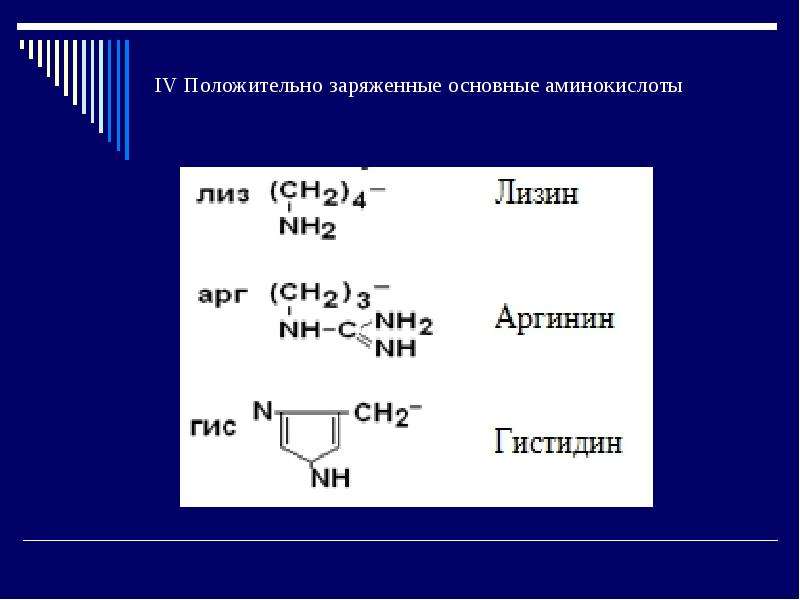
1) Незаменимые аминокислоты не могут синтезироваться в организме человека и должны обязательно поступать с пищей (вал, иле, лей, лиз, мет, тре, три, фен) и еще 2 аминокислоты относятся к частично незаменимым (арг, гис).
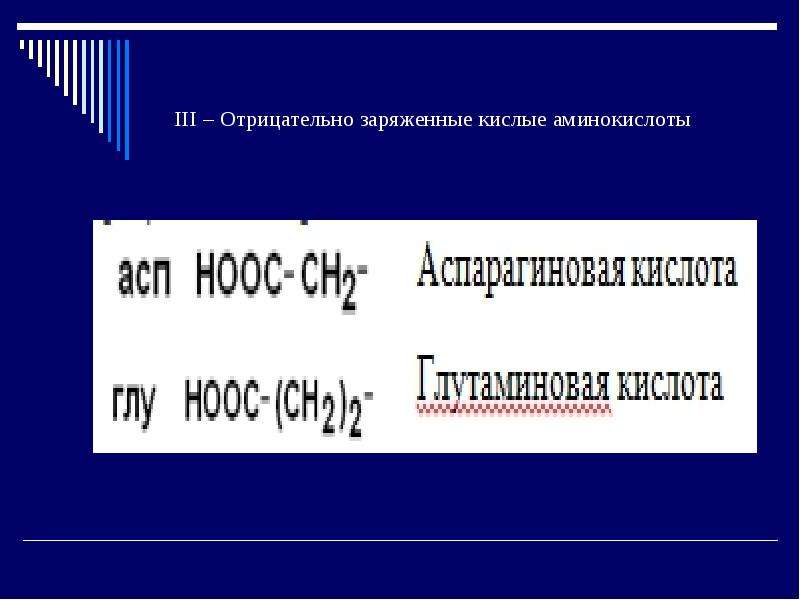
2) Заменимые аминокислоты могут синтезироваться в организме человека (глутаминоваякислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин).
№31 слайд


Содержание слайда: Образование пептидных связей.
α–СООН группа одной аминокислоты может реагировать с α–NH2 группой другой аминокислоты с образованием пептидных связей.
Пептидные цепи белков – это линейные полимеры α–АК, соединенных пептидной связью.
Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками, цепь повторяющихся групп –NH–CH–CO– называется пептидным остовом. Аминокислотный остаток, имеющий свободную NH2–группу называется N–концевым, а имеющий свободным α–карбоксигруппу – С–концевым.
Пептиды пишутся и читаются с N–конца.
Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.
Пептидные связи очень прочные, для их неферментного гидролиза in vitro требуются жесткие условия: высокие to и p, кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (E), называемых протеазами или пептидгидролазами.
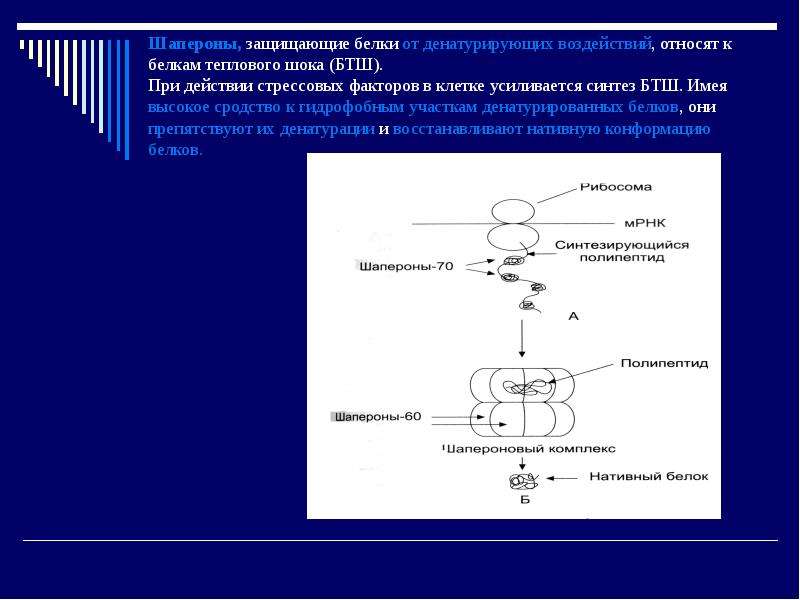
Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана
№32 слайд


Содержание слайда: Пептиды пишутся и читаются с N–конца.
Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.
Пептидные связи очень прочные, для их неферментного гидролиза in vitro требуются жесткие условия: высокие to и p, кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (E), называемых протеазами или пептидгидролазами.
Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана
Пептиды пишутся и читаются с N–конца.
Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.
Пептидные связи очень прочные, для их неферментного гидролиза in vitro требуются жесткие условия: высокие to и p, кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (E), называемых протеазами или пептидгидролазами.
Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана
№33 слайд


Содержание слайда: Белки , как уникальный класс биополимеров
Белки – это высокомолекулярные азотсодержащие органические соединения, построенные из остатков α-аминокислот .
Белки также называют протеинами (греч. protos – первый, важнейший). Белкам принадлежит решающая роль во всех процессах жизнедеятельности, они не встречаются в неживой природе.
№34 слайд


Содержание слайда: Отличия живой природы от неживой
1) способность живых организмов к воспроизводству себе подобных;
2) сократимость, движение;
3) высокий уровень структурной организации;
4) способность к эффективному преобразованию и использованию энергии;
5) обмен с окружающей средой и саморегуляция химических превращений.
Все эти свойства живой природы в большей мере обусловлены наличием в ней белков. Таким образом, белки составляют основу структуры и функций живых организмов
№35 слайд


Содержание слайда: Белки являются важнейшим субстратом жизни, т.к. обладают рядом особенностей
: молекулы белков отличаются неисчерпаемым разнообразием структуры при строгой ее специфичности у данного белка
белкам присуща способность к внутримолекулярным взаимодействиям, что обеспечивает динамичность структуры их молекул, изменчивость и пластичность их формы, обратимость переходов из глобулярного состояния в фибриллярное
№36 слайд


Содержание слайда: обладая разнообразными химическими радикалами аминокислотных остатков в составе полипептидных цепей, белковые молекулы способны вступать в разнообразные химические и физические взаимодействия как с друг другом, так и с нуклеиновыми кислотами, полисахаридами, образуя надмолекулярные комплексы.
обладая разнообразными химическими радикалами аминокислотных остатков в составе полипептидных цепей, белковые молекулы способны вступать в разнообразные химические и физические взаимодействия как с друг другом, так и с нуклеиновыми кислотами, полисахаридами, образуя надмолекулярные комплексы.
молекулы белков закономерно изменяют свою структуру под влиянием внешнего воздействия и восстанавливают исходное состояние. Многие белки способны ускорять каталитически химические реакции, протекающие в живом организме
№37 слайд


Содержание слайда: Физико-химические свойства белков
1. Высокая вязкость белковых растворов.
2. Водные растворы белков имеют ясно выраженный коллоидный характер. Стабилизация коллоидных растворов белков обеспечивается зарядом частиц коллоидного раствора.
3. Способность белковых растворов к набуханию в больших пределах.
4. Растворы белков оптически активны, подвижны в электрическом поле, поглощают УФ-лучи при 280 нм.
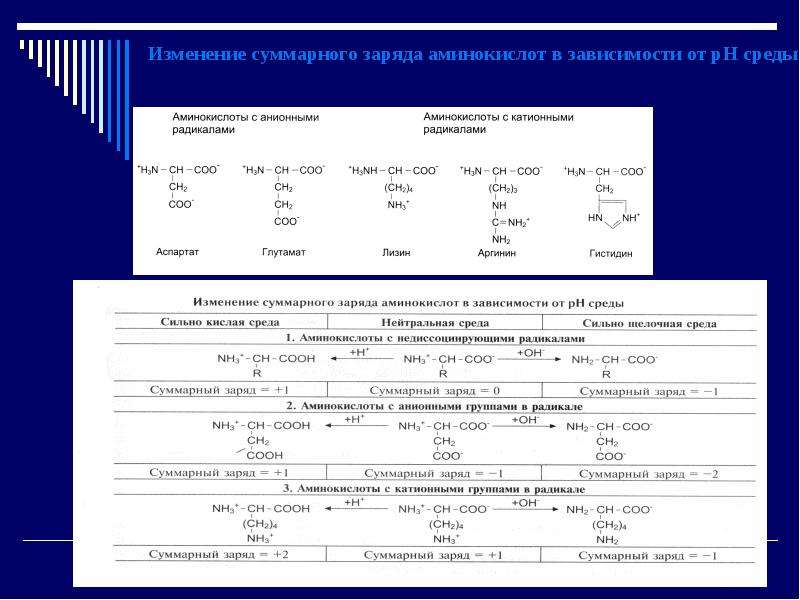
5. Благодаря наличию свободных СООН– и NH2– групп проявляют амфотерные свойства. Кроме того, белки имеют высокую Mr, обладают изоэлектрической и изоионной точкой, денатурируют и ренатурируют и т.д.
№38 слайд


Содержание слайда: Заряд белковой молекулы
Белковые растворы - коллоидные растворы с разными свойствами.
Белки бывают кислыми и основными:
Кислые белки содержат много глу и асп, у которых есть дополнительные карбоксильные и меньше аминогрупп.
В щелочных белках много лиз и арг.
Каждая молекула белка в водном растворе окружена гидратной оболочкой, так как у белков за счет аминокислот есть много гидрофильных группировок (-СООН, -ОН, -NH2, -SH).
В водных растворах белковая молекула имеет заряд. Заряд белка в воде может меняться в зависимости от РН.
Осаждение белков. У белков есть гидратная оболочка, заряд, препятствующий склеиванию. Для осаждения необходимо снять гидратную оболочку и заряд.
Реакции осаждения делят на два вида:
№39 слайд


Содержание слайда: 1. Высаливание белков: (NH4)SO4 - снимается только гидратная оболочка, белок сохраняет все виды своей структуры, все связи, сохраняет нативные свойства. Такие белки можно затем вновь растворить и использовать.
1. Высаливание белков: (NH4)SO4 - снимается только гидратная оболочка, белок сохраняет все виды своей структуры, все связи, сохраняет нативные свойства. Такие белки можно затем вновь растворить и использовать.
2. Осаждение с потерей нативных свойств белка - процесс необратимый. С белка снимается гидратная оболочка и заряд, нарушаются различные свойства в белке. Например соли меди, ртути, мышьяка, железа, концентрированные неорганические кислоты - HNO3, H2SO4, HCl, органические кислоты, алкалоиды - танины, йодистая ртуть.
При кипячении молекулы белков начинают хаотично двигаться, сталкиваются, снимается заряд, уменьшается гидратная оболочка.
Для обнаружения белков в растворе применяются: цветные реакции; реакции осаждения
№40 слайд


Содержание слайда: Элементный состав белков
В белках содержится С – до 55%; О– 20-25%; N – 16%, а также S, P, Mg и др. Доля азота в отличие от других элементов примерно одинакова и составляет 16% и содержание белка в материале часто определяют по количеству азота (сжигание по Къельдалю).
Исключение составляет белки-протамины, которые содержат ~30% N.
Относительная молекулярная масса белков (Mr) очень велика: от ≈6000Да до нескольких миллионов Да.
Например, Mr инсулина = 5733 Да, а вируса табачной мозаики – 40 млн.Да
№47 слайд


Содержание слайда: Классификация белков
по форме молекул (глобулярные или фибриллярные);
по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
по химическому строению (наличие или отсутствие небелковой части);
по выполняемым функциям (транспортные, защитные, структурные белки и др.);
по локализации в клетке (ядерные, цито-плазматические, лизосомальные и др.);
№48 слайд


Содержание слайда: Классификация белков
по локализации в организме (белки крови, печени, сердца и др.);
по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные);
по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков, Т1/2 которых исчисляют неделями и месяцами);
по схожим участкам первичной структуры и родственным функциям (семейства белков).
№49 слайд
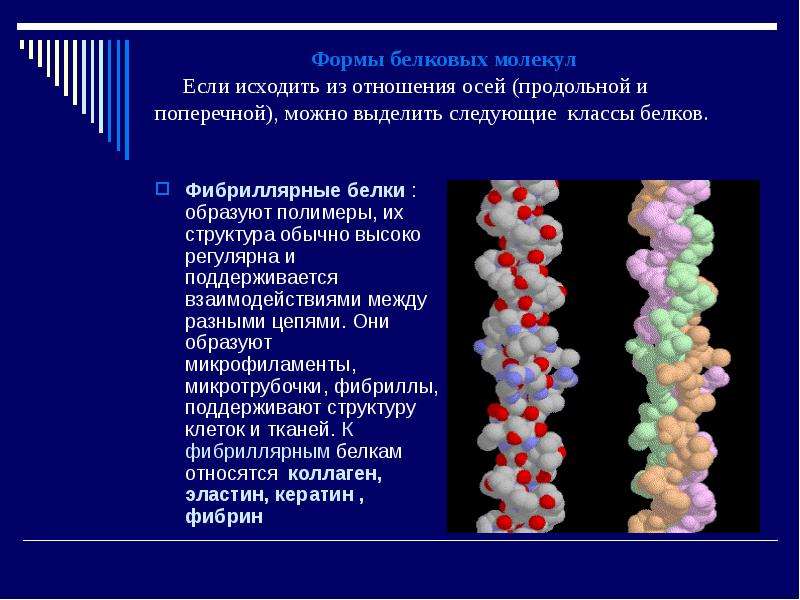

Содержание слайда: Формы белковых молекул
Если исходить из отношения осей (продольной и поперечной), можно выделить следующие классы белков.
Фибриллярные белки : образуют полимеры, их структура обычно высоко регулярна и поддерживается взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. К фибриллярным белкам относятся коллаген, эластин, кератин , фибрин
№51 слайд


Содержание слайда: Формы белковых молекул
Мембранные белки имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортёры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
№52 слайд


Содержание слайда: Функции белков
Функции белков
Каталитическая Ферменты
Сократительная Актин, миозин
Регуляция работы
генов Гистоны, негистоновые ядерные белки
Гормональная Обмен веществ (инсулин, глюкагон, ТТГ)
Защитная Иммунная система (иммуноглобулины),
Свертывание крови фибриноген, факторы свертывания
Регуляторная Кальмодулин
Структурная Коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке
Транспортная Альбумины (переносят билирубин, жирные кислоты), гемоглобин (кислород), липопротеины (липиды)
Питательная Белок молока (казеин)
№73 слайд


Содержание слайда: Денатурация
При воздействии на белки определенными агентами может нарушаться пространственная структура белка.
Первичная структура не изменяется, изменяются нативные свойства белка, он перестает функционировать.
Факторы:
1) термические (кипячение);
2) химические (кислоты, щелочи);
3) радиоактивное излучение.
Белок может ренатурировать. Для этого необходимо очень короткое воздействие агентов.
Скачать все slide презентации Определение биохимии История развития биохимии Понятие «жизнь» Живой организм Строение и функции белков одним архивом:
Похожие презентации
-
 Сущность понятия конкуренция. Поведенческий, структурный и функциональный подход к определению конкуренции Подготивили: Жвакин
Сущность понятия конкуренция. Поведенческий, структурный и функциональный подход к определению конкуренции Подготивили: Жвакин -
 История развития хирургии. Организация хирургической помощи и деонтология в хирургии Кафедра общей хирургии Лектор проф. Б. С.
История развития хирургии. Организация хирургической помощи и деонтология в хирургии Кафедра общей хирургии Лектор проф. Б. С. -
 ПРЕДМЕТ АКУШЕРСТВА. ОСНОВНЫЕ ИСТОРИЧЕСКИЕ ЭТАПЫ РАЗВИТИЯ. ПРИНЦИПЫ ОРГАНИЗАЦИИ АКУШЕРСКО-ГИНЕКОЛОГИЧЕКОЙ ПОМОЩИ.
ПРЕДМЕТ АКУШЕРСТВА. ОСНОВНЫЕ ИСТОРИЧЕСКИЕ ЭТАПЫ РАЗВИТИЯ. ПРИНЦИПЫ ОРГАНИЗАЦИИ АКУШЕРСКО-ГИНЕКОЛОГИЧЕКОЙ ПОМОЩИ. -
 Управление качеством: понятие, функции и методы Выполнили: Минниахметова м. , Сочнева а.
Управление качеством: понятие, функции и методы Выполнили: Минниахметова м. , Сочнева а. -
 Понятие медсестринского процесса. Функции сестринства.
Понятие медсестринского процесса. Функции сестринства. -
 Анатомо-физиологические особенности строения полости рта в возрастном аспекте. Этапы развития челюстной-лицевой области. Фор
Анатомо-физиологические особенности строения полости рта в возрастном аспекте. Этапы развития челюстной-лицевой области. Фор -
 Анатомо-гистологическое строение и функция периодонта в разные возрастные периоды у детей Периодонтит: этиология, патогенез,
Анатомо-гистологическое строение и функция периодонта в разные возрастные периоды у детей Периодонтит: этиология, патогенез, -
 ИСТОРИЯ РАЗВИТИЯ ДЕТСКОЙ ХИРУРГИИ, ОСОБЕННОСТИ ХИРУРГИИ ДЕТСКОГО ВОЗРАСТА М. П. Разин
ИСТОРИЯ РАЗВИТИЯ ДЕТСКОЙ ХИРУРГИИ, ОСОБЕННОСТИ ХИРУРГИИ ДЕТСКОГО ВОЗРАСТА М. П. Разин -
 Значение, строение, функционирование нервной системы.
Значение, строение, функционирование нервной системы. -
 Эндокринная система В регуляции функций организма кроме нервной системы принимает участие комплекс биологически активных со
Эндокринная система В регуляции функций организма кроме нервной системы принимает участие комплекс биологически активных со