Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
13 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
2.54 MB
Просмотров:
107
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Алюминий.
Сплавы алюминия.
Учитель:
Белозерова
Татьяна Анатольевна
Ученица:
Манжура
Виктория Владимировна
№2 слайд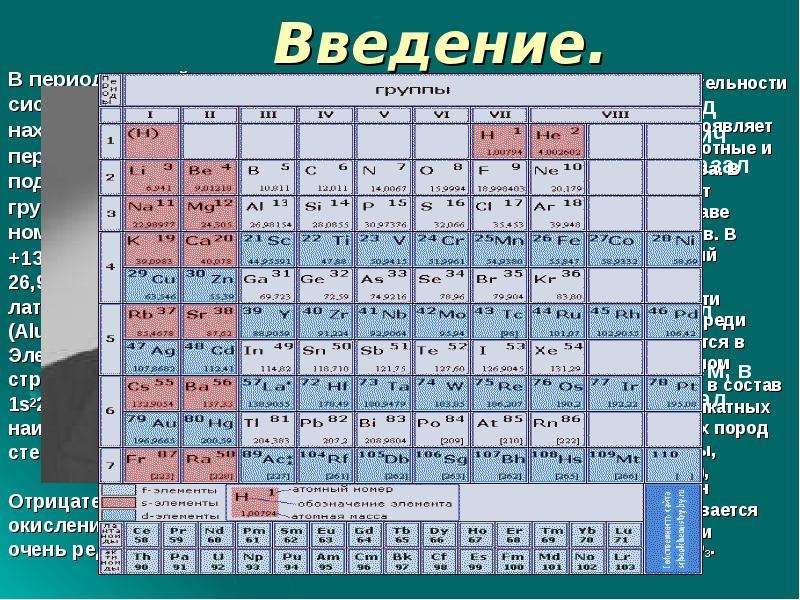
Содержание слайда: Введение.
В периодической
системе алюминий
находится в третьем
периоде, в главной
подгруппе третьей
группы, его атомный
номер13, заряд ядра
+13,атомная масса
26,9815.Обозначается
латинскими буквами AL
(Aluminium).
Электронное
строение атома
1s22s22p63s23p1,
наиболее характерная
степени окисления
+3 и 0.
Отрицательные степени
окисления проявляются
очень редко.
№3 слайд
Содержание слайда: Историческая справка.
В 1827впервые был получен
алюминий, немецким химиком
Вёлером, при нагревании
хлорида алюминия AlCl3 со
щелочными металлами калием
(K) и натрием (Na) без доступа
воздуха.
AlCl3 +3K = 3KCl + Al
№4 слайд
Содержание слайда: Нахождение в природе.
В свободном виде алюминия в природе нет!
№5 слайд
Содержание слайда: Физические свойства.
Физическими
Свойствами
(явлениями)
Называются
такие, при
которых могут
измениться
размеры, форма
тел или
агрегатное
состояние
веществ, но
состав их
остается
постоянным.
№6 слайд
Содержание слайда: Химические свойства
I.Взаимодействие алюминия с простыми веществами.
№7 слайд
Содержание слайда: II.Взаимодействие алюминия со сложными веществами.
№8 слайд
Содержание слайда: Белый аморфный порошок или очень твердые белые кристаллы.
Белый аморфный порошок или очень твердые белые кристаллы.
Физические константы:
Мr = 101,96~102, р = 3,97 г/см3 tпл=2053°С, tкип=3000°С
Кристаллический Аl2О3 химически пассивен, аморфный — более активен.
Медленно реагирует с кислотами и щелочами в растворе, проявляя
амфотерные свойства:
Al2O3 + 6НСl(конц.) = 2АlСl3 + ЗН2О
Al2O3 + 2NаОН(конц.) + ЗН2О = 2Na[Al(OH)4]
(в расплаве щелочи образуется NaAlO2). Вторая реакция
используется для «вскрытия» бокситов.
Помимо сырья для производства алюминия, Аl2О3 в виде порошка
служит компонентом огнеупорных, химически стойких и абразивных
материалов. В виде кристаллов применяется для изготовления
лазеров и синтетических драгоценных камней ( рубины, сапфиры и
др.), окрашенных примесями оксидов других металлов — Сr2О3
(красный цвет), Тi2О3 и Fe2О3 (голубой цвет).
№9 слайд
Содержание слайда: Гидроксид алюминия.
Физические константы:
Мr=78,00 р= 3,97 г/см3, t разл > 170 °С
При нагревании ступенчато разлагается, образуя промежуточный
продукт — метагидроксид AlO(OH):
Проявляет амфотерные, равно выраженные кислотные и основные свойства:
1.Взаимодействие гидроксида алюминия с кислотами:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2.Взаимодействие Al(OH)3 со щелочами:
Al(OH)3+ NaOH = NaAlO2 + 2H2O
Удобный способ получения Аl(ОН)3 — пропускание СО2 через раствор гидроксокомплекса:
[Аl(ОН)4]- + СО2 = Аl(ОН)3+ НСО3-
№10 слайд
Содержание слайда: Сплавы алюминия.
1. Дуралюмины - от французского слова dur - твердый, трудный и aluminium - твердый алюминий. Дуралюмины - сплавы на основе алюминия, содержащие:
1,4-13% Cu,
0,4-2,8% Mg ,
0,2-1,0% Mn ,
иногда 0,5-6,0% Si ,
5-7% Zn ,
0,8-1,8% Fe ,
0,02-0,35% Ti и др.
Дуралюмины - наиболее прочные и наименее коррозионно-стойкие из
алюминиевых сплавов. Наибольшее применение нашли в
авиастроении для изготовления некоторых деталей турбореактивных
двигателей.
№11 слайд
Содержание слайда: Применение.
Алюминий обладает целым рядом свойств, которые выгодно отличают его
от других металлов.
Широкое применение получил так называемый термит - смесь оксида
железа Fe3O4 с алюминием.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Данный процесс используют при сварке. Иногда для получения некоторых чистых металлов в свободном виде.
В технике алюминий используют для насыщения поверхности стальных и чугунных изделий с целью защиты этих изделий от коррозии.
Гидрооксид алюминия Al(OH)3 используется для крашения тканей, для изготовления керамики и как нейтрализующий агент.
Алюминиевая фольга используется как упаковочный материал для продуктов питания (например шоколада), более толстая - для изготовления банок для напитков.
Некоторые соли алюминия применяются в медицине для лечения кожных заболеваний: KAl(SO4)2 · 12 H2O- алюмокалиевые квасцы: (СН3СОО)3Al – ацетат алюминия.
Хлорид алюминия AlCl3 применяется в качестве катализатора в органической химии.
Сульфат алюминия Al2(SO4) 3 · 18 H2O используется для очистки воды.
№12 слайд
Содержание слайда: Тест
Вариант I.
1.Какова электронная конфигурация атома алюминия?
А. 1s22s22p1 Б. 1s22s22p3
B. 1s22s22p63s23p1 Г. 1s22s22p63s23p63d14s2
2.С каким из указанных веществ реагирует алюминий?
А.CaO Б.HCl
B.Cl2 Г. NaOH
3.С каким из указанных веществ реагирует гидроксид алюминия?
А.N2 Б. NaOH
B.H2SO4 Г. H2O
4.Какие вещества образуются при взаимодействии Al(OH)3 и NaOH?
А.Na2O Б. Al2O3
B.NaAlO2 Г. H2O
№13 слайд
Содержание слайда: Вариант II.
Вариант II.
1.Какова электронная конфигурация иона Al+3?
А. 1s2 Б. 1s22s22p6
B. 1s22s22p63s23p6 Г. 1s22s22p63s23p1
2.С каким из указанных веществ реагирует оксид алюминия ?
А. H2O Б.N2
B. NaOH Г. H2SO4
3.С каким из указанных веществ реагирует алюминий?
А. SO2 Б.Br2
B. NaCl Г. KOH
4. Какие вещества образуются при взаимодействии Al2O3 с KOH ?
А. Al(OH) 3 Б.K2O
B. H2O Г. KAlO2
5. Какие из указанных металлов являются менее активными, чем алюминий?
А. Ag Б.Ba
B. Hg Г. K
6. Растворы каких веществ имеют кислую реакцию среды (pH<7)?
А. KAlO2 Б.Al2 (SO4) 3
B. K3AlO3 Г. Al(NO3) 3
7. В чем растворяется Al(OH) 3?
А. раствор NaOH Б. H2O
B. растворKCl Г. Раствор H2SO4






















