Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
10 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
65.57 kB
Просмотров:
57
Скачиваний:
2
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: фосфор
Красный, белый и черный
№2 слайд
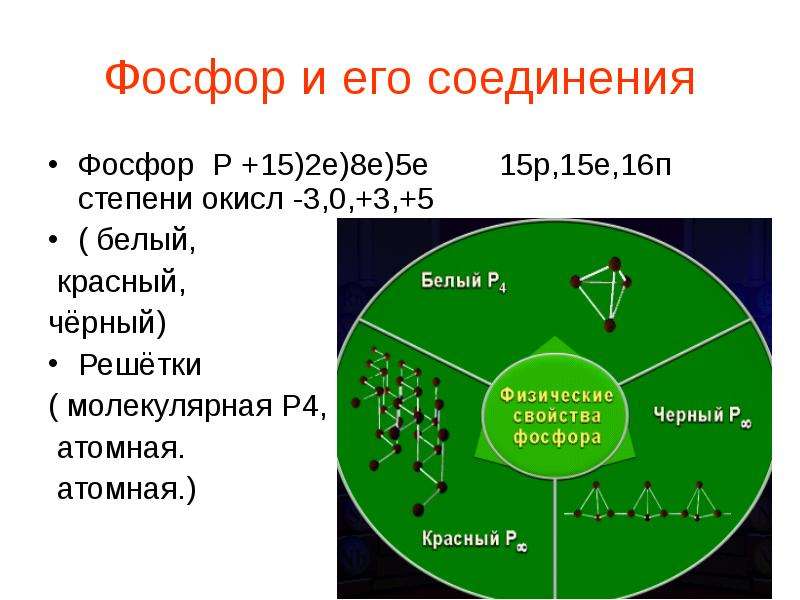
Содержание слайда: Строение молекулы
№3 слайд
Содержание слайда: Вид связи
В узлах молекулярной кристаллической решетки белого фосфора находятся тетраэдрические молекулы P_4. Это означает, что химическая связь в молекулах белого фосфора ковалентная неполярная, т.к. реализуется между одинаковыми атомами неметаллов. Прочность связи P-P в молекуле P_4 относительно невелика, чем объясняется его высокая химическая активность.
Кристаллическая решетка:белый-молекулярная,красный-атомная
№4 слайд
Содержание слайда: Нахождение в природе.
Биологическая роль.
Фосфор - один из самых распространённых элементов земной коры, его содержание составляет 0,08-0,09 % её массы. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3F, фосфорит Ca3(PO4)2 и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ), является элементом жизни.
Биологическая роль фосфора
фосфор входит в состав многих веществ организма (фосфолипиды, фосфопротеиды, нуклеотиды, коферменты, ферменты и пр.)
фосфолипиды являются основным компонентом мембран всех клеток в организме человека
в костях фосфор находится в виде гидроксилапатита, в зубах в виде фторапатит, выполняя структурную функцию
остатки фосфорной кислоты входят в состав нуклеиновых кислот и нуклеотидов, а также в состав аденозинтрифосфорной кислоты (АТФ) и креатинфосфата важнейшие аккумуляторы и переносчики энергии
остатки фосфорной кислоты входят в состав буферной системы крови, регулируя ее значение рН
№5 слайд
Содержание слайда: Физическая роль
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропных модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества - белую, красную (см. рис.), черную и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропных модификации фосфора.
Белый фосфор, фосфор в жидком и растворенном состоянии, а также в парах до 800°С состоит из молекул P4. При нагревании выше 800 °С молекулы диссоциируют: P4 = 2P2. При температуре выше 2000°С молекулы распадаются на атомы.
Красный фосфор имеет формулу (Р4)n и представляет собой полимер со сложной структурой, имеет оттенки от пурпурно-красного до фиолетового, растворим в расплавленных металлах (Bi, Pb).
Чёрный фосфор — это наиболее стабильная форма, вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, нерастворимое в воде или органических растворителях, полупроводник.
№6 слайд
Содержание слайда: Химическая активность.
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и черному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
№7 слайд
Содержание слайда: Химические свойства
Фосфор легко окисляется кислородом:
Взаимодействует со многими простыми веществами — галогенами,серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — РH3
№8 слайд
Содержание слайда: Химические свойства
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования.
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль
№9 слайд
Содержание слайда: Как получают
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
2Ca3(PO4)2 + 10C + 6SiO2 → P4 + 10CO + 6CaSiO3.
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
4HPO3 + 12C → 4P + 2H2 + 12CO.
№10 слайд
Содержание слайда: Где применяют
Наиболее активен химически, токсичен и горюч белый («жёлтый» ) фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.) .
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, топлив, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов (NPK), участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
в качестве комплексообразователей (средства для умягчения воды) ,
в составе пассиваторов поверхности металлов (защита от коррозии, например, т. н. состав «мажеф») ,
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок