Презентация Геохимические классификации элементов онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Геохимические классификации элементов абсолютно бесплатно. Урок-презентация на эту тему содержит всего 45 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Геохимические классификации элементов
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:45 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:6.01 MB
- Просмотров:92
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№4 слайд


Содержание слайда: Половина земной коры состоит из O. Таким образом, земная кора – это "кислородная сфера".
На втором месте стоит Si (кларк 29.5), на третьем Al (8.05). Если к ним добавить Fe (4.65), Ca (2.96), K (2.50), Na (2.50), Mg (1.87), Ti (0.45), то получится 99.48.
На остальные ~75 элементов приходится менее 1%.
№5 слайд


Содержание слайда: O, Si, Al, Fe, Ca, K, Na, Mg (Ti, P, Mn)
Главные, петрогенные элементы (>1 - 0.1%).
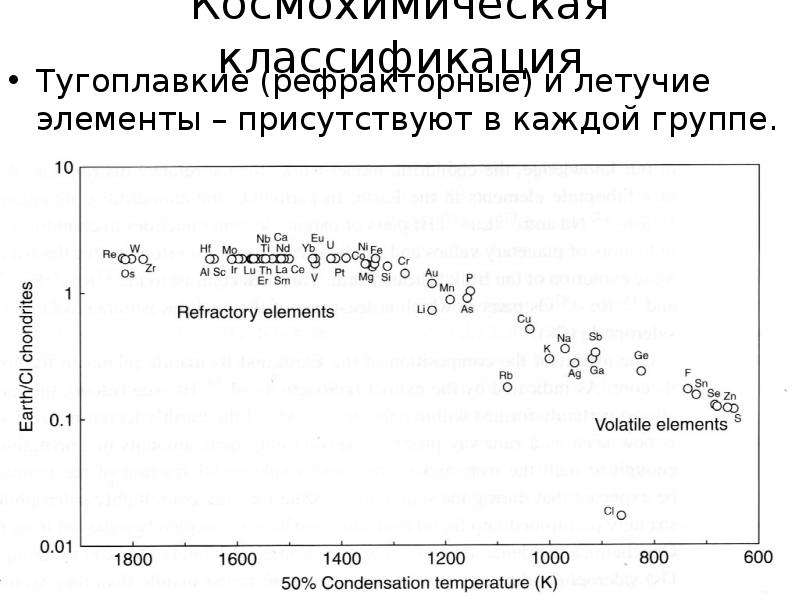
Элементы, содержание которых не превышает 0.1-0.0001%, называют редкими (уст. – малые). Если редкие элементы не образуют собственных минералов, то их называют "редкими рассеянными" (Br, In, Ra, Re, Hf, Se и др.). Содержание в ppm, г/т.
Так, у U и Br кларки почти одинаковы (2.5*10-4 и 2.1*10-4), но U – редкий элемент, т. к. известно 104
урановых минерала и урановые месторождения,
Br – рассеянный (имеет лишь один минерал).
№6 слайд


Содержание слайда: Принципиальная разница между петрогенными и редкими элементами заключается в том, что петрогенные элементы определяют фазовый (минеральный) состав системы, в то время как редкие элементы входят в эти фазы в виде примесей и пассивно распределяются между существующими фазами, но не влияют на их содержание и устойчивость.
У этого правила есть исключения. Так, Sr даже в небольших количествах сильно влияет на устойчивость кальцита.
№7 слайд


Содержание слайда: В геохимии есть еще понятие микроэлементы, которое означает элементы, содержащиеся в малых количествах (<0.01%) в данной системе. Так, Al – микроэлемент в живом организме и макроэлемент в силикатных породах.
В геохимии есть еще понятие микроэлементы, которое означает элементы, содержащиеся в малых количествах (<0.01%) в данной системе. Так, Al – микроэлемент в живом организме и макроэлемент в силикатных породах.
№10 слайд


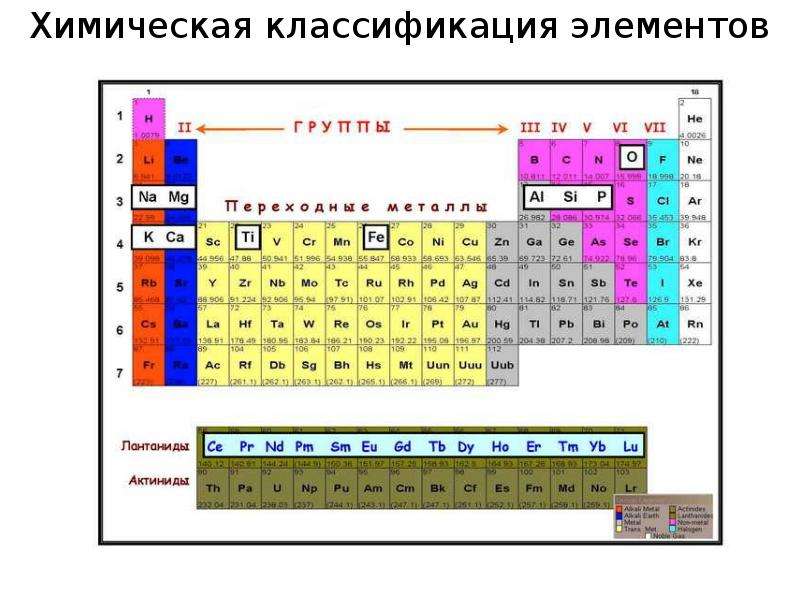
Содержание слайда: Согласно периодическому закону, свойства химических элементов изменяются периодически, в зависимости от атомного порядкового номера элемента.
Согласно периодическому закону, свойства химических элементов изменяются периодически, в зависимости от атомного порядкового номера элемента.
В первую очередь, это касается химических свойств элементов, их валентности, способности вступать в химические соединения с другими элементами, состава и свойств этих соединений.
Периодичность обнаруживают многие физические свойства (оптические спектры, потенциалы ионизации, радиусы атомов и ионов, атомные объемы и др). Они связаны со строением электронных оболочек атомов.
№13 слайд


Содержание слайда: Между величинами атомных весов и атомным номером (или зарядом ядра атома) имеется определенная связь:
Атомный вес (А) примерно в 2–2.5 раза больше величины атомного номера Z.
Число нуклонов A = Z+N, где N – число нейтронов, относится к числу протонов Z как А/Z ≈ 2.
Разность N-Z - избыток нейтронов.
Для многих элементов начала периодической системы (от He до O) это отношение довольно точно равно 2, начиная с железа оно увеличивается от 2.1 у Fe до 2.5 у Hg и 2.6 у U.
№16 слайд


Содержание слайда: Как писал В.И. Вернадский, “геохимические факты не были приняты во внимание при построении периодической системы химических элементов. Поэтому геохимическая классификация элементов не может быть заменена их химической классификацией”.
Как писал В.И. Вернадский, “геохимические факты не были приняты во внимание при построении периодической системы химических элементов. Поэтому геохимическая классификация элементов не может быть заменена их химической классификацией”.
Это, вероятно, связано с тем, что общие химические свойства элементов в значительной степени отличаются от их особенностей в природных физико-химических и, в частности рудообразующих системах.
Близкие по химическим свойствам элементы нередко образуют обособленные концентрации (Na и K, I и Cl) и, наоборот, элементы, не имеющие черт сходства, в природных условиях, образуют совместные концентрации (Cu и Mo, Au и W).
№17 слайд


Содержание слайда: В 1923 г. В.М. Гольдшмидт
сформулировал основной
закон геохимии:
Общая распространенность элемента зависит от свойств его атомного ядра, а характер распространения – от свойств наружной электронной оболочки его атома.
Классификация элементов была предложена
В. Гольдшмидтом исходя из предположения, что Земля образовалась в результате разделения первично однородного вещества, аналогичного метеоритам, на четыре части: металл, серный расплав, силикатная часть и атмосфера с океаном.
№18 слайд


Содержание слайда: В.М. Гольдшмидт сравнил дифференциацию элементов в расплавленной планете с выплавкой металла из руд, когда на дно металлургической печи опускается тяжелый металл с плотностью около 7 (аналог ядра), а на поверхность всплывает легкий силикатный шлак (аналог земной коры). Между ними располагается слой «штейна» - сульфида Fe с примесью сульфидов других металлов (аналог мантии).
№27 слайд
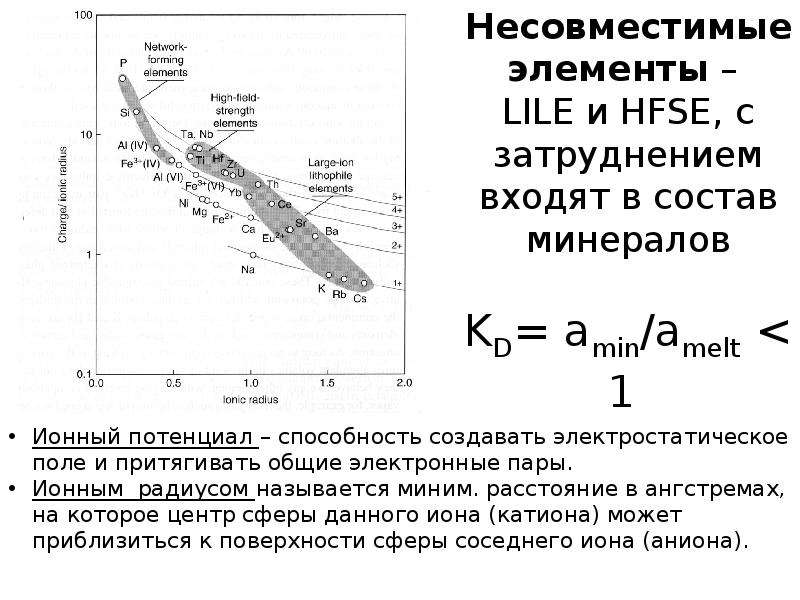

Содержание слайда: Несовместимые элементы –
LILE и HFSE, с затруднением входят в состав минералов
KD= amin/amelt < 1
Ионный потенциал – способность создавать электростатическое поле и притягивать общие электронные пары.
Ионным радиусом называется миним. расстояние в ангстремах, на которое центр сферы данного иона (катиона) может приблизиться к поверхности сферы соседнего иона (аниона).
№29 слайд


Содержание слайда: Щелочные и щелочноземельные элементы
Li, Be, K, Rb, Sr, Cs, Ba.
Низкая электроотрицательность (способность атома в молекуле притягивать к себе общие электронные пары) и валентность 1 или 2.
Образуют ионные связи (кроме Be – ковалентные).
Растворимы в водных растворах и подвижны в различных процессах.
Несовместимые элементы.
№30 слайд


Содержание слайда: HFSE – высокозарядные элементы
Sc, Y, Th, U, Pb, Zr, Hf, Ti, Nb, Ta, REE.
Ионный потенциал >2.0.
Ионный радиус не превышает ионный радиус Ca2+ .
Наименее подвижные при наложенных геологических процесссах.
Распределение HFSE позволяет судить о природе различных магматических пород.
№31 слайд


Содержание слайда: Переходные металлы (транзитные элементы)
Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn.
Формируют d-блок Периодической системы.
Химически стабильны, характерна различная валентность.
Более подвижны при различных процессах по сравнению с HFSE, т.к. образуют широкий спектр соединений.
Ответственны за окраску и магнитные свойства минералов.
№39 слайд


Содержание слайда: Классификация В.И. Вернадского
Присутствие или отсутствие в истории элемента химических и радиохимических процессов
Характер этих процессов – обратимость или необратимость
Присутствие или отсутствие в истории элементов в земной коре их химических соединений или молекул, состоящих из нескольких атомов.
№41 слайд


Содержание слайда: Из анализа групп, в которых каждый элемент встречается всего один раз, видно, что они нередко выделены только по одному из признаков.
Из анализа групп, в которых каждый элемент встречается всего один раз, видно, что они нередко выделены только по одному из признаков.
В этой классификации особый интерес представляет группа циклических или органогенных элементов - наиболее распространенная как по количеству, так и по геохимической значимости.
В понятие “циклические элементы” входило их активное участие в круговороте в связи с состоянием динамического равновесия элементов в биосфере.
№42 слайд


Содержание слайда: А.Е. Ферсман (1932 г.), используя развернутую форму системы Менделеева с нулевой группой посередине, выделяет 3 группы: элементы верхнего обычного поля до Ni - составляющих остов лито-, атмо- и гидросфер, элементы нижнего левого поля — сульфидов и нижнего правого поля кислотного, типа металлических кислот.
№43 слайд


Содержание слайда: А.Н. Заварицкий (1950 г.) выделяет 10 гр.: благородные газы (от Не до Rn); эл-ты горных пород (Na, Mg, Al, Si и др.); магм. эманаций (В, F, Р, С1, S и др.); группы железа (от Ti до Ni); редкие элементы (Sc, REE, Nb и др.); радиоактивные элементы (Ra, Th, U и др.); металлические рудные (Сu, Zn, Sn и др.), металлоидные и металлогенные (As, Sl и др.); гр. платины (Ru- Pt); тяжелые галоиды (Вг, I).
Скачать все slide презентации Геохимические классификации элементов одним архивом:
Похожие презентации
-
 Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов -
 Первые попытки классификации химических элементов
Первые попытки классификации химических элементов -
 Классификация химических элементов Й. Я. Берцелиус – выдающийся шведский ученый разделил все элементы на металлы и неметаллы.
Классификация химических элементов Й. Я. Берцелиус – выдающийся шведский ученый разделил все элементы на металлы и неметаллы. -
 Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач.
Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач. -
 Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей -
 Классификация химических элементов. Амфотерность
Классификация химических элементов. Амфотерность -
 Изучение геохимических свойств редкоземельных элементов
Изучение геохимических свойств редкоземельных элементов -
 Биогенные элементы. Классификация биоэлементов по Вернадскому
Биогенные элементы. Классификация биоэлементов по Вернадскому -
 Биогенные элементы. Классификация. Топография биогенных элементов в организме человека
Биогенные элементы. Классификация. Топография биогенных элементов в организме человека -
 Классификация элементов. III тип. Концентрационные элементы
Классификация элементов. III тип. Концентрационные элементы