Презентация Металлы. Общие свойства металлов онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Металлы. Общие свойства металлов абсолютно бесплатно. Урок-презентация на эту тему содержит всего 35 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Металлы. Общие свойства металлов
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:35 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:667.00 kB
- Просмотров:56
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№5 слайд


Содержание слайда: p-металлы: элементы IIIA (кроме бора B), IVA (германий Ge, олово Sn, свинец Pb) и VA (сурьма Sb и висмут Bi) групп.
p-металлы: элементы IIIA (кроме бора B), IVA (германий Ge, олово Sn, свинец Pb) и VA (сурьма Sb и висмут Bi) групп.
Свойства:
– образование химических связей осуществляется s- и p-электронами в процессе их возбуждения и гибридизации орбиталей;
– оксиды p-металлов проявляют амфотерный характер;
– основные оксиды образуют только p-элементы IIIA группы пятого и шестого периодов – индий In и таллий Tl.
№6 слайд


Содержание слайда: d-металлы: 30 элементов, расположенных в серединах периодов (IV, V, VI, VII) и достраивающих d-подуровень предпоследнего слоя при уже заполненном внешнем ns-подуровне.
d-металлы: 30 элементов, расположенных в серединах периодов (IV, V, VI, VII) и достраивающих d-подуровень предпоследнего слоя при уже заполненном внешнем ns-подуровне.
Свойства:
– в образовании химических связей у атомов d-металлов могут принимать участие как s-, так и d-электроны. Все d-элементы, кроме Zn и Cd, обладают переменной степенью окисления;
– характер оксидов d-металлов зависит от степени окисления: оксиды низшей степени окисления имеют основной характер, средней - амфотерный, высшей – кислотный.
№7 слайд


Содержание слайда: f-металлы: лантаноиды и актиноиды. У этих элементов достраиваются энергетические подуровни 4f и 5f при заполненном внешнем уровне 6s2 и 7s2.
f-металлы: лантаноиды и актиноиды. У этих элементов достраиваются энергетические подуровни 4f и 5f при заполненном внешнем уровне 6s2 и 7s2.
Сложное строение электронных оболочек f-металлов сказывается на их свойствах:
– f-металлы проявляют устойчивую степень окисления +3, при возбуждении возможны и более высокие степени окисления;
– f-металлы обладают высоким сродством к кислороду и образуют устойчивые оксиды типа R2O3.
№9 слайд


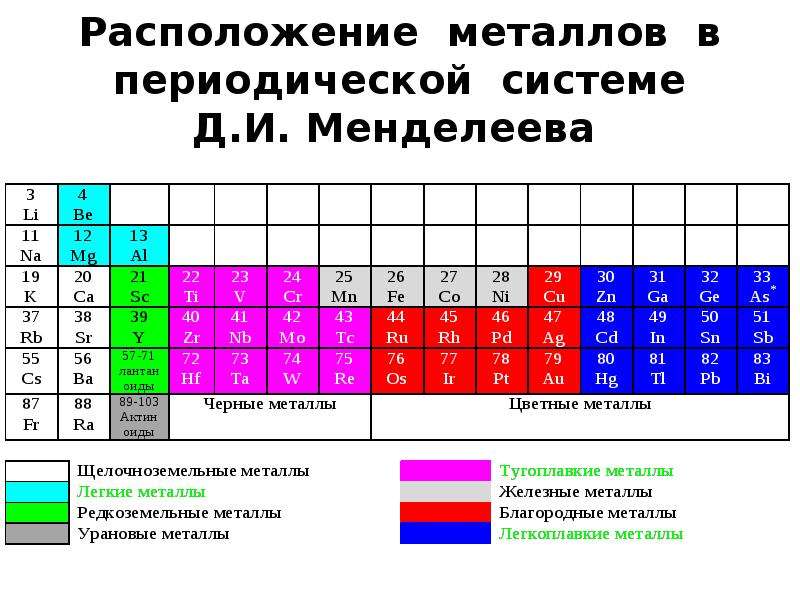
Содержание слайда: Черные подразделяются:
Черные подразделяются:
Железные металлы - Fe, Co, Ni (ферромагнетики) и Mn.
Тугоплавкие металлы - температура плавления выше Fe (1539оС) - добавки легированных сталей и основы для соответствующих сплавов.
Урановые металлы - актиниды - для сплавов атомной энергетики.
Редкоземельные металлы (РЗМ) – лантан , церий, неодим, празеодим и др. - лантаноиды + иттрий и скандий. Близки по химическим, различаются по физическим свойствам. Присадки к сплавам других элементов.
Щелочноземельные металлы. В свободном состоянии применяются в особых случаях (теплоносители в атомных реакторах).
№11 слайд


Содержание слайда: Цветные подразделяются:
Цветные подразделяются:
Легкие металлы - Be, Mg, Al - малая плотность.
Благородные металлы - Ag, Au, платиновая группа (Pt, Pd, Ir (иридий), Rh (родий), Os (осмий), Ru (рутений)), "полублагородная" медь. Высокая устойчивость против коррозии.
Легкоплавкие металлы - Zn, Cd, Hg, Sn, Pb, Bi, Tl (таллий), Sb (сурьма), элементы с ослабленными металлическими свойствами: Ga (галлий), Ge (германий).
№12 слайд


Содержание слайда: Нахождение металлов в природе
В самородном состоянии: Cu, Ag, Hg, Pt, Au
В виде соединений: оксидные (Fe3O4 –
магнетит), карбонатные
(CaCO3 – известняк),
фосфатные, силикатные,
алюмосиликатные (K2O×Al2O3×6SiO2 – полевой шпат или ортоклаз),
сульфидные (HgS – киноварь) и галидные
(NaCl – галит, каменная или поваренная соль).
№16 слайд


Содержание слайда: Полиморфизм
α – модификация устойчива при сравнительно низких температурах,
– устойчива при более высоких температурах.
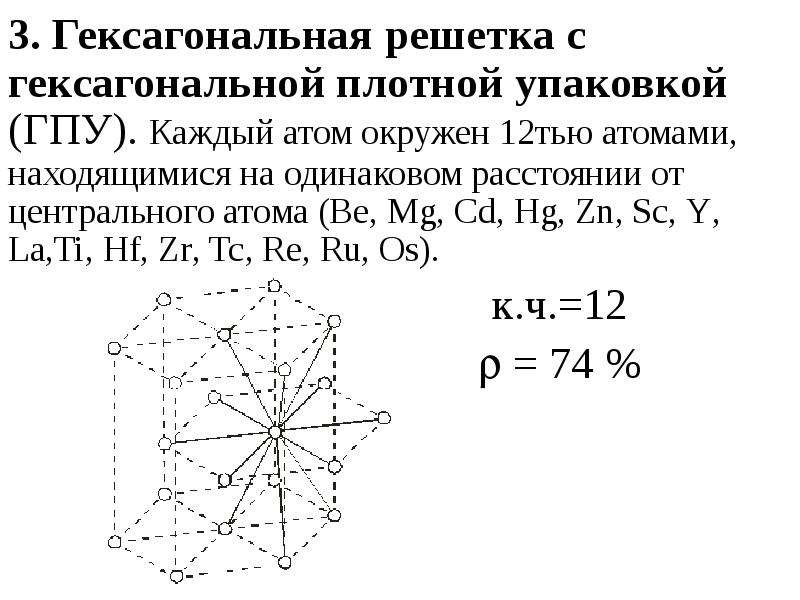
Например, железо может существовать в виде четырех полиморфных модификаций Fe.
Модификации Fe отличаются друг от друга температурными интервалами устойчивости и магнитными свойствами, но имеют одинаковую объемноцентрированную кубическую решетку.
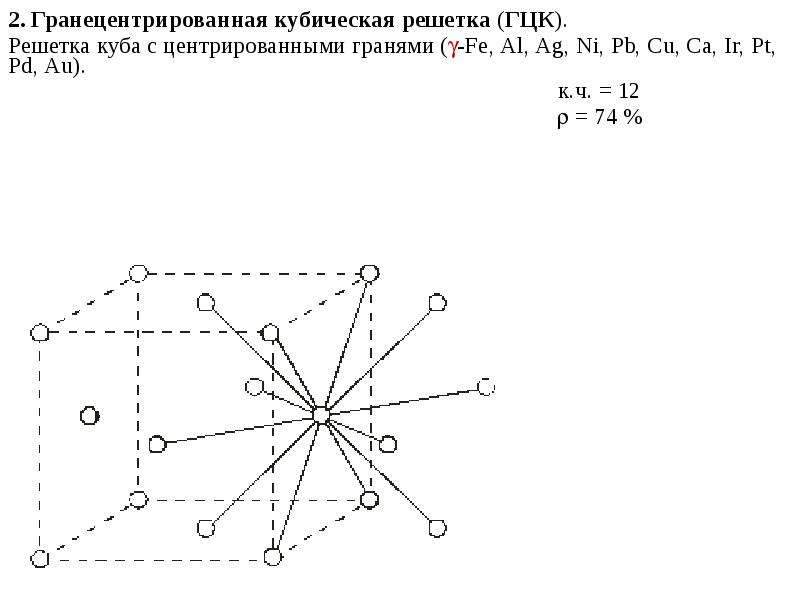
Модификация Fe, устойчивая в интервале 910-1401°С, имеет гранецентрированную кубическую решетку.
№30 слайд


Содержание слайда: С другими неметаллами.
С другими неметаллами.
Из металлов I группы с азотом, углеродом, кремнием непосредственно взаимодействует только литий:
6Li + N2 = 2Li3N (250C) нитрид лития
2Li + 2C = Li2C2 (600C) карбид лития
4Li + Si = Li4Si (600-700C, примесь Li2Si)
Металлы II группы:
Са + С = СаС2 карбиды
3Mп + N2 = Mg3N2 нитриды
№31 слайд


Содержание слайда: 2. ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ
2. ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ
С водой.
Металлы I группы: Na + H2O = NaOH + ½ H2
При переходе от Li к Cs интенсивность реакции увеличивается, цезий взаимодействует с водой наиболее бурно.
Металлы II группы: Ca + 2H2O = Ca(OH)2 + H2
Be и Mg взаимодействуют медленно из-за обволакивания металлов образующимися гидроксидами.
№35 слайд
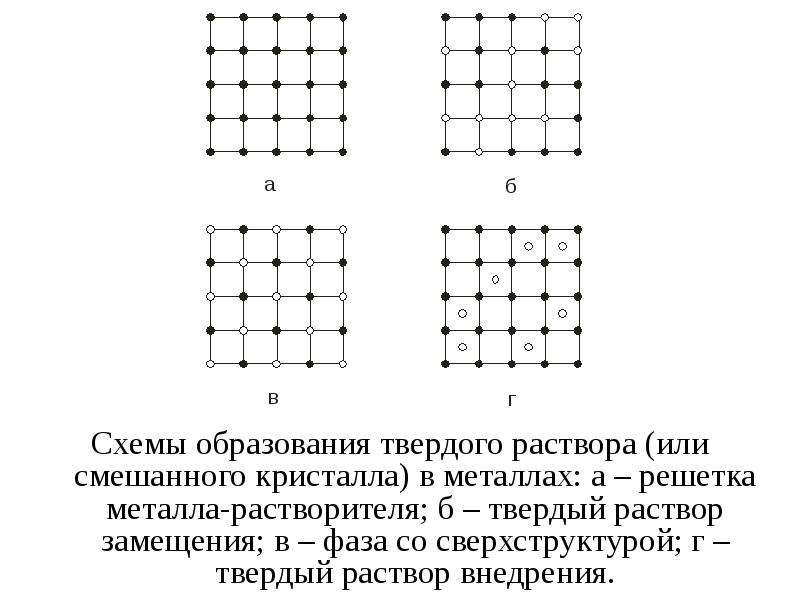

Содержание слайда: Схемы образования твердого раствора (или смешанного кристалла) в металлах: а – решетка металла-растворителя; б – твердый раствор замещения; в – фаза со сверхструктурой; г – твердый раствор внедрения.
Схемы образования твердого раствора (или смешанного кристалла) в металлах: а – решетка металла-растворителя; б – твердый раствор замещения; в – фаза со сверхструктурой; г – твердый раствор внедрения.
Скачать все slide презентации Металлы. Общие свойства металлов одним архивом:
Похожие презентации
-
 По Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов" - скачать смотреть
По Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов" - скачать смотреть -
 Общие свойства металлов МАОУ Домодедовский лицей 3 Разинькова Н. М.
Общие свойства металлов МАОУ Домодедовский лицей 3 Разинькова Н. М. -
 По Химии "Металлы Общие свойства и получение" - скачать смотреть
По Химии "Металлы Общие свойства и получение" - скачать смотреть -
 Простые вещества – металлы. Общие физические свойства металлов.
Простые вещества – металлы. Общие физические свойства металлов. -
 Простые вещества – металлы. Общие физические свойства металлов.
Простые вещества – металлы. Общие физические свойства металлов. -
 Общие свойства металлов МАОУ Домодедовский лицей 3 Разинькова Н. М.
Общие свойства металлов МАОУ Домодедовский лицей 3 Разинькова Н. М. -
 Общие свойства металлов
Общие свойства металлов -
 Положение металлов в ПСХЭ Д. И. Менделеева. Общие физические свойства металлов
Положение металлов в ПСХЭ Д. И. Менделеева. Общие физические свойства металлов -
 Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов -
 По Химии "Строение и физические свойства металлов" - скачать смотреть
По Химии "Строение и физические свойства металлов" - скачать смотреть