Презентация Основы коррозии и защиты металлов. Химическая коррозия онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Основы коррозии и защиты металлов. Химическая коррозия абсолютно бесплатно. Урок-презентация на эту тему содержит всего 71 слайд. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Основы коррозии и защиты металлов. Химическая коррозия
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:71 слайд
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:839.97 kB
- Просмотров:80
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: Семенова, И. В. Коррозия и защита от коррозии [Текст] : учеб. пособие / И. В. Семенова, Г. М. Флорианович, А. В. Хорошилов; под ред. И. В. Семеновой. - 2-е изд., перераб. и доп. - М. : ФИЗМАТЛИТ, 2006., 2010- 376 с.
Жук, Н.П. Курс теории коррозии и защиты металлов: Учеб. пособие. /Н.П. Жук. - М., Металлургия, 1976. – 472с.: ил.3.
Лихачев В. А. Коррозия и защита металлов [Текст]: учеб. пособие / В. А. Лихачев; ВятГУ, ХФ, каф. ТЭП. - Киров: [б. и.], 2010. - 68 с.
Лихачев, В. А. Коррозия и защита строительных конструкций [Текст] : учеб. пособие / В. А. Лихачев, Е. Д. Глушков; ПРИП ФГБОУ ВПО ВятГУ, - Киров, 2012. - 96 с.
№3 слайд


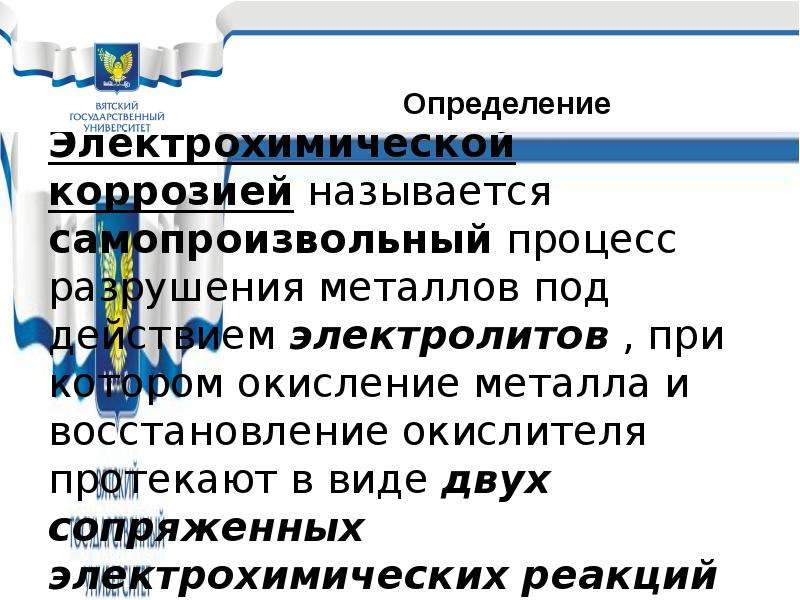
Содержание слайда: Химической коррозией называется самопроизвольный процесс разрушения металлов под действием сухих газов и неэлектролитов, при котором окисление металла и восстановление окислителя протекают в виде одной гетерогенной химической реакции
Химической коррозией называется самопроизвольный процесс разрушения металлов под действием сухих газов и неэлектролитов, при котором окисление металла и восстановление окислителя протекают в виде одной гетерогенной химической реакции
№7 слайд


Содержание слайда: Таким образом железо, углеродистые и низколегированные стали в условиях химической коррозии необходимо защищать при температуре выше 300оС.
Таким образом железо, углеродистые и низколегированные стали в условиях химической коррозии необходимо защищать при температуре выше 300оС.
300оС – реальная температура окалинообразования железа.
№9 слайд


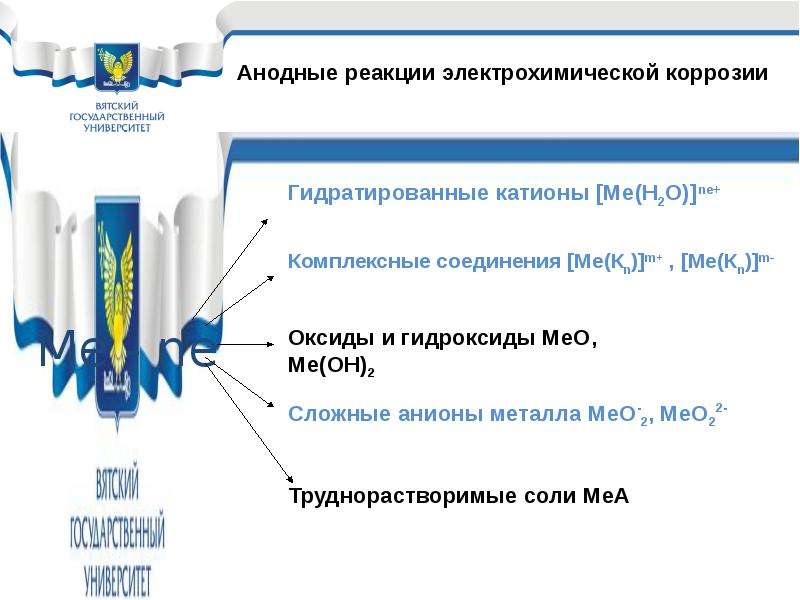
Содержание слайда: Сопряженные реакции электрохимической коррозии
Сопряженные электрохимические реакции это:
Катодная (катодные) – восстановление окислителя или окислителей, присутствующих в коррозионной среде;
Анодная (анодные) – окисление металла с получением разнообразных продуктов коррозии
№12 слайд


Содержание слайда: Ион водорода или вода также могут вызывать электрохимическую коррозию
2Н+ + 2е 2Нат Н2
(кислая среда)
или
2Н2О + 2е 2Нат + 2ОН - Н2 + 2ОН -
(нейтральная или щелочная среда)
Коррозия под действием ионов водорода или воды, сопровождающаяся выделением молекулярного водорода называется коррозия с водородной деполяризацией.
Для сплавов железа наблюдается в кислых коррозионных средах с рН < 3
№18 слайд


Содержание слайда: 10Х13 и 20Х13, 12Х17Т – хромистые стали.
10Х13 и 20Х13, 12Х17Т – хромистые стали.
Общая коррозия существенно снижается, но стали склонны к локальным формам коррозии (питтинговой, язвенной, межкристаллитной)
Второй по важности легирующий элемент - Ni (никель).
Позволяет существенно увеличить стойкость стали к локальным формам коррозии. Лучшее соотношение Cr : Ni - 18 : 9 или
18 : 10. Такое соотношение обеспечивает наряду с высокой коррозионной стойкостью сталей хорошие технологические и механические характеристики.
Хромникелевые стали наиболее распространенный вид нержавеющих сталей. Стали аустенитные (не магнитятся).
Примеры: 08Х18Н9Т, 12Х18Н9Т, 07Х21Г7АН5, 09Х15Н8Ю
№19 слайд


Содержание слайда: Коррозионностойкие стали
Мо (молибден) – вводится в количестве 2-3%, повышает стойкость стали в кислых средах и в хлоридах. При введении Мо необходимо повышение содержания Ni , из-за этого стали дорогие.
10Х17Н13М3Т Ниобий (Б) и титан (Т) вводят
08ХН23МБ для уменьшения межкристаллитной коррозии.
Си (медь) – 2-3%, повышает стойкость стали в кислотах. Это катодная присадка.
При введении меди для сохранения аустенитной структуры также требуется повышения высокого содержания Ni. 08Х23Н28М3Д3Т – работают в горячих растворах кислот H2SO4, HNO3, но в HCl стоят плохо.
№22 слайд


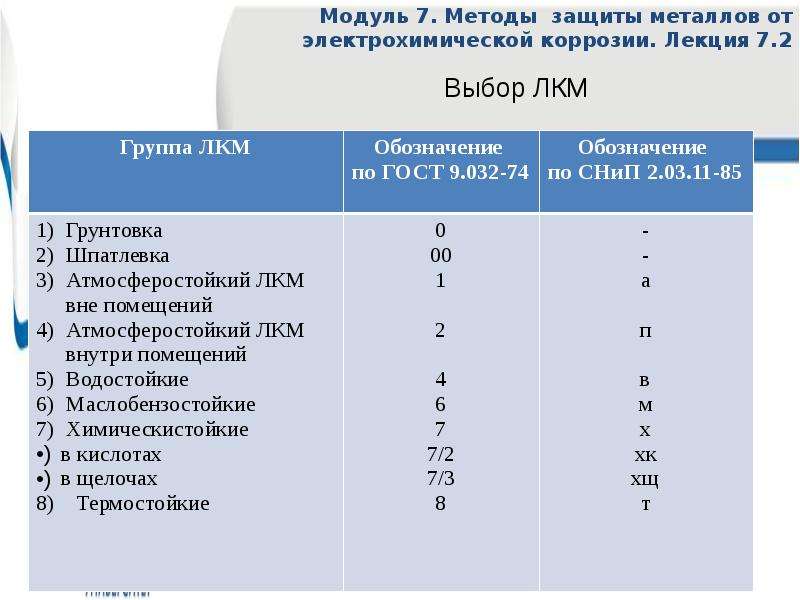
Содержание слайда: Лакокрасочные материалы
Отечественная и зарубежная промышленность выпускает 6 видов лакокрасочных материалов
Грунтовка – специальный ЛКМ с хорошим сцеплением к основе и последующим слоям.
Шпатлевка – ЛКМ для выравнивания поверхности.
Краска – ЛКМ дающий после высыхания матовую поверхность.
Эмаль –ЛКМ, позволяющий получить после высыхания блестящую поверхность или поверхность с текстурой
Лак – ЛКМ, позволяющий получать прозрачную бесцветную или окрашенную пленку, иногда черную блестящую.
№23 слайд


Содержание слайда: Лакокрасочное покрытие (ЛКП) защищает металл от коррозии за счет 2-х основных механизмов защиты:
Адгезионный механизм защиты . Сущность в том, что ЛКП затрудняет образование новой фазы – продуктов коррозии – на границе раздела металл – покрытие. Механизм работает, если покрытие хорошо сцеплено с основой.
Барьерный механизм защиты. Сущность – ЛКП изолирует металл от коррозионной среды. Механизм работает, если в покрытии нет никаких дефектов (в том числе микродефектов – микропор и микротрещин)
№24 слайд


Содержание слайда: Качество ЛКП определяется сроком его службы :
Качество ЛКП определяется сроком его службы :
До 5 лет – плохое; - До 10 лет – хорошее; - 15лет и выше – отличное.
Чтобы получить качественное лакокрасочное покрытие, необходимо обеспечить хорошую адгезию его и отсутствие в нем дефектов.
Хорошая адгезия достигается:
Качественной подготовкой металла под покрытие. Наиболее высокое качество сцепления получается на чистом металле.
Применением в качестве первого слоя – слоя грунтовки.
№25 слайд


Содержание слайда: Подготовка металла под покрытия
На 70% качество ЛКП зависит от качества подготовки металла под покрытие
На металле всегда присутствует 2 вида загрязнений:
Жиры, пыль, грязь;
2.Продукты естественной коррозии (ржавчина, оксидные пленки).
Существуют два метода удаления, присутствующих на металле, загрязнений:
1. Механический;
2. Химический;
№26 слайд


Содержание слайда: Механический способ подготовки металла под покрытие
Механический способ подготовки металла под покрытие удаляет оба вида поверхностных загрязнений и считается более эффективным. В практике используется 3 основных вида механической обработки металла.
Шлифование (обработка наждачными кругами, наждачной бумагой, напильником и т.д.)
Крацевание (обработка металлическими щетками)
Обработка летящим абразивом (пескоструй, гидропескоструй, дробеструй и т.д.)
№27 слайд


Содержание слайда: Химический способ подготовки металла под покрытие
Протекает в две стадии:
1. удаление жиров, пыли, грязи;
2. Удаление естественных продуктов коррозии.
Удаление жиров, пыли, грязи.
Растворителями(бензин, керосин, уайт – спирит и т.д.)
Применением моющих средств (на основе соды)
Удаление ржавчины:
С помощью кислотных составов с ингибиторами коррозии.
С помощью преобразователи ржавчины (ПР) или, модификаторов ржавчины (МР).
№28 слайд


Содержание слайда: Преобразование и модифицирование ржавчины
ПР и МР в своем составе содержит фосфорную кислоту (Н3РО4), которая преобразуют оксиды в более плотные упорядоченные фосфаты.
ПР и МР составы можно применять только для не застарелой или очень небольшой ржавчины или в комбинации с механической обработкой.
Считается, что качество подготовки при применении составов ПР и МР получается хуже, чем при полной очистке металла.
№29 слайд


Содержание слайда: Барьерный механизм защиты может быть реализован только в том случае если лакокрасочное покрытие будет многослойным.
Барьерный механизм защиты может быть реализован только в том случае если лакокрасочное покрытие будет многослойным.
1 слой - грунтовка является решающим слоем в системе ЛКП, работает на адгезионный и барьерный механизм защиты.
2 слой - эмаль или краска, снижается сквозная пористость.
3 слой – эмаль или краска, снижается сквозная пористость.
При получении ЛКП с длительным сроком службы (15-20 лет) количество слоев увеличивается до 4-5.
№31 слайд


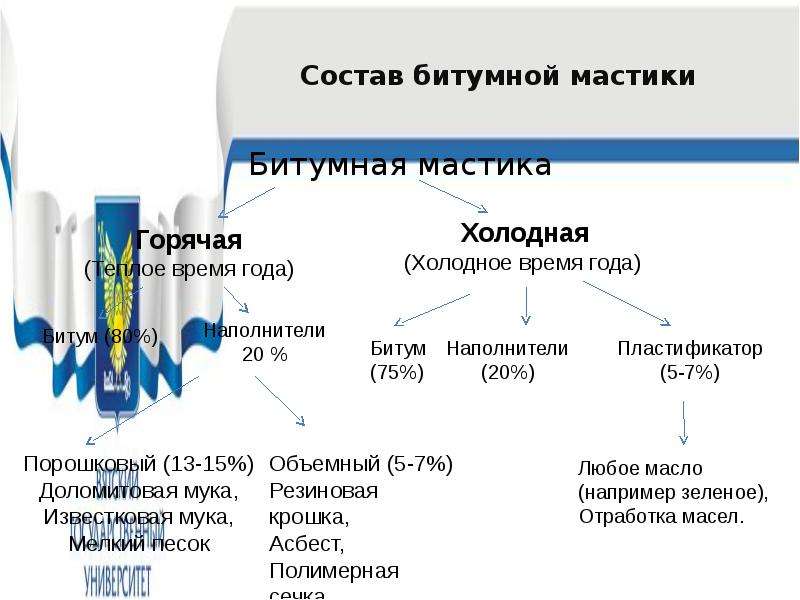
Содержание слайда: Битумные покрытия во многом напоминают ЛКП и с успехом их дополняют в условиях подземной и подводной коррозии. Для нанесения качественного битумного покрытия необходимы:
Битумные покрытия во многом напоминают ЛКП и с успехом их дополняют в условиях подземной и подводной коррозии. Для нанесения качественного битумного покрытия необходимы:
Хорошая подготовка металла под покрытие
Нанесение покрытия в несколько слоев.
По количеству наносимых слоев битумные покрытия делятся:
1. Нормальные;
2. Усиленные;
3. Весьма усиленные
№32 слайд


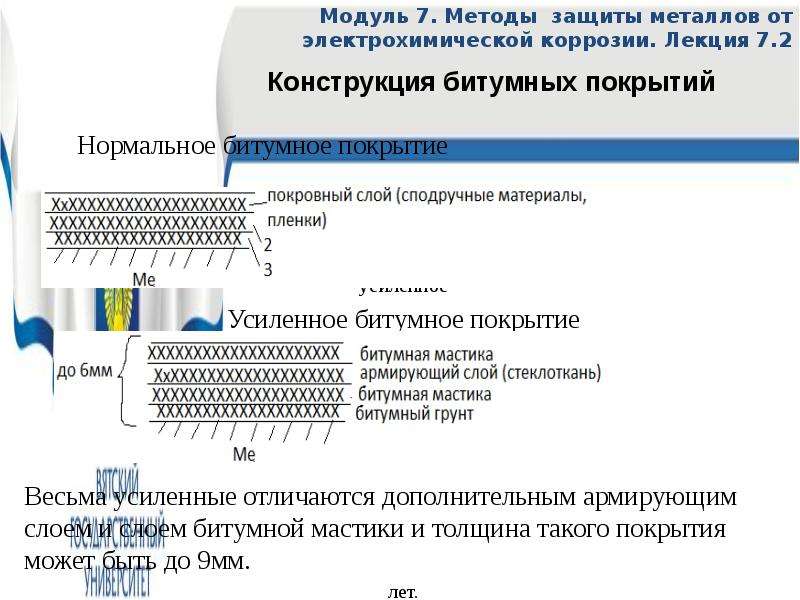
Содержание слайда: Нормальное битумное покрытие
Нормальное битумное покрытие наносится в 2 слоя:
1 слой – битумная грунтовка;
2 слой – битумная мастика.
Общая толщина нормального битумного покрытия до 3 мм.
При использовании холодной битумной мастики возможно нанесение 3-его слоя (покровный слой) из подручных материалов (оберточная бумага, битумная бумага, полиэтиленовая пленка) предотвращающего стекание холодной битумной мастики.
Нормальное битумное покрытие склонно к растрескиванию, поэтому более широко используются усиленное и весьма усиленное покрытия.
№35 слайд

Содержание слайда: Модуль 7. Методы защиты металлов от электрохимической коррозии. Лекция 7.2
Нормальное битумное покрытие
усиленное
Усиленное битумное покрытие
Весьма усиленные отличаются дополнительным армирующим слоем и слоем битумной мастики и толщина такого покрытия может быть до 9мм.
лет.
№36 слайд


Содержание слайда: Достоинства и недостатки битумных покрытий
Достоинства: Хорошее сцепление, не дорогие
Недостатки: нетехнологичны; недостаточная влагостойкость; не очень высокая биостойкость; склонны к продавливанию; со временем стареют.
Срок службы мастичных покрытий составляет 10 – 15 лет
№37 слайд

Содержание слайда: Модуль 7. Методы защиты металлов от электрохимической коррозии. Лекция 7.2
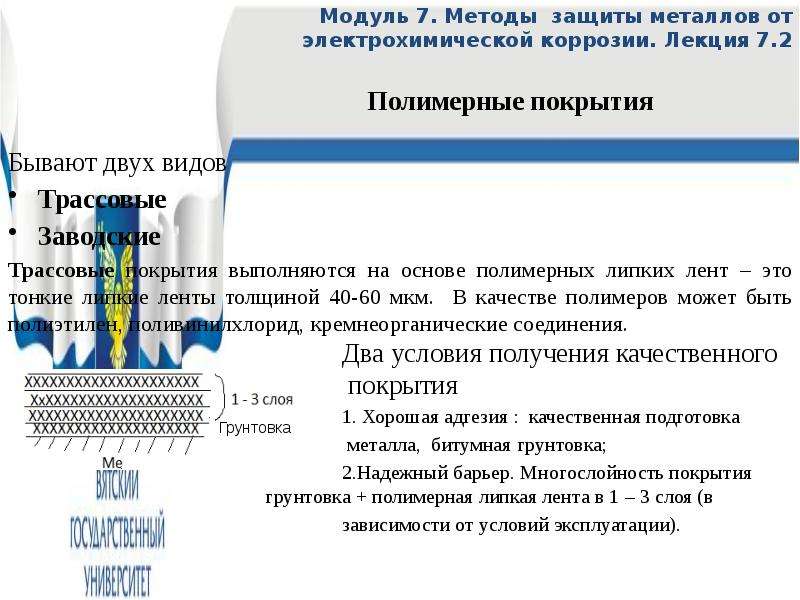
Бывают двух видов
Трассовые
Заводские
Трассовые покрытия выполняются на основе полимерных липких лент – это тонкие липкие ленты толщиной 40-60 мкм. В качестве полимеров может быть полиэтилен, поливинилхлорид, кремнеорганические соединения.
Два условия получения качественного
покрытия
1. Хорошая адгезия : качественная подготовка
металла, битумная грунтовка;
2.Надежный барьер. Многослойность покрытия грунтовка + полимерная липкая лента в 1 – 3 слоя (в
зависимости от условий эксплуатации).
№38 слайд

Содержание слайда: Модуль 7. Методы защиты металлов от электрохимической коррозии. Лекция 7.2
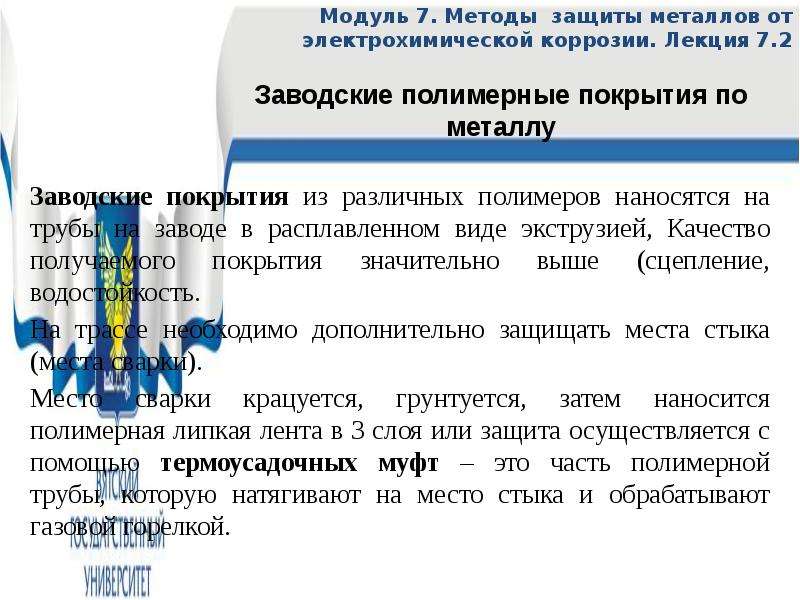
Заводские покрытия из различных полимеров наносятся на трубы на заводе в расплавленном виде экструзией, Качество получаемого покрытия значительно выше (сцепление, водостойкость.
На трассе необходимо дополнительно защищать места стыка (места сварки).
Место сварки крацуется, грунтуется, затем наносится полимерная липкая лента в 3 слоя или защита осуществляется с помощью термоусадочных муфт – это часть полимерной трубы, которую натягивают на место стыка и обрабатывают газовой горелкой.
№39 слайд
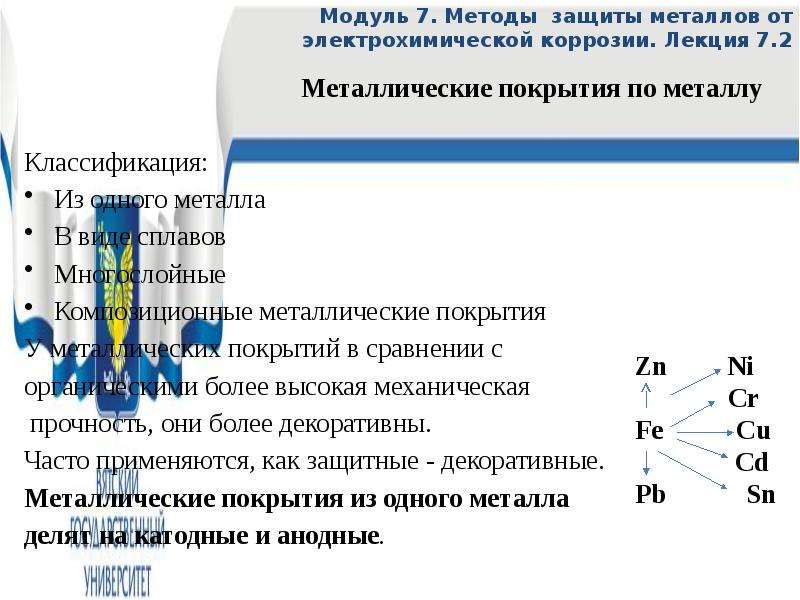

Содержание слайда: Модуль 7. Методы защиты металлов от электрохимической коррозии. Лекция 7.2
Классификация:
Из одного металла
В виде сплавов
Многослойные
Композиционные металлические покрытия
У металлических покрытий в сравнении с
органическими более высокая механическая
прочность, они более декоративны.
Часто применяются, как защитные - декоративные.
Металлические покрытия из одного металла
делят на катодные и анодные.
№40 слайд


Содержание слайда: Модуль 7. Методы защиты металлов от электрохимической коррозии. Лекция 7.2
Катодные – это покрытия, у которых потенциал металла покрытия более положительный, чем металла основа. Катодные покрытия защищает металл только механически. Для железа к ним относятся Ni, Cr, Cu, Sn, Pb. Эффективность защитного действия катодного покрытия не высока и оно защищает металл основы только в том случае, если в нем нет пор.
Анодные – это покрытия металлом более отрицательным по потенциалу, чем металл основы. Они защищают основу не только механически, но и по принципу протекторной защиты: Zn на Fe, Cd на Fe в условиях морской коррозии, когда его потенциал смещается и становится отрицательнее Fe. Анодным покрытием является Sn на Fe, в органических кислотах в отсутствии кислорода.
№41 слайд


Содержание слайда: Основное металлическое покрытие, широко применяемое в машиностроении и строительстве – это Zn.
Основное металлическое покрытие, широко применяемое в машиностроении и строительстве – это Zn.
Наносится: горячим способом, гальваническим цинкованием.
Преимущества: надежная защита, особенно при атмосферной коррозии, в том числе электрохимическая; высокие механические характеристики, красивый декоративный вид.
Брак: белая ржавчина;
Холодное цинкование: гальванол, цинканол (разновидность ЛКП с дополнительной протекторной защитой, но проще в технологии, чем горячее и гальваническое цинкование).
№42 слайд


Содержание слайда: Многослойные покрытия
Для повышения защитных свойств катодных покрытий их часто делают многослойными. Такие покрытия применяются давно и самым распространенным многослойным покрытием является Cu – Ni – Cr. Это защитно-декоративное покрытие. Оно имеют хороший внешний вид и сохраняет его длительное время.
Рассмотрим как защищает железо такое покрытие: исходим из того, что из-за многослойности сквозной пористости в покрытии нет, однако в тонком слое хрома их много. Поэтому при попадании электролита на изделие начинает работать пара Ni – Cr, в которой более активным металлом является Ni .
№43 слайд


Содержание слайда: Коррозия покрытия Cu – Ni – Cr
Коррозионный очаг в никелевом слое распространяется по сфере под порой в слое Cr.
Как только сфера доходит до слоя меди, начинает корродировать контактная тройка металлов Cu – Ni – Cr, в которой наиболее отрицательным металлом является Cu.
Поэтому коррозионный очаг также по сфере начинает развиваться в слое Cu. Причем продукты коррозии и Ni, и Cu не объемные и внешне на детали коррозия не проявляется.
Как только сфера доходит до Fe считается, что защитное действие покрытия закончилось, начинает корродировать железо с образованием объемных продуктов.
Т.о. защитная способность покрытия Cu – Ni – Cr обеспечивается толщиной слоев Ni и Cu
№44 слайд


Содержание слайда: Коррозия многослойных покрытий
В последствие появились более сложные многослойные покрытия, обеспечивающие более длительную защиту Fe от коррозии при таком же расходе Cu, Ni, и Cr на покрытие, например покрытие Би-никель.
Коррозия покрытия Би-никель тормозится на стадии коррозии никеля матового в связи с чем такое покрытие служит дольше.
№45 слайд
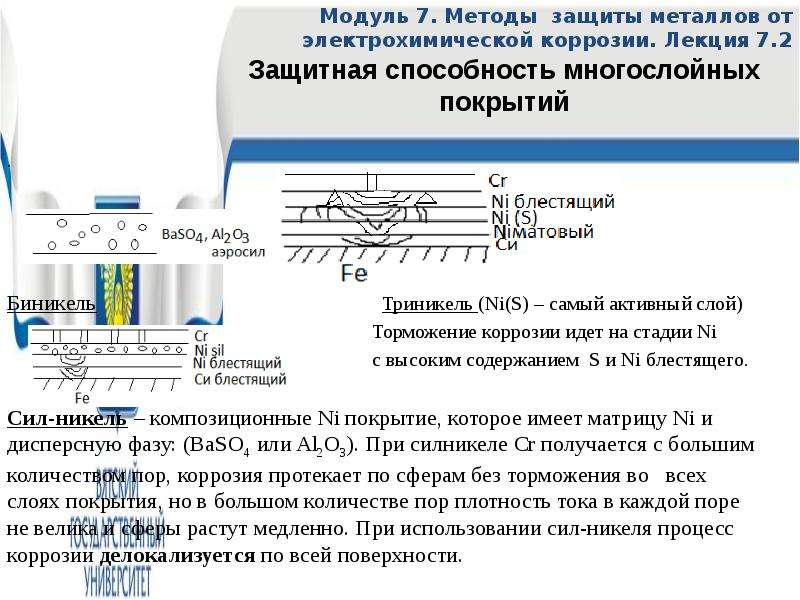

Содержание слайда: Модуль 7. Методы защиты металлов от электрохимической коррозии. Лекция 7.2
.
Биникель Триникель (Ni(S) – самый активный слой)
Торможение коррозии идет на стадии Ni
с высоким содержанием S и Ni блестящего.
Сил-никель – композиционные Ni покрытие, которое имеет матрицу Ni и дисперсную фазу: (BaSO4 или Al2O3). При силникеле Cr получается с большим количеством пор, коррозия протекает по сферам без торможения во всех слоях покрытия, но в большом количестве пор плотность тока в каждой поре не велика и сферы растут медленно. При использовании сил-никеля процесс коррозии делокализуется по всей поверхности.
№46 слайд


Содержание слайда: Модуль 7. Методы защиты металлов от электрохимической коррозии. Лекция 7.2
Иногда сплавы защищают от коррозии лучше, чем покрытие из одного металла.
Это обеспечивается: 1) более надежной пассивацией сплавов в условиях атмосферной коррозии (например бронзы пассивируются лучше, чем медь,
2) смещением потенциала покрытия в положительную сторону.
Zn – Cd легирующие элементы обеспечивают смещение
Zn – Pb потенциала в положительном направлении, анодный
Zn – Ni характер покрытия сохраняется, но контактная пара работает
Zn – Sn менее активно.
3) Второй элемент сплава работает как катодная присадка, способствуя пассивации основного металла покрытия (Ni-Pd)
№47 слайд
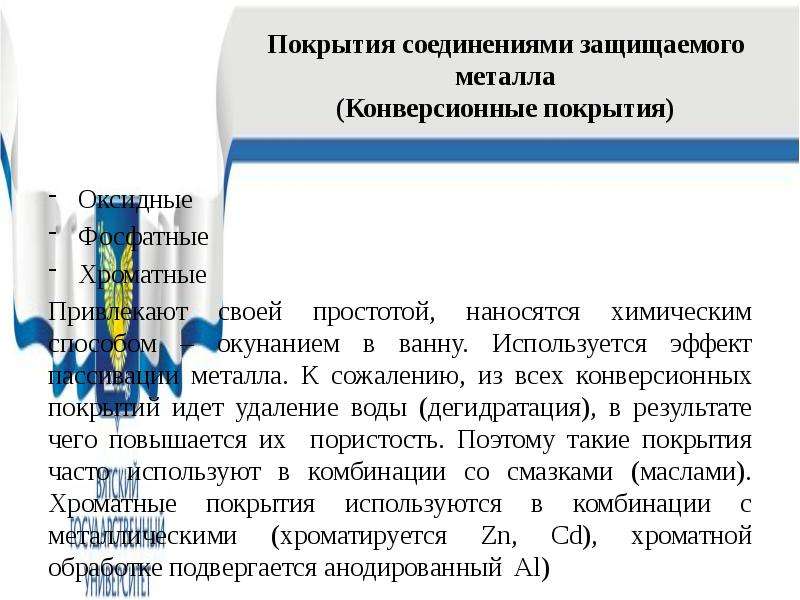

Содержание слайда: Покрытия соединениями защищаемого металла
(Конверсионные покрытия)
Оксидные
Фосфатные
Хроматные
Привлекают своей простотой, наносятся химическим способом – окунанием в ванну. Используется эффект пассивации металла. К сожалению, из всех конверсионных покрытий идет удаление воды (дегидратация), в результате чего повышается их пористость. Поэтому такие покрытия часто используют в комбинации со смазками (маслами). Хроматные покрытия используются в комбинации с металлическими (хроматируется Zn, Cd), хроматной обработке подвергается анодированный Al)
№49 слайд


Содержание слайда: К активным компонентам вызывающим электрохимическую коррозию и увеличивающим ее скорость являются: Н2O, О2, Н+, CI-, SO2-4, SO2, H2S и др.
К активным компонентам вызывающим электрохимическую коррозию и увеличивающим ее скорость являются: Н2O, О2, Н+, CI-, SO2-4, SO2, H2S и др.
Удаление Н2O - осушка атмосферы:
- Естественная вентиляция помещений;
- силикагель в замкнутом объеме (превращение электрохимической коррозии в химическую)
- навесы (при хранении техники)
- дренаж (с помощью канав при подземной коррозии)
Удаление О2, Н+, CI- , SO2-4, SO2, H2S :
- принудительная вентиляция
- замена грунта (кислого, засоленного)
- системы оборотного водоснабжения
№50 слайд


Содержание слайда: Ингибиторы коррозии – это вещества замедляющие коррозию, но не изменяющие других физико – химических характеристик металла.
Ингибиторы коррозии – это вещества замедляющие коррозию, но не изменяющие других физико – химических характеристик металла.
Обычно применять ингибиторы можно, когда объем коррозии среды ограничен.
Эффективность любого ингибитора может быть оценена:
коэффициентом торможения
, где К0 – показатель скорости коррозии без ингибитора
К1 – показатель скорости коррозии в присутствии ингибитора
2) степенью защиты
100%
№51 слайд


Содержание слайда: Существует несколько классификаций ингибиторов.
Существует несколько классификаций ингибиторов.
По механизму действия: физические и химические
Физические – механизм действия основан на физической адсорбции. Адсорбция зависит от того, насколько близок Етнз к Екор
Если Енз=Екор то лучше всего адсорбируются нейтральные молекулы, если металл при Екор заряжен «-», адсорбируются катионы, если заряжен металл имеет заряд «+» - анионы.
Физические ингибиторы делятся на:
Органические катионы
Нейтральные молекулы
Органические анионы
Для физических ингибиторов
характерно понятие – оптимальная
концентрация ингибиторов.
№52 слайд


Содержание слайда: 2. Химические – ингибиторы, вступают во взаимодействие с металлом или средой.
2. Химические – ингибиторы, вступают во взаимодействие с металлом или средой.
2.1 Хемосорбционные (механизм - хемосорбция)
2.2. Окислители и пассиваторы - вещества типа NaNO3, NaNO2 хроматы. (Вещества, образующие оксидные или хроматные пассивные пленки)
2.3. Образователи покровных пленок (механизм основан на солевой пассивации – образуются труднорастворимые пленки – Na2SiO3, карбонаты, фосфаты)
2.4 Дестимуляторы – вещества, поглощающие кислород из коррозионной среды - Na2SO3, гидразин - N2Н4
2.5 Электрохимические ингибиторы – повышают перенапряжение выделения водорода:As3+ , Sb3+ , Bi3+
№53 слайд

Содержание слайда: Для химических ингибиторов: окислителей, пассиваторов и образователей покровных пленок существует понятие, критическая концентрация ингибитора (Скр), минимальная концентрация ингибитора, которая обеспечивают получение оксидной или пассивной пленки на всей поверхности металла.
Для химических ингибиторов: окислителей, пассиваторов и образователей покровных пленок существует понятие, критическая концентрация ингибитора (Скр), минимальная концентрация ингибитора, которая обеспечивают получение оксидной или пассивной пленки на всей поверхности металла.
Классификация по виду сред, в которых используются ингибиторы
Ингибиторы кислотной коррозии
Ингибиторы в нейтральных средах
Ингибиторы атмосферной коррозии
Ингибиторы щелочной коррозии
№54 слайд


Содержание слайда: Ингибиторы кислотной коррозии
Ингибиторы кислотной коррозии
Широко используются:
В процессах травления металла, при удалении с них ржавчины и окалины;
В техпроцессах, где используются кислоты для снижения коррозии оборудования;
При транспортировке кислот.
Ингибиторы должны не изменять скорости растворения окалины и ржавчины, а должны уменьшать скорость коррозии железа.
Для ингибиторов кислотной коррозии предложена шкала эффективности ингибитора. Монография С.М.Решетникова – ингибиторы кислотной коррозии металлов (Ленинград – Химия, 80г.)
№55 слайд


Содержание слайда: Ингибиторы атмосферной коррозии.
Ингибиторы атмосферной коррозии.
Летучие – легко переходящие в паровую фазу (легко испаряются, легко сублимируются). Механизм действия – это физические ингибиторы, органические легколетучие соединения. Чтобы применять летучие ингибиторы – нужно ограничить объем коррозионной среды (атмосферы). Применяются в комбинации с упаковочными материалами: раньше – битумная (черная) бумага, парафинированная бумага, сейчас – полиэтилен (герметизация обязательна).
Контактные ингибиторы. Они наносятся кистью, мойкой, окунанием. Обычно это растворы химических ингибиторов – пассиваторов (образователей покровных пленок). Иногда наносятся в виде загущенных растворов.
№57 слайд


Содержание слайда: Введение ингибиторов в жидкую коррозионную среду в определенной концентрации.
Изделия помещают в атмосферу, насыщенную парами ингибиторов (ингибированная бумага, мешочек, пористые носители Линосил и Линопоп).
Продувка ингибированным воздухом больших полостей.
Контактные ингибиторы (нанесение в виде пленки).
Введение ингибиторов в смазочные масла, смазочноохлаждающиеся жидкости, смазки.
№58 слайд


Содержание слайда: Изменение условий коррозии
Под изменением условий коррозии понимают:
Рациональное конструирование с целью снижения скорости коррозии, создаваемой конструкции;
Электрохимическую защиту металлов, при которой за счет изменения потенциала корродирующего металла снижается его скорость коррозии
№59 слайд


Содержание слайда: От вида конструкции скорость коррозии может меняться в несколько раз.
От вида конструкции скорость коррозии может меняться в несколько раз.
В каждой области существуют свои приемы рационального конструирования. Однако можно выделить несколько общих приемов рационального конструирования:
Рациональный выбор материала для создаваемой конструкции.
Учитывать возможность контактной коррозии (если конструкции выполняется из разных материалов)
В конструкции нужно уменьшать количество застойных зон и зазоров.
При сварке шва (лучше всего варить менее активным, т.е. более положительным, металлом)
№60 слайд


Содержание слайда: Рациональное конструирование
По возможности сварной шов необходимо отжигать;
Сварка – в стык предпочтительнее, чем внахлест;
При создании химических аппаратов желательно предотвращать локализованное поступление жидкостей в реактор;
Желательно, чтобы в реакторе или теплообменнике не было больших перепадов температур;
Предотвращать утечки тока из реакторов;
Предусматривать методы защиты конструкций от коррозии. (Чаще всего комбинацию методов).
№64 слайд


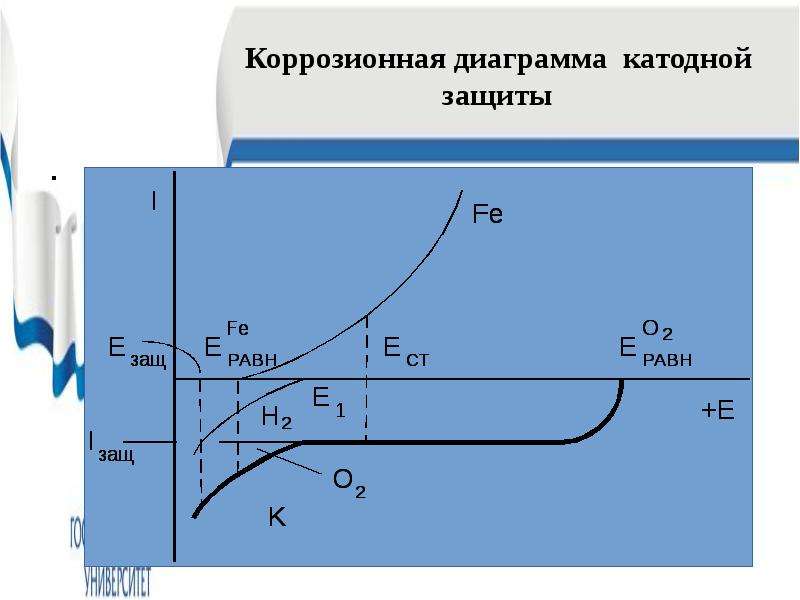
Содержание слайда: Используется: 1. Для защиты магистральных подземных трубопроводов;
2. Для защиты оборудования при добыче нефти ( в частности для защиты обсадных колонн);
3. Для защиты от морской коррозии (платформы, трубопроводы.
Основные элементы катодной защиты:
1. Станция катодной защиты;
2. Электрод сравнения;
3. Анодный заземлитель ( вспомогательный электрод, анод)
№65 слайд


Содержание слайда: Протекторная защита основана на особенностях коррозии двух металлов в контакте. Согласно теории контактной коррозии, при контакте положительного металла М2 с более отрицательным М1 потенциал металла М2 смещается в отрицательную сторону, коррозия его при этом уменьшается или полностью прекращается.
№67 слайд


Содержание слайда: Используется: 1. Для защиты магистральных подземных трубопроводов;
2. Для защиты оборудования при добыче нефти;
3. Для защиты от морской коррозии (платформы, трубопроводы, танкеры);
4. Для защиты внутренней поверхности резервуаров для хранения нефти и ее продуктов:
5. Для защиты заглубленных резервуаров для хранения пожароопасных и взрывоопасных веществ;
6. Для защиты днищ резервуаров для хранения топлива.
№68 слайд


Содержание слайда: Протектор: Zn, Al, Mg.
Zn – в грунтах с p ≤ 20ом м, солевая, морская коррозии;
Al - солевая и морская коррозия;
Mg (сплав Al, Zn, Mn, Mg,)
5-9 %, 2-3%, 0,15-0,8, остальное
Al – увеличивает эффективность сплава, литейные и механические свойства;
Zn - повышает кпд, уменьшает вредное влияние примесей Cu, и Ni;
Mn – Осаждает вредную примесь Fe
Скачать все slide презентации Основы коррозии и защиты металлов. Химическая коррозия одним архивом:
Похожие презентации
-
 Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии -
 Методы защиты металлов от электрохимической коррозии. Классификация методов защиты
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты -
 Основы коррозии и защиты металлов. Виды коррозии металлов
Основы коррозии и защиты металлов. Виды коррозии металлов -
 Основы коррозии и защиты металлов
Основы коррозии и защиты металлов -
 Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии -
 Методы защиты металлов от электрохимической коррозии
Методы защиты металлов от электрохимической коррозии -
 По Химии "Характеристика химического элемента – неметалла на основании его положения в Периодической системе хими
По Химии "Характеристика химического элемента – неметалла на основании его положения в Периодической системе хими -
 Химия Изучение коррозии и защиты металлов
Химия Изучение коррозии и защиты металлов -
 Коррозия и защита металлов
Коррозия и защита металлов -
 Основы химической коррозии
Основы химической коррозии