Презентация Химия Изучение коррозии и защиты металлов онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Химия Изучение коррозии и защиты металлов абсолютно бесплатно. Урок-презентация на эту тему содержит всего 34 слайда. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Химия Изучение коррозии и защиты металлов
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:34 слайда
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:6.22 MB
- Просмотров:93
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№3 слайд


Содержание слайда: Задачи
изучить литературу по теме исследований;
исследовать коррозийную устойчивость оксидных пленок:
сделать вывод о защитных свойствах различных участков оксидной пленки, образующейся на металле:
сравнить скорость появления медных пятен на поверхности стальной пластинки;
сделать фотографии медных пятен;
рассмотреть процессы коррозии оцинкованного железа и луженой жести и сравнить их;
определить радиус действия цинкового протектора при защите стали в растворах хлорида натрия различной концентрации;
составить график, выражающий зависимость радиуса действия протектора от концентрации растворов хлорида натрия.
№5 слайд


Содержание слайда: Коррозия
Самопроизвольное разрушение металлов и металлических материалов (сплавов) под воздействием окружающей среды называется коррозией
Существуют разные виды коррозии металлов и их сплавов. Наиболее распространены два вида:
а) Химическая коррозия
б) Электрохимическая коррозия
№9 слайд


Содержание слайда: Химическая коррозия
Химическая коррозия- это вид коррозии, обусловленный непосредственным взаимодействием металла или сплава с сухими газами, жидкостями, не являющимися электролитами, твёрдыми веществами. Суть её заключена в окислении металла в процессе непосредственного химического взаимодействия с веществами окружающей среды (газовая, жидкостная коррозия).
Примером газовой коррозии может служить окисление железа в атмосфере хлора:
№10 слайд


Содержание слайда: Электрохимическая коррозия
Электрохимическая коррозия - наиболее рапространённый вид коррозии, приносящий наибольший вред металлам и изделиям из них. Электрохимическая коррозия возникает при контакте двух и более металлов одного сплава или металла с поверхностью изделия из другого металла и в присутствии воды или другого электролита.
№12 слайд


Содержание слайда: Опыт №1
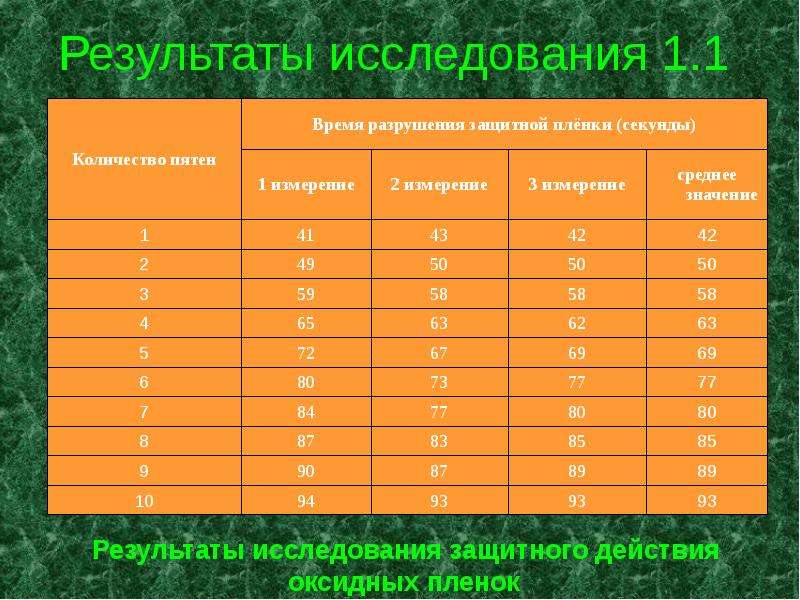
Испытание коррозийной устойчивости оксидных плёнок
Объект исследования: стальная пластинка длиной 25 см, шириной 2 см, очищенная наждачной бумагой.
Методика проведения исследования.
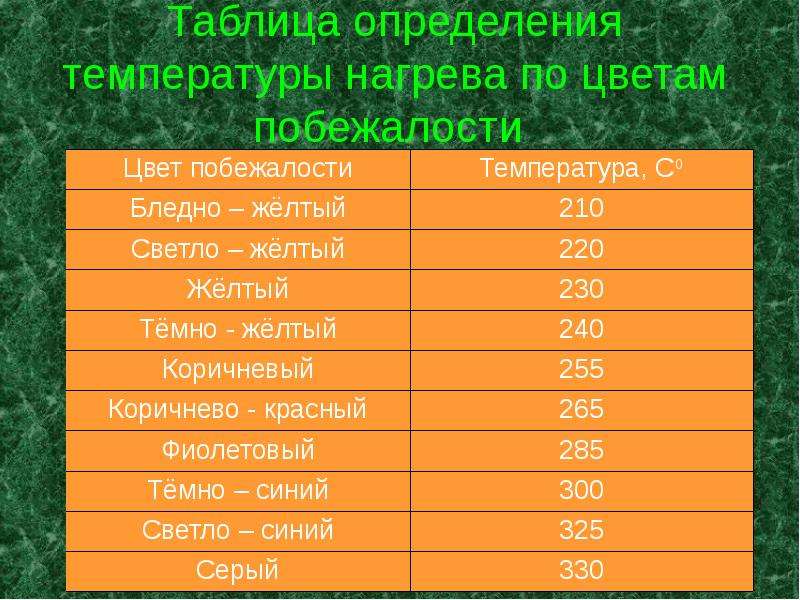
Один конец пластинки зажимают держателем лабораторного штатива, а другой помещают над пламенем спиртовки. На пластинке (по мере ее нагревания) появляются цвета побежалости. Пластинку снимают с огня и охлаждают. На охлажденную пластинку через каждые 2 см по длине пластинки наносят по капле 0, 1 М раствора кристаллогидрата сульфата меди (CuSO4 * 5 H2O). По скорости появления медного пятна судят о защитных свойствах различных участков оксидной пленки, образующейся на металле. Скорость появления пятна определяют секундомером. [2]
№18 слайд


Содержание слайда: Опыт №2
Коррозия оцинкованного железа и луженой жести
Объекты исследования: пластинки стальные, цинковые и оловянные.
Методика проведения эксперимента.
В стакан емкостью 200 мл наливают дистиллированную воду, к ней добавляют 20 капель концентрированного раствора серной кислоты и 5-6 капель раствора красной кровяной соли K3 [Fe(CN)6] Раствор размешивают и разливают поровну в два других стакана емкостью 100 мл. В один из них погружают стальную пластинку с присоединенной к ней пластинкой (кусочком) цинка. В другой стакан погружают такую же пластинку, соединенную с пластинкой олова. Через некоторое время сравнивают окраску растворов в стаканчике №1 и №2. [2]
№21 слайд


Содержание слайда: Результаты исследования 2.2
Стакан №2
б) система Fe – Sn: К(+)Sn → 2 e- + 2H+ (из раствора) = Н2
А(-)Fe e- → Fe2+ в растворе
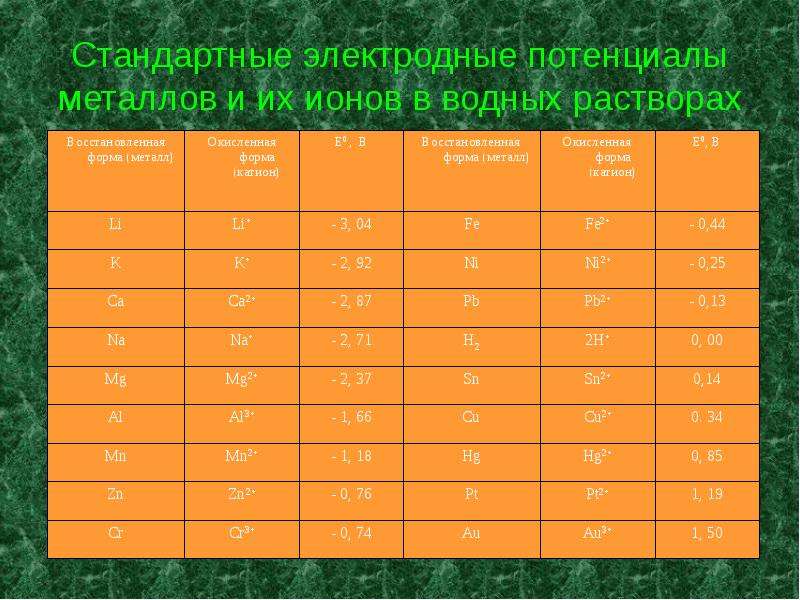
Е0 (Sn2+|Sn) = - 0,14 В; Е0 (Fe2+ | Fe) = - 0,44В.
Е = E0 (Sn2+ | Sn) - Е0 (Fe2+| Fe) ; Е = [-0, 14 – (-0,44)] = 0, 30 В.
2K3[Fe(CN)6] + 3FeSO4 → Fe3[Fe(CN)6]2 ↓ + 3K2SO4
№22 слайд


Содержание слайда: Опыт №3
Электрохимическая защита металлов от коррозии (протекторная защита)
Объект исследования: стальной стрежень (зачищенный наждачной бумагой, промытый в воде и обёрнутый фильтровальной бумагой) длиной 25 см и диаметром 8 мм на одном конце, которого прикреплён кусок цинка длиной 1см.
Методика проведения эксперимента:
Приготавливают по 2 л 0,1%(№1), 0,2%(№2), 0,3%(№3) , 1,5%(№4) растворов хлорида натрия; 10% раствор красной кровяной соли.
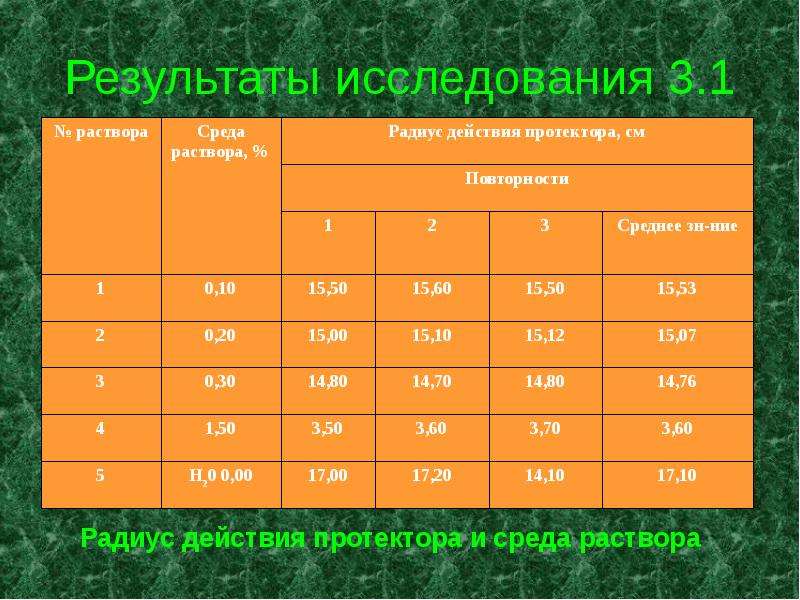
К 2 л каждого из приготовленных растворов хлорида натрия приливают по 1 мл 10% раствора красной кровяной соли и перемешивают. В ванну для раствора ставят стальной стержень на стальных подставках (рис.). Раствор №1 вливают через воронку, доходящую до дна ванны. Через 10-15 минут при помощи миллиметровой линейки определяют расстояние от места прикрепления протектора до первого синего пятна на стальном стержне.
Выливают раствор №1, вынимают образец, тщательно промывают его под струей водопроводной воды и протирают фильтровальной бумагой. Ванну и подставки ополаскивают водопроводной водой.
Радиус действия протектора в растворе №1 и других растворах определяют так же, как в растворе №1. Такой же опыт проводят с водопроводной водой. [2]
№31 слайд


Содержание слайда: Заключение 4.
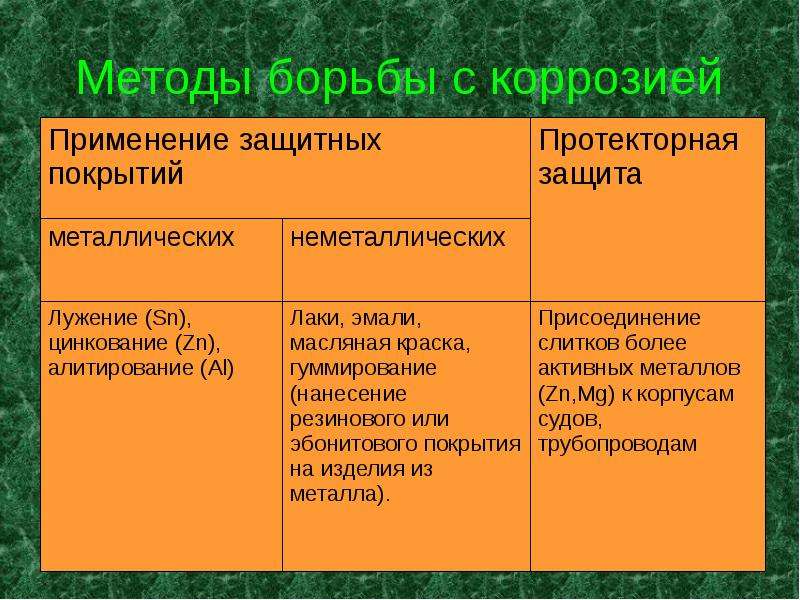
Нами было проведено сравнение оцинкованного железа и луженой жести, в ходе которого выяснено, что при коррозии оцинкованного железа вначале растворяется не железо, а цинк этот способ защиты металла от коррозии называется протекторным, т.е., железо можно предохранить от коррозии путем соединения его с более активным металлом
№32 слайд


Содержание слайда: Заключение 5.
В опыте действие цинкового протектора при защите стали в растворах хлорида натрия различной концентрации, мы выяснили, что радиус действия протектора зависит от среды электролита. Расстояние, на которое распространяется защитное действие протектора, тем больше, чем выше электрическая проводимость среды, в которой находится защищаемый металл, и чем больше разность потенциалов протектора и металла. В нашем опыте разность потенциалов: Е0 (Zn2+ |Zn) = - 0,76 В; Е0 (Fe2+ | Fe) = - 0,44 В.
Е = Е0 (Fe2+ | Fe) - E0 (Zn2+ | Zn) ; Е = [-0, 44 – (-0,76)] = 0, 32 В.
Скачать все slide презентации Химия Изучение коррозии и защиты металлов одним архивом:
Похожие презентации
-
 Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии -
 Основы коррозии и защиты металлов. Химическая коррозия
Основы коррозии и защиты металлов. Химическая коррозия -
 Методы защиты металлов от электрохимической коррозии. Классификация методов защиты
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты -
 Коррозия и защита металлов
Коррозия и защита металлов -
 Защита металлов от коррозии
Защита металлов от коррозии -
 Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии -
 Основы коррозии и защиты металлов. Виды коррозии металлов
Основы коррозии и защиты металлов. Виды коррозии металлов -
 Основы коррозии и защиты металлов
Основы коррозии и защиты металлов -
 Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии -
 Методы защиты металлов от электрохимической коррозии
Методы защиты металлов от электрохимической коррозии