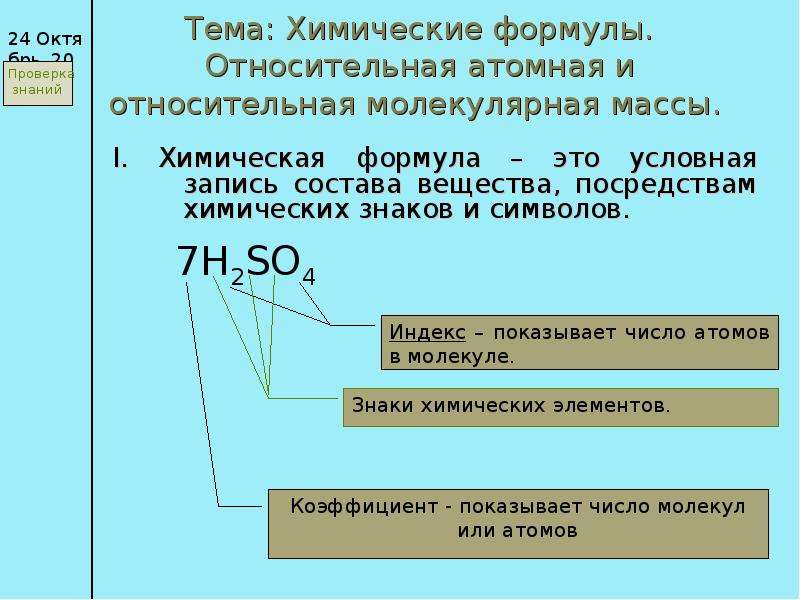
Презентация Повторение: 1) Относительная атомная масса – Аr (указана в ПСХЭ Д. И. Менделеева) Пример: Аr (Na) 23 онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Повторение: 1) Относительная атомная масса – Аr (указана в ПСХЭ Д. И. Менделеева) Пример: Аr (Na) 23 абсолютно бесплатно. Урок-презентация на эту тему содержит всего 12 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:12 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:3.14 MB
- Просмотров:79
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
Скачать все slide презентации Повторение: 1) Относительная атомная масса – Аr (указана в ПСХЭ Д. И. Менделеева) Пример: Аr (Na) 23 одним архивом:
Похожие презентации