Презентация Псевдогалогены и их соединения онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Псевдогалогены и их соединения абсолютно бесплатно. Урок-презентация на эту тему содержит всего 36 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Псевдогалогены и их соединения
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:36 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:1.33 MB
- Просмотров:64
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: Общие замечания
ПГ – это молекулы, состоящие более чем из двух электроотрицательных атомов, которые в свободном состоянии напоминают молекулы галогенов (Биркенбах, 1925 г.)
наиболее важные ПГ: дициан (CN)2, диоксоциан (OCN)2, дитиоциан (SCN)2, диселеноциан (SeCN)2, азидокарбондисульфид (SCSN3)2
ПГ образуют ионы, напоминающие по свойствам галогениды: CN-, N3-, NCO-, CNO-, SCN-, SeCN-, N(CN)2-, C(CN)3-
№3 слайд


Содержание слайда: Условия отнесения вещества к псевдогалогенам или псевдогалогенидам
ПГ должен быть летучим веществом, состоящем из симметричной комбинации X-X
ПГ должен реагировать с металлами с образованием солей, содержащих X-
их соли AgX и PbX2 должны быть нерастворимы в воде
должны существовать кислоты HX
№4 слайд


Содержание слайда: Условия отнесения вещества к псевдогалогенам или псевдогалогенидам
радикалы ПГ должны образовывать соединения между собой X-X’ и с галогенами
псевдогалогенид-ионы должны образовывать комплексы, такие же, как галогенид-ионы
псевдогалогениды должны образовывать ковалентные соединения
X- должен окисляться до X2 подходящим окислителем
№6 слайд
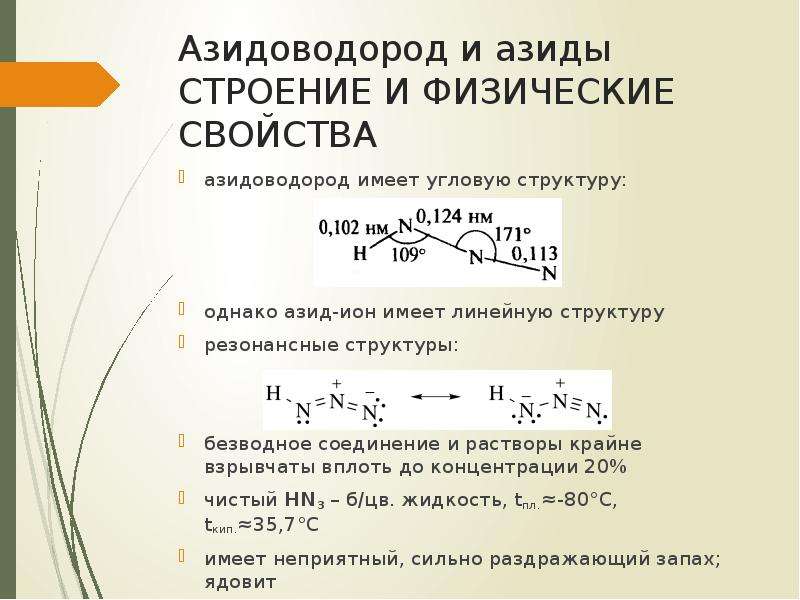

Содержание слайда: Азидоводород и азиды
строение и физические свойства
азидоводород имеет угловую структуру:
однако азид-ион имеет линейную структуру
резонансные структуры:
безводное соединение и растворы крайне взрывчаты вплоть до концентрации 20%
чистый HN3 – б/цв. жидкость, tпл.≈-80°С, tкип.≈35,7°С
имеет неприятный, сильно раздражающий запах; ядовит
№7 слайд


Содержание слайда: Азидоводород и азиды
химические свойства
азидоводородная кислота по силе сравнима с уксусной (pKa=4,64)
через водородную связь может присоединяться азид-ион, образуя N3HN3-
взаимодействует с металлами
на свету и при нагревании разлагается, под УФ в присутствии серной кислоты разлагается с образованием гидроксиламина
с сильными кислотами ведет себя как основание
№8 слайд


Содержание слайда: Азидоводород и азиды
химические свойства
азидоводородная кислота может проявлять как сильные окислительные:
HN3 + 3H+ + 2e- → N2 + NH4+ (E° = 1,96 В)
так и сильные восстановительные свойства:
2HN3 → 2H+ + 3N2 + 2e- (E° = -3,09 В)
азиды Ag(I), Hg(II), Pb(II), Cu(I), Tl(I) плохо растворимы в воде, а азиды ЩМ и ЩЗМ имеют ионную структуру
за исключением CsN3, ионные азиды плавятся с разложением
азиды ТМ от нагревания или трения детонируют
№12 слайд


Содержание слайда: Азидоводород и азиды
химические свойства
наиболее стабильные изомеры N6- (расчет):
азидоводород при реакции с аммиаком образуем азид аммония
азид аммония детонирует
при реакции гидразина с азидоводородной кислотой получается азид гидразиния (также получается при разложении 5-аминотетразола и транс-2-тетразола)
при сильном нагревании азид гидразиния разлагается
№13 слайд


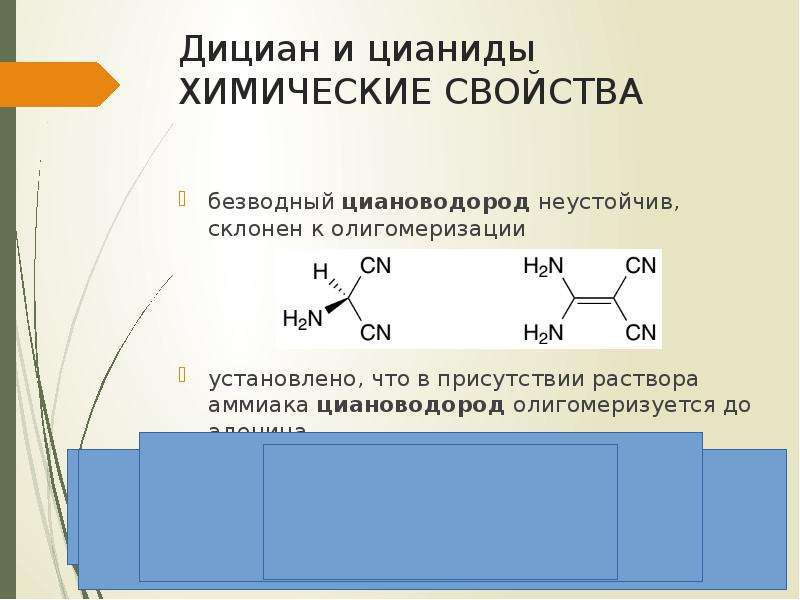
Содержание слайда: Дициан и цианиды
получение
дициан образуется при горении угля в электрической дуге в атмосфере азота
… при нагревании цианидов ртути или серебра
… при нагревании смеси желтой кровяной соли с сулемой
… при сухой перегонке оксалата аммония в присутствии оксида фосфора(V)
… при пропускании сухого циановодорода над нагретым до 250°С пиролюзитом
№14 слайд


Содержание слайда: Дициан и цианиды
получение
… при окислении циановодорода воздухом на серебряном катализаторе
… при окислении циановодорода хлором на активированном угле
… при действии на цианиды ЩМ солями меди (II) или подкисленным пероксодисульфатом (S2O82-)
циановодород получается при подкислении цианидов
… при реакции метана и аммиака
№15 слайд


Содержание слайда: Дициан и цианиды
получение
цианиды ЩМ можно получить при прокаливании амидов с углем
… при разложении комплексных цианидов
… при нагревании карбонатов с углеродам в токе азота
цианид аммония получается при пропускании аммиака и сероуглерода над нагретой медью
остальные цианиды получаются при обменных реакциях в растворах
№16 слайд


Содержание слайда: Дициан и цианиды
строение и физические свойства
дициан имеет линейную структуру
это бесцветный, горючий, токсичный газ (tпл. = -28°С, tкип. = -21°С)
дициан кинетически стабилен, но эндотермичен (ΔHf° = 297 кДж/моль)
циановодород также имеет линейную структуру
это бесцветная, очень токсичная и летучая жидкость (tпл. = -13,4°С, tкип. = 25,6°С) с запахом горького миндаля
№17 слайд


Содержание слайда: Дициан и цианиды
химические свойства
дициан при нагревании до 300-500°С полимеризуется до парациана
парациан нерастворим в воде, спирте, жидком циановодороде, но растворим в холодной концентрированной серной кислоте
при нагревании до 800-850°С в токе азота переходит обратно в дициан
дициан горит фиолетовым цветом самым горячим пламенем (4777°С)
№18 слайд


Содержание слайда: Дициан и цианиды
химические свойства
дициан в щелочных растворах гидролизуется
медленнее в нейтральных растворах
при нагревании выше 1000°С диссоциирует до моноциана
по химической активности дициан можно расположить между бромом и иодом
раствор циановодорода в воде – слабая кислота (pKa = 9,3)
имеет высокую диэлектрическую проницаемость – 114,9 (у воды – 81) за счет ассоциации молекул (μ = 2,930)
№20 слайд


Содержание слайда: Дициан и цианиды
химические свойства
циановодород и его производные реагируют с азидоводородом с образованием тетразола или его производных
при продолжительном кипячении ионных цианидов происходит разложение
при их сплавлении с серой или полисульфидами получаются тиоцианаты (тиоцианат аммония получается при выдерживании цианиды в растворе со свежеосажденной серой)
а при нагревании с оксидом-окислителем получаются цианаты
при взаимодействии галогенов с цианидами образуются галогеноцианы
№23 слайд


Содержание слайда: Дициан и цианиды
химические свойства
цианхлорид – токсичный газ – также получается при электролизе водного раствора HCN и NH4Cl
тримеризуется с образованием цианурхлорида
фторирование цианурхлорида приводит к образованию цианурфторида, который при нагревании разлагается до цианфторида
цианфторид – токсичный газ
цианбромид и цианиодид можно получить при нагревании цианида с галогеном
№24 слайд


Содержание слайда: Диоксоциан, цианаты и их изомеры
получение
есть предположение, что диоксоциан может получаться при реакции AgOCN с бромом, НО убедительных доказательств до сих пор нет
согласно недавним исследованиям в этой и других подобных реакциях получается диизооксоциан и производные оксоциана
№25 слайд


Содержание слайда: Диоксоциан, цианаты и их изомеры
получение
пиролизом циануровой кислоты, полученной при гидролизе цианурхлорида, получают цианатную кислоту (HOCN)
при -100°С образуется полимерная модификация
изоциановая кислота (HNCO) получается при нагревании мочевины и сразу тримеризуется
гремучая кислота получается при взаимодействии фульмината натрия с серной кислотой при охлаждении льдом
№26 слайд


Содержание слайда: Диоксоциан, цианаты и их изомеры
строение и физические свойства
цианатная кислота – нестабильная бесцветная летучая жидкость (tпл. = -86°С, tкип. = 23,5°С) с запахом уксусной кислоты
изоцианатная кислота устойчива в виде тримера, который имеет слоистую структуру
гремучая кислота – нестабильная жидкость (tпл. = -10°С), при комнатной температуре быстро полимеризуется; молекула имеет линейное строение
№27 слайд


Содержание слайда: Диоксоциан, цианаты и их изомеры
химические свойства
цианатная кислота – слабая кислота (pKa = 3,92)
в водном растворе гидролизуется
цианаты ЩМ можно получить при сплавлении металлов или карбонатов с мочевиной
цианаты d-Me получают обменными реакциями
изоциановая кислота – слабая кислота (pKa = 3,66)
ковалентные изоцианаты получают из галогенида соответствующего металла или неметалла и изоцианата серебра в органическом растворителе
№28 слайд


Содержание слайда: Диоксоциан, цианаты и их изомеры
химические свойства
гремучая кислота примерно в пять раз сильнее азидоводородной
при комнатной температуре быстро полимеризуется
соли гремучей кислоты – фульминаты – обычно нестойкие и очень ядовитые соединения.
для получения ионных фульминатов действуют амальгамой металла на раствор фульмината ртути в абсолютном этаноле
при их осторожном нагревании происходит изомеризация в цианаты
ковалентные фульминаты взрываются при ударе или нагревании
№29 слайд


Содержание слайда: Дитиоциан и тиоцианаты
получение
дитиоциан получается при бромировании тиоцианата металла в апротонном растворителе, …
… при химическом или анодном окислении тиоцианат-иона
тиоцианатоводород получается при взаимодействии сероводорода с ковалентными тиоцианатами
ионные тиоцианаты получают при сплавлении цианидов с серой
ковалентные тиоцианаты – обменными реакциями
№31 слайд


Содержание слайда: Дитиоциан и тиоцианаты
химические свойства
дитиоциан неустойчив и быстро полимеризуется до оранжевого (SCN)n
в водном растворе гидролизуется
окисляет халькогеноводороды
родановодород устойчив до 10°С, затем полимеризуется
водные растворы получаются при реакциях обмена
растворы родановодородной кислоты устойчивы только до 5%, в более концентрированных происходит димеризация иона и разложение
HNCS – довольно сильная кислота (pKa = 0,96)
№32 слайд


Содержание слайда: Дитиоциан и тиоцианаты
химические свойства
родановодородная кислота легко окисляется
она и ее соли не токсичны, содержатся в слюне человека и в луке
тиоцианаты термически неустойчивы
роданид-лиганд может присоединятся к центральному атому через жесткий (N) или мягкий (S) конец
№33 слайд


Содержание слайда: Диселеноциан и селеноцианаты
получение
диселеноциан получается при действии эфирного раствора иода на селеноцианат серебра, …
при окислении SeCN- пентафторидом иода, …
анодным окислением SeCN-
селеноцианатная кислота известна лишь в растворе, получается из солей
селеноцианаты ЩМ можно получить при сплавлении селена с комплексными цианидами, или …
при растворении селена в цианидных растворах
ковалентные селеноцианаты получаются при действии селеноцианата калия на соответствующие соли
№34 слайд


Содержание слайда: Диселеноциан и селеноцианаты
строение и физические свойства
диселеноциан имеет линейную структуру
желтый порошок, хорошо растворимый в органических растворителях
селеноцианаты – твердые кристаллические вещества
некоторые из них так и не получены в свободном виде, например, LiSeCN
Скачать все slide презентации Псевдогалогены и их соединения одним архивом:
Похожие презентации
-
 Урок изучения и первичного усвоения знаний с элементами исследования на тему: «Окислительно-восстановительные свойства соединен
Урок изучения и первичного усвоения знаний с элементами исследования на тему: «Окислительно-восстановительные свойства соединен -
 Обобщающий урок по теме «Соединения химических элементов» 8 класс.
Обобщающий урок по теме «Соединения химических элементов» 8 класс. -
 Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы -
 По Химии "Соединения алюминия" - скачать смотреть
По Химии "Соединения алюминия" - скачать смотреть -
 Генетическая связь между неорганическими соединениями.
Генетическая связь между неорганическими соединениями. -
 Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро
Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро -
 Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ -
 Основные соединения кальция и их применение – вчера, сегодня, завтра.
Основные соединения кальция и их применение – вчера, сегодня, завтра. -
 Тема урока: «Генетическая связь между классами неорганических соединений » ГОУ СОШ 149 Учитель химии: Иванова Г. М.
Тема урока: «Генетическая связь между классами неорганических соединений » ГОУ СОШ 149 Учитель химии: Иванова Г. М. -
 По Химии "Важнейшие класы бинарных соединений-оксиды и летучие водородные соединения" - скачать смотреть
По Химии "Важнейшие класы бинарных соединений-оксиды и летучие водородные соединения" - скачать смотреть