Презентация Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню. Взаємод онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню. Взаємод абсолютно бесплатно. Урок-презентация на эту тему содержит всего 58 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню. Взаємод
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:58 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:957.00 kB
- Просмотров:94
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№1 слайд


Содержание слайда: Сполуки неметалічних елементів з Гідрогеном.
Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню.
Взаємодія амоніаку та хлороводню з водою.
Солі амонію.
Якісна реакція на йони амонію та хлорид-іони.
Оксиди неметалічних елементів.
Кислотний характер оксидів та гідратів оксидів неметалічних елементів.
№2 слайд


Содержание слайда: Мета: .
Ознайомити зі складом та особливостями будови молекули аміаку та хлорводню.
Розглянути лабораторні способи добування та фізичні властивості.
Підкреслити необхідність додержання правил техніки безпеки.
Дослідити розчинення аміаку та хлорводню у воді та дію цього розчину на індикатори.
Формувати уміння складати рівняння реакцій, що характеризують хімічні властивості аміаку як основи та відновника.
Повторити і розширити уявлення про солі та їх загальні властивості з урахуванням солей амонію.
Сформувати поняття про донорно-акцепторний механізм утворення ковалентного зв’язку.
Ознайомити із специфічними властивостями солей амонію. Формувати вміння складати рівняння реакцій для солей амонію, що характерні для всіх солей (дисоціація, взаємодія з кислотами, солями) та виявляють специфічні властивості (взаємодія з лугами, термічний розклад), пояснювати рівняння реакцій з позицій теорії електролітичної дисоціації.
Ознайомити з добуванням солей амонію.
№3 слайд


Содержание слайда: Демонстрації:
Демонстрації:
1. Якісна реакція на хлорид-іон.
2. Добування амоніаку і розчинення його у воді (“фонтан”), випробування розчину фенолфталеїном.
3. Утворення амоній хлориду з амоніаку і хлороводню.
4. Якісна реакція на йон амонію.
Лабораторні досліди:
2. Виявлення хлорид-іонів у розчині.
3. Виявлення йонів амонію в розчині.
№5 слайд


Содержание слайда: Склад і назви сполук.
Сполуки з Гідрогеном відомі для більшості неметалічних елементів;
їх не утворюють лише інертні елементи.
Скласти формулу сполуки неметалічного елемента з Гідрогеном досить легко.
Щоб з'ясувати значення валентності елемента в такій сполуці, потрібно від числа 8 відняти номер групи періодичної системи, в якій міститься елемент.
№7 слайд


Содержание слайда: Загальна формула сполук елементів із Гідрогеном має два варіанти написання — НnЕ і ЕНn.
Загальна формула сполук елементів із Гідрогеном має два варіанти написання — НnЕ і ЕНn.
Послідовність запису елементів у формулах цих сполук зумовлена традицією: символи елементів VI і VII груп розміщують після символу Гідрогену, а символи елементів інших груп — перед ним.
Загальні формули сполук неметалічних елементів кожної групи з Гідрогеном указують у деяких варіантах періодичної системи в окремому рядку
№8 слайд


Содержание слайда: Для сполук неметалічних елементів із Гідрогеном частіше використовують тривіальні назви
Для сполук неметалічних елементів із Гідрогеном частіше використовують тривіальні назви
амоніак,
метан,
вода,
хлороводень,
сірководень та ін.),
іноді — хімічні
гідроген хлорид,
гідроген сульфід тощо.
№10 слайд


Содержание слайда: Якщо позитивні й негативні заряди, що виникли на атомах унаслідок зміщення спільних електронних пар, рівномірно розподілені в молекулі, то вона є неполярною (наприклад, молекула СН4).
Якщо позитивні й негативні заряди, що виникли на атомах унаслідок зміщення спільних електронних пар, рівномірно розподілені в молекулі, то вона є неполярною (наприклад, молекула СН4).
В іншому разі в одній частині молекули зосереджується невеликий негативний заряд, а в протилежній — позитивний заряд.
Така молекула полярна; вона має два електричні полюси і називається диполем.
Полярними є молекули НF, Н2О, NН3
№11 слайд


Содержание слайда: Фізичні властивості.
Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид НF (за температури нижче 19,5 °С) і вода — рідинами.
Усі ці сполуки безбарвні; чимало їх можна виявити за характерним запахом — неприємним, іноді різким.
Температури плавлення і кипіння сполук із Гідрогеном неметалічних елементів кожної групи періодичної системи зростають зі збільшенням відносних молекулярних мас. Проте сполуки елементів 2-го періоду — вода, амоніак і фтороводень — «випадають» із цієї залежності
Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв'язків між молекулами
№12 слайд


Содержание слайда: Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Наприклад, в 1 л води за нормального тиску розчиняється 534 л газу бромоводню НВг (за 25 °С) або 702 л газу амоніаку КН3 (за 20 °С).
Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Наприклад, в 1 л води за нормального тиску розчиняється 534 л газу бромоводню НВг (за 25 °С) або 702 л газу амоніаку КН3 (за 20 °С).
Це пояснюється утворенням водневих зв'язків між молекулами води і галогеноводню або амоніаку, а також дисоціацією молекул НВг у водному розчині.
Метан дуже слабо розчиняється у воді через неполярність молекул СН4, неможливість утворення ними водневих зв'язків і нездатність до дисоціації.
Розчини сполук галогенів із Гідрогеном і Сульфуру з Гідрогеном у воді виявляють властивості кислот.
Водні розчини НСL, НВг і НІ поводяться як сильні одноосновні кислоти, НF — як кислота середньої сили, а Н2S — як слабка двохосновна кислота.
№13 слайд


Содержание слайда: Метан СН4 інертний щодо води (за звичайних умов).
Метан СН4 інертний щодо води (за звичайних умов).
Водний розчин амоніаку NН3, на відміну від розчинів інших сполук неметалічних елементів із Гідрогеном, має лужну реакцію
Вам відомо, що вода є слабким електролітом. Мізерна частка її молекул дисоціює з утворенням йонів Н+ і ОН~:
Отже, воду можна вважати дуже слабкою кислотою і водночас дуже слабкою основою.
Водні розчини сполук галогенів із Гідрогеном і Сульфуру з Гідрогеном виявляють властивості кислот.
№15 слайд


Содержание слайда: Історія вікриття нітрогену:
У 1772 р. Англієць Д. Резерфорд встановив, що повітря, що залишився під дзвоном, де жила кілька днів миша, звільнений від вуглекислоти, не підтримує горіння і дихання.
Це повітря він назвав «отруйним повітрям». У тому ж році Прістлі Дж. отримавши «отруйний повітря» іншим шляхом, назвав його «флогістрованому» повітрям.
У 1773 році К.В. Шіле встановив, що повітря складається з двох газів. Він назвав газ, який не підтримує горіння і дихання «Поганим» або «зіпсованим» повітрям.
У 1776 р. Лавуазьє, докладно досліджуючи «Отруйний», «флогістрованому» і«Поганий» повітря, встановив тотожність між ними.
У 1787 р. Лавуазьє запропонував назвати цей газ «азотом» (від грец. Слова «а» -заперечення і «Зое»-життя).
№22 слайд


Содержание слайда: Властивості амоніаку.
Амоніак – безбарвний газ з різким запахом. При температурі, нижчій за – 33,4ОС, він переходить у рідкий стан.
Маса 1 л амоніаку за нормальних умов дорівнює 0,77 г.
При охолодженні до 33,4ºС амоніак під звичайним тиском перетворюється у прозору рідину, що твердне при – 77,8ºС.
Амоніак добре розчинний у воді: 1:700. Розчинність амоніаку у воді зумовлена утворенням водневим зв’язків між їхніми молекулами
№23 слайд


Содержание слайда: Для амоніаку характерні реакції приєднання і окислення.
1.Взаємодіє з водою і утворює гідрати NH3.H2O, NH3+H2O=NH4OH. Лужна реакція розчину амоніаку наявністю . Водний розчин NH3 – амоній гідроксид (слабка основа). Фенолфталеїн – малинове забарвлення, розчин NH3 10% нашатирний спирт.
2. Взаємодія з кислотами.
Утворюються солі амонію: NH3+HCl=NH4Cl; 2NH3+H2SO4=(NH4)2SO4
3.Відновні властивості (при нагріванні).
а) згорає у кисні: 4NH3+3О2=2N2+6Н2О; б)каталітичне окислення: 4NH3+5О2=4NО+6Н2О; в)реагує з окислювачами: 4H3N +3Br2=6НBr+3N2; 2NH3+3CuO=3Cu+N2+3H2O.
№26 слайд


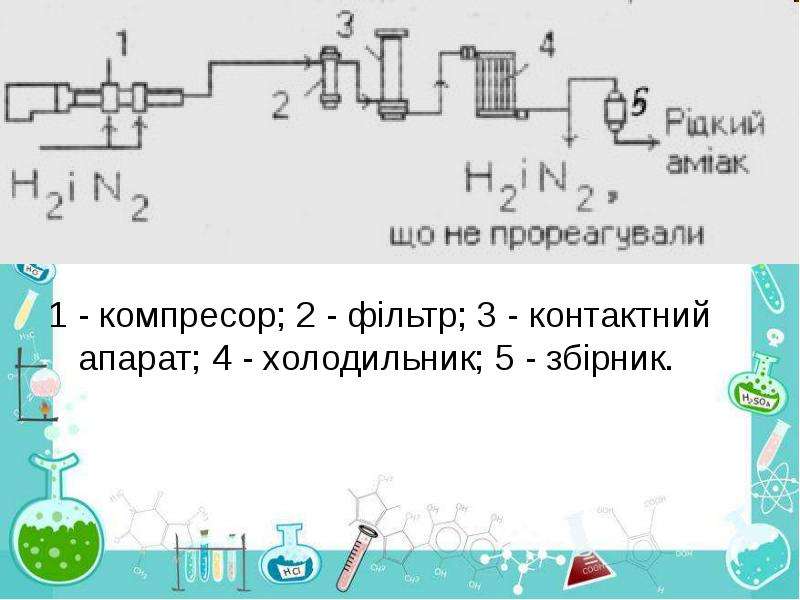
Содержание слайда: Добування
У лабораторії амоніак добувають, нагріваючи амоній хлорид гашеним вапном. 2NH4Cl+Ca(OH)2=CaCl2+H2O+2NH3 Амоніак, що утворився висушують СаО.
У промисловості амоніак синтезують з простих речовин Н2 і N2. Реакція азоту з воднем екзотермічна, вона відбувається із виділенням теплоти.
№29 слайд


Содержание слайда: Застосування.
Аміак — важливий продукт хімічної промисловості.
Його використовують як добриво і для виробництва азотних добрив, а також нітратної кислоти, вибухових речовин, соди.
Як холодоагент аміак застосовують у холодильниках.
У вигляді аміачної води він використовується у медицині під назвою «нашатирний спирт». Вдихання малих кількостей аміаку І стимулює роботу серця і нервової системи, тому нашатирний спирт дають нюхати при знепритомленні та отруєннях, наприклад чадним газом CO.
Як слабкий луг аміачну воду широко застосовують у хімічних лабораторіях, а також у побуті: під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.
№32 слайд


Содержание слайда: Хлороводень (HCl) — безбарвний задушливий газ з різким запахом.
Хлороводень (HCl) — безбарвний задушливий газ з різким запахом.
Температура розплавлення: −115 °C (158 K), температура кипіння: −85 °C (188 K), молекулярна маса — 70,9 а. о. м
У лабораторних умовах хлороводень одержують при дії концентрованої сульфатної кислоти на хлорид натрію при сильному нагріванні:2NaCl + Н2SO4 = Na2SO4 + 2HCl ↑
У промисловості його добувають звичайно спалюванням водню в атмосфері хлору у спеціальних пальниках: H2 + Cl2 = 2HCl
№33 слайд


Содержание слайда: Розчин хлороводню у воді називають хлоридною, або соляною, кислотою.
Розчин хлороводню у воді називають хлоридною, або соляною, кислотою.
Поява кислотних властивостей хлороводню в розчині обумовлюється тим, що полярна будова молекул HCl під впливом дуже полярних молекул води переходить в іонну, внаслідок чого молекули хлориду водню у розчині дисоціюють:
№36 слайд


Содержание слайда: Н2 + С12 = 2НС1, а в лабораторії — за реакцією обміну між твердою сіллю (натрій хлоридом) і концентрованою сульфатною кислотою:
Н2 + С12 = 2НС1, а в лабораторії — за реакцією обміну між твердою сіллю (натрій хлоридом) і концентрованою сульфатною кислотою:
Таким способом раніше добували хлороводень і в промисловості.
№37 слайд


Содержание слайда: ВЗАЄМОДІЯ АМОНІАКУ ТА ХЛОРОВОДНЮ З ВОДОЮ.
Аміак добре розчиняється у воді утворюючи аміачну воду (за нормальних умов у 100 г води розчиняється 87,5 г, або 115л, NH3). Висока розчинність аміаку пояснюється тим, що він реагує з водою.
Водний розчин гідроген хлориду називають хлоридною кислотою. Тривіальна назва цього розчину — соляна кислота.
№39 слайд


Содержание слайда: СОЛІ АМОНІЮ — це кристалічні речовини з йонним типом зв'язку.
СОЛІ АМОНІЮ — це кристалічні речовини з йонним типом зв'язку.
До складу солей амонію входять один або кілька катіонів амонію і аніон кислотного залишку.
Фізичні властивості.
Солі амонію — тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів.
У воді добре розчиняються.
№41 слайд


Содержание слайда: Солі амонію добувають при взаємодії амоніаку або амоній гідроксид з кислотами: NH3+NHО3=NH4NО3; 2NH3+H2SO4=(NH4)2SO4;
Солі амонію добувають при взаємодії амоніаку або амоній гідроксид з кислотами: NH3+NHО3=NH4NО3; 2NH3+H2SO4=(NH4)2SO4;
NH4OH+HNO3=NH4NO3+H2O.
У катіоні NH є чотири ковалентні зв’язки: донор акцептор
№43 слайд


Содержание слайда: Солі амонію виявляють загальні властивості солей:
Солі амонію виявляють загальні властивості солей:
1) взаємодіють з лугами: NH4Cl+NaOH=NaCl+NH4OH (NH3 +H2O)
2) взаємодіють з кислотами: 2NH4Cl+H2SO4=(NH4)2SO4+2HCl
3) взаємодіють із солями: (NH4)2SO4+BaCl2=2NH4Cl+BaSO4
Всі амонійні солі добре розчиняються у воді. У водних розчинах солі добре гідролізують. NH +H2O=NH4OН+ H
№47 слайд


Содержание слайда: Оксид сульфуру(IV) SO2 (діоксид сульфуру, сірчистий газ) — це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Токсичний
Оксид сульфуру(IV) SO2 (діоксид сульфуру, сірчистий газ) — це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Токсичний
Дуже легко розчиняється у воді (в 1 л води при 20 °С Розчиняється 43 л S02).
Поряд з «фізичним» розчиненням одночасно відбувається хімічна взаємодія невеликої частини молекул оксиду сульфуру(ІV) S02 з водою, внаслідок чого утворюється сульфітна кислота:
S02 + Н20 = H2S03
Оксид сульфуру (IV) добувають спалюванням сірки, a також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
S + O2 = SO2↑
2Pb + 3O2 = 2PbO + 2SO2↑
№48 слайд


Содержание слайда: НІТРОГЕН З ОКСИГЕНОМ утворює п'ять оксидів, в яких він виявляє ступінь окиснення від +1 до +5:
НІТРОГЕН З ОКСИГЕНОМ утворює п'ять оксидів, в яких він виявляє ступінь окиснення від +1 до +5:
+1 +2 +3 +4 +5
N20, NO, N203, N02, N2O5
Усі оксиди нітрогену дуже отруйні, за винятком N20.
№49 слайд


Содержание слайда: Оксид нітрогену (І) N20 — безбарвний газ із приємним запахом, залежить до несолетвірних оксидів. Під назвою «веселильний газ» N20 у суміші з киснем використовується в медицині для наркозу. Не отруйний.
Оксид нітрогену (ІІ) NO — безбарвний газ, без запаху, у воді не розчиняється. Належить до несолетвірних оксидів.
На повітрі легко окиснюється, перетворюючись на бурий газ — діоксид нітрогену, або оксид нїтрогену (IV) N02:
2NO + 02 = 2N02
№51 слайд


Содержание слайда: Оксид фосфору (V) Р205 — білий дрібнокристалічний порошок, дуже гігроскопічний, тому застосовується для осушування газів.
Оксид фосфору (V) Р205 — білий дрібнокристалічний порошок, дуже гігроскопічний, тому застосовується для осушування газів.
Типовий кислотний оксид.
Енергійно реагує з водою, утворюючи різні фосфатні кислоти, залежно від співвідношення і температури води:
Р205 + Н20 = 2НР03
холодна метафосфатна кислота
Р205 + ЗН20 = 2Н3Р04
гаряча ортофосфатна
кислота
№53 слайд


Содержание слайда: Оксид карбону(IV), або вуглекислий газ, С02 за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С02 зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого час-тина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом.
Оксид карбону(IV), або вуглекислий газ, С02 за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С02 зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого час-тина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом.
Вуглекислий газ С02 у великих кількостях шкідливий для людіни і тварин
№54 слайд


Содержание слайда: Взаємодія з водою. Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє.
Взаємодія з водою. Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє.
Це пояснюється тим, що С02 взаємодіє з водою з утворенням нестійкої карбонатної кислоти:
H2O + CO2 ⇔ H2CO3
2. Взаємодія з основами і основними оксидами.
Оксид карбону (IV) С02 реагує з лугами у водних розчинах та з твердими лугами і основними оксидами за звичайних умов, утворюючи солі — карбонати:
Са(ОН)2 + С02 - СаС03↓ + Н20
СаО + С02 = СаС03
№55 слайд


Содержание слайда: Добування оксиду карбону(ІУ). У лабораторних умовах С02 добувають дією хлоридної кислоти на мармур:
Добування оксиду карбону(ІУ). У лабораторних умовах С02 добувають дією хлоридної кислоти на мармур:
СаС03 + 2НСl = СаСl2 + Н20 + С02↑
У промисловості оксид карбону(ІV) добувають прожарюванням вапняку:
СаС03 = СаО + С02↑
Застосування. Вуглекислий газ С02 застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються.
№57 слайд


Содержание слайда: Оксид силіцію(ІV) SiO2, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (tпл. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).
Оксид силіцію(ІV) SiO2, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (tпл. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).
№58 слайд


Содержание слайда: Оксид силіцію (IV) Si02 взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі — силікати:
Оксид силіцію (IV) Si02 взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі — силікати:
2NaOH + Si02 = Na2Si03 + Н20
BaO + Si02 = BaSi03
Діоксид силіцію SiO2 у вигляді піску широко застосовують у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу, абразивів. У вигляді кварцу Sі02 використовують у радіотехніці, в акустоелектроніці, в оптичному приладобудуванні. Синтетичний діоксид силіцію Sі02 («біла сажа») застосовується як наповнювач у виробництві гуми.
Скачать все slide презентации Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню. Взаємод одним архивом:
Похожие презентации
-
 Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють
Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють -
 ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале
ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале -
 Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості.
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості. -
 Лужні метали. Фізичні та хімічні властивості простих речовин. Біологічна роль елементів.
Лужні метали. Фізичні та хімічні властивості простих речовин. Біологічна роль елементів. -
 План: Основні відомості Формули основ Назви основ Класифікація Фізичні властивості Хімічні властивості Способи добування
План: Основні відомості Формули основ Назви основ Класифікація Фізичні властивості Хімічні властивості Способи добування -
 Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості -
 Кристалічна ґрадка. Встановити взаємозвязок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозвязок між будовою речовин та їх фізичними властивостями -
 Презентація уроку «Речовини. Фізичні властивості речовин. Властивості твердих тіл, рідин та газів» Підготувала: учитель хімії ви
Презентація уроку «Речовини. Фізичні властивості речовин. Властивості твердих тіл, рідин та газів» Підготувала: учитель хімії ви -
 Презентація «Речовини. Фізичні властивості речовин. Властивості твердих тіл, рідин та газів»
Презентація «Речовини. Фізичні властивості речовин. Властивості твердих тіл, рідин та газів» -
 фізичні властивості полімеру спиртів та карбонових кислот
фізичні властивості полімеру спиртів та карбонових кислот