Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
20 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
1.83 MB
Просмотров:
65
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Строение атома и атомного ядра
Периодическая система химических элементов
(Часть 2)
№2 слайд
Содержание слайда: Строение атомного ядра
№3 слайд
Содержание слайда: Электрон
№4 слайд
Содержание слайда: Электрон
№5 слайд
Содержание слайда: Атом - квантовая система, т.е. система микрочастиц, поведение которых описывается законами квантовой механики. Согласно законам, энергетическое состояние электрона описывается при помощи четырех квантовых чисел.
Атом - квантовая система, т.е. система микрочастиц, поведение которых описывается законами квантовой механики. Согласно законам, энергетическое состояние электрона описывается при помощи четырех квантовых чисел.
1. Главное квантовое число “n” - характеризует уровень энергии в поле ядра и удаленность этого уровня от ядра. Целые числа (1, 2, 3, 4 и т. д.), характеризующие стационарные орбиты, называются главными квантовыми числами. Для реально существующих атомов n может иметь значения целых чисел от 1 до 7, соответственно номеру периода, в котором находится элемент,
соответствующие энергетические уровни (электронные слои) обозначаются большими буквами латинского алфавита.
С увеличением n возрастают энергия электрона и размер электронного облака.
№6 слайд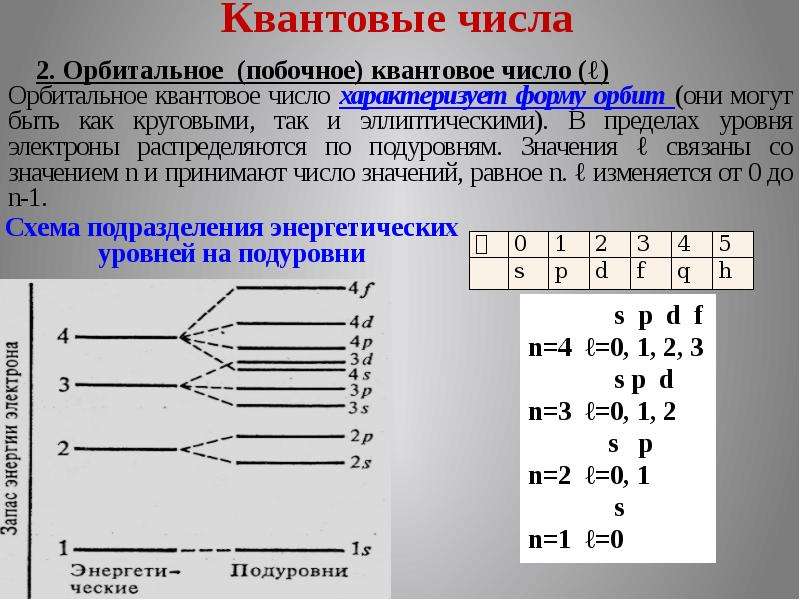
Содержание слайда: Квантовые числа
№7 слайд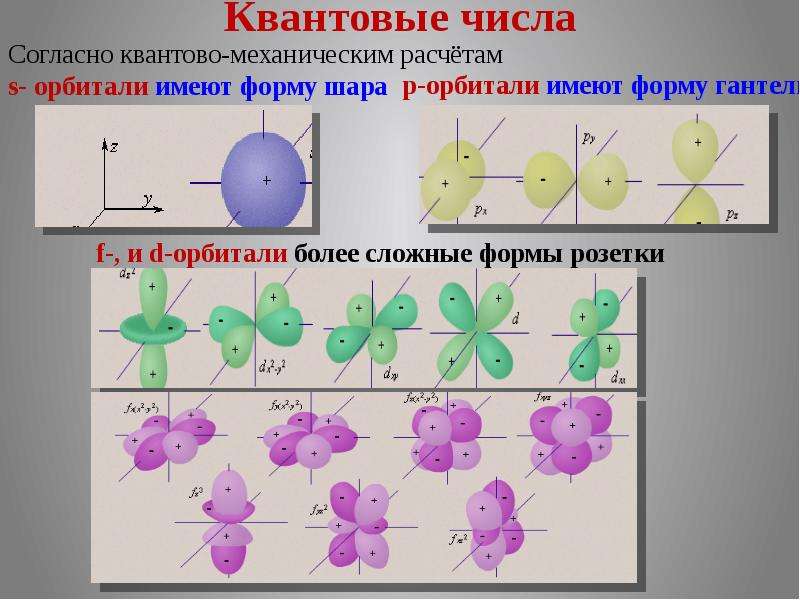
Содержание слайда: Квантовые числа
№8 слайд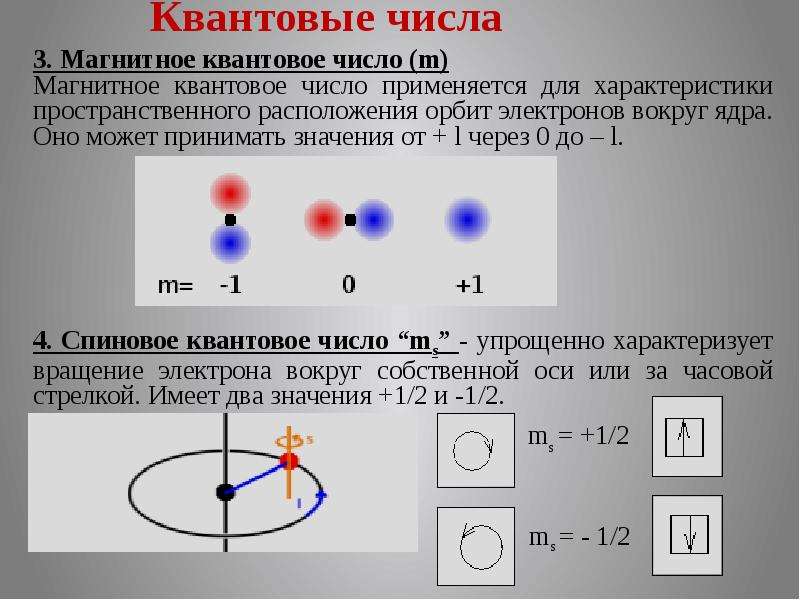
Содержание слайда: Квантовые числа
3. Магнитное квантовое число (m)
Магнитное квантовое число применяется для характеристики пространственного расположения орбит электронов вокруг ядра. Оно может принимать значения от + l через 0 до – l.
4. Спиновое квантовое число “ms” - упрощенно характеризует вращение электрона вокруг собственной оси или за часовой стрелкой. Имеет два значения +1/2 и -1/2.
№9 слайд
Содержание слайда: Принципы заполнения атомных орбиталей
№10 слайд
Содержание слайда: Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s.
Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
№11 слайд
Содержание слайда: Полная электронная формула элемента
№12 слайд
Содержание слайда: Открытие периодического закона Д. И. Менделеева
№13 слайд
Содержание слайда: Открытие периодического закона Д. И. Менделеева
№14 слайд
Содержание слайда: Периодический закон Д. И. Менделеева
№15 слайд
Содержание слайда: В связи с открытием закона Мозле современная формулировка периодического закона следующая:
В связи с открытием закона Мозле современная формулировка периодического закона следующая:
Свойство элементов, а так же формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
№16 слайд
Содержание слайда: Периодическая система химических
элементов
На основе Периодического закона Д. И. Менделеев создал Периодическую систему химических элементов, которая состояла из 7 периодов и 8 групп (короткопериодный вариант таблицы). В настоящее время чаще используется длиннопериодный вариант Периодической системы (7 периодов, 18 групп, отдельно показаны элементы - лантаноиды и актиноиды).
№17 слайд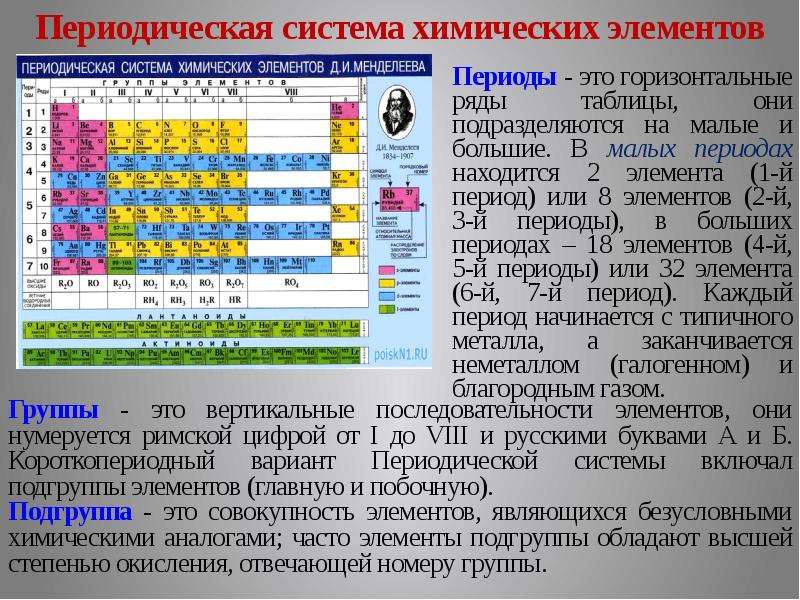
№18 слайд
Содержание слайда: Периодическая система химических элементов
№19 слайд
Содержание слайда: Периодическая система химических элементов
№20 слайд





























