Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
20 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
407.50 kB
Просмотров:
69
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
№2 слайд
Содержание слайда: Сера известна человечеству с древних времен, т. к. она в природе встречается в самородном виде. Считалось, что голубое пламя и запах, распространяемый при горении серы, отгоняет демонов.
Сера известна человечеству с древних времен, т. к. она в природе встречается в самородном виде. Считалось, что голубое пламя и запах, распространяемый при горении серы, отгоняет демонов.
№3 слайд
Содержание слайда: Сернистый газ использовали для отбеливания тканей. При раскопках Помпеи нашли картину, на которой изображен противень с серой и приспособление для подвешивания над ним материи.
№4 слайд
Содержание слайда: Кроме того, серу и ее соединения использовали для приготовления косметических средств и для лечения кожных заболеваний..
Кроме того, серу и ее соединения использовали для приготовления косметических средств и для лечения кожных заболеваний..
№5 слайд
Содержание слайда: Ее применяли для военных целей. Так в
670 г защитники Константинополя сожгли арабский флот с помощью смеси селитры, угля и серы (“греческий огонь”). Сера также входит в состав черного пороха
№6 слайд
№7 слайд
Содержание слайда: +16S
а) находится в Vl группе, главной подгруппе
б) lll период. 3 ряд
в) неметалл
г) проявляет степени окисления -2, 0,+2,+4,+6
д) образует кислотные оксиды SO2 (сернистый газ) и SO3 (серный газ)
е) этим оксидам соответствуют кислоты H2SO3(сернистая) и H2SO4(серная)
ё) с водородом образует летучее водородное соединение H2S
№8 слайд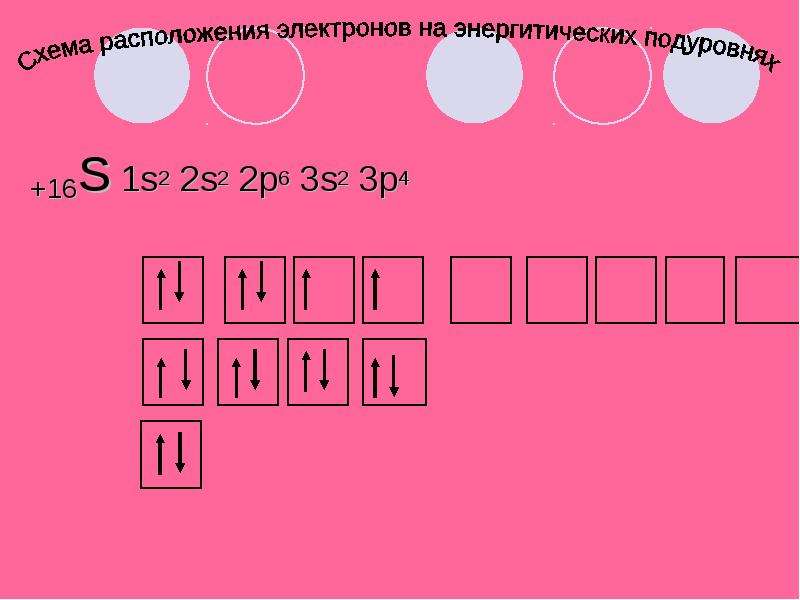
Содержание слайда: +16S 1s2 2s2 2p6 3s2 3p4
+16S 1s2 2s2 2p6 3s2 3p4
№9 слайд
Содержание слайда: S8-молекула серы состоит из 8-и атомов
S8-молекула серы состоит из 8-и атомов
связь в молекуле - ковалентная неполярная
молекула неполярная
кристаллическая решётка - молекулярная неполярная
№10 слайд
№11 слайд
Содержание слайда: а) Самородную серу очищают от примесей песка и глины. Для этого ее расплавляют перегретым водяным паром, в результате жидкая сера легко отделяется от твердых примесей. При затвердевании получается комовая сера, дальнейшую очистку которой проводят перегонкой.
а) Самородную серу очищают от примесей песка и глины. Для этого ее расплавляют перегретым водяным паром, в результате жидкая сера легко отделяется от твердых примесей. При затвердевании получается комовая сера, дальнейшую очистку которой проводят перегонкой.
б) Из сульфидов
t
FeS2 =>FeS +S
в) Из сероводорода - неполным окислением
H2S+O2 =>S+H2O
№12 слайд
Содержание слайда: Сера имеет несколько аллотропных модификаций. Наиболее устойчивы
Сера имеет несколько аллотропных модификаций. Наиболее устойчивы
ромбическая и моноклинная.
Это кристаллические вещества, которые различаются формой кристаллов и некоторыми физическими свойствами
№13 слайд
Содержание слайда: Кристаллы состоят из молекул S8( кр. решетка молекулярная –неполярная)
Кристаллы состоят из молекул S8( кр. решетка молекулярная –неполярная)
ромбическая сера имеет цвет лимонно-желтый, tпл.=112,8C,
моноклинная сера имеет цвет темно-желтый tпл.=119.3C,
№14 слайд
Содержание слайда: При быстром охлаждении расплавлено серый образуется ещё одна неустойчивая аллотропная модификация- пластическая сера Sn , которая легко растягивается подобно резине.
При быстром охлаждении расплавлено серый образуется ещё одна неустойчивая аллотропная модификация- пластическая сера Sn , которая легко растягивается подобно резине.
S S S S S
..S S S S S S…
В воде сера практически нерастворима. Хорошим растворителем для неё является сероуглерод,
толуол и некоторые другие вещества.
№15 слайд
№16 слайд
Содержание слайда: Большая часть серы используется для производства серной кислоты.
Большая часть серы используется для производства серной кислоты.
Значительное количество серы расходуется для вулканизации каучука (она повышает его прочность и эластичность). При введении в каучук большого количества серы получают твердый продукт - эбонит, являющийся электроизоляционным материалом.
Сера применяется для борьбы с вредителями сельского хозяйства,
для изготовления черного пороха,
а также в медицине для изготовления мазей против кожных заболеваний.
№17 слайд
Содержание слайда: Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С
№18 слайд
Содержание слайда: Сера реагирует со щелочными металлами без нагревания:
Сера реагирует со щелочными металлами без нагревания:
2Na + S ® Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t°:
2Al + 3S –t°® Al2S3
Zn + S –t°® ZnS
С некоторыми неметаллами сера образует бинарные соединения:
H2 + S ® H2S
2P + 3S ® P2S3
C + 2S ® CS2
№19 слайд
Содержание слайда: Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
c кислородом:
S + O2 –t°® S+4O2
2S + 3O2 –t°;pt® 2S+6O3
c галогенами (кроме йода):
S + Cl2 ® S+2Cl2
c кислотами - окислителями:
S + 2H2SO4(конц) ® 3S+4O2 + 2H2O
S + 6HNO3(конц) ® H2S+6O4 + 6NO2 + 2H2O
№20 слайд






























