Презентация Квантовомеханическая модель атома водорода онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Квантовомеханическая модель атома водорода абсолютно бесплатно. Урок-презентация на эту тему содержит всего 62 слайда. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Физика » Квантовомеханическая модель атома водорода
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:62 слайда
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:446.50 kB
- Просмотров:124
- Скачиваний:1
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: Лекция 7.
Квантовомеханическая модель атома водорода
План лекции
7.1. Квантование энергии. Главное квантовое число.
7.2. Распределение электронного заряда в атоме. Орбитальное квантовое число.
7.3. Квантование орбитального момента импульса.
7.4. Пространственное квантование. Магнитное квантовое число.
7.5. Квантование собственного момента импульса. Спиновое квантовое число.
7.6. Энергетический спектр атома водорода.
№3 слайд


Содержание слайда: 7.1. Квантование энергии.
Главное квантовое число
С точки зрения квантовой механики, электрон в атоме водорода находится в трёхмерной потенциальной яме сложной формы.
Потенциальная энергия определяет взаимодействие электрона с положительно заряженным ядром:
r – расстояние электрона от ядра;
Ze – заряд ядра: Z = 1 для водорода;
e – заряд электрона.
№5 слайд


Содержание слайда: Уравнение Шредингера для стационарных состояний имеет вид:
Уравнение Шредингера для стационарных состояний имеет вид:
Электрон находится в центральном, сферически симметричном электрическом поле, поэтому при решении этого уравнения целесообразно использовать сферическую системой координат.
№8 слайд


Содержание слайда: При решении уравнения Шредингера в сферических координатах получены следующие результаты:
При решении уравнения Шредингера в сферических координатах получены следующие результаты:
собственные значения полной энергии электрона Е и собственные волновые функции ψ зависят от целых чисел.
Эти целые числа получили название:
n – главное квантовое число,
l – орбитальное квантовое число;
m – магнитное квантовое число.
№9 слайд


Содержание слайда: Уравнение Шредингера имеет требуемые однозначные конечные и непрерывные решения в следующих случаях:
Уравнение Шредингера имеет требуемые однозначные конечные и непрерывные решения в следующих случаях:
при любых положительных Е;
при дискретных отрицательных значениях энергии, определяемых формулой:
№10 слайд


Содержание слайда: Случай Е = 0 соответствует отрыву электрона от атома.
Случай Е = 0 соответствует отрыву электрона от атома.
2. Случай E > 0 соответствует свободному электрону, пролетающему вблизи ядра и снова удаляющемуся на бесконечность.
3. Случай E < 0 соответствует электрону, связанному с ядром атома.
Последнее выражение для полной энергии совпадает с формулой для энергии по теории Бора.
№11 слайд


Содержание слайда: Однако в квантовой механике данные значения энергии получаются как следствие основных положений этой науки, т.е. решения уравнения Шредингера.
Однако в квантовой механике данные значения энергии получаются как следствие основных положений этой науки, т.е. решения уравнения Шредингера.
Бору же для получения такого результата пришлось постулировать о наличии стационарных состояний атома.
Значения энергии
соответствуют энергиям стационарных состояний атома.
Число n называют главным квантовым числом.
№16 слайд


Содержание слайда: Эта вероятность различна в разных частях объёма атома.
Эта вероятность различна в разных частях объёма атома.
Заряд электрона «размазан» по всему объёму атома, образуя так называемое электронное облако.
Объёмная плотность электрического заряда атома
для стационарных состояний зависит только от расстояния r электрона от ядра:
С – некоторая постоянная величина, r1 = 0,0529 нм – радиус первой стационарной орбиты.
№17 слайд


Содержание слайда: Для стационарных состояний атома волновые функции также зависят от расстояния r электрона от ядра атома.
Для стационарных состояний атома волновые функции также зависят от расстояния r электрона от ядра атома.
Существует прямая зависимость между объёмной плотностью заряда атома и квадратом модуля радиальной волновой функции.
Орбиталь – форма распределения объёмной плотности электрического заряда в атоме.
Классическое понятие орбит пропадает.
№18 слайд


Содержание слайда: Радиальная часть волновой функции (форма орбитали) зависят от двух квантовых чисел: n, l.
Радиальная часть волновой функции (форма орбитали) зависят от двух квантовых чисел: n, l.
Орбитальное квантовое число
- принимает целочисленные значения:
l: 0, 1, 2, …, (n-1);
определяет форму распределения электронного заряда (форму орбитали);
определяет значения орбитального момента импульса электрона.
№19 слайд


Содержание слайда: При условии n = 1, 2, 3… и l = 0 форма электронного облака обладает сферической симметрией.
При условии n = 1, 2, 3… и l = 0 форма электронного облака обладает сферической симметрией.
При этих условиях плотность вероятности нахождения электрона в тонком шаровом слое радиуса r и толщины dr определяется по формуле
Величина оказывается максимальной на расстояниях от ядра, соответствующих радиусам «боровских» стационарных орбит: r1, r2 = 4r1, r3= 9r1,… и т.д.
№20 слайд


Содержание слайда: Сферическая форма электронного облака
Сферическая форма электронного облака
n = 1, l = 0
Вероятность обнаружить электрон на расстояниях, как много меньших , так и много больших r1 практически равна нулю. Наибольшее значение вероятности приходится на расстояние r1= 0,0529 нм, равное радиусу первой «боровской» орбиты.
№22 слайд


Содержание слайда: В состоянии с квантовыми числами
В состоянии с квантовыми числами
n = 2 и l = 0
максимальная вероятность приходится на расстояние r2 = 4r1, которое соответствует радиусу второй стационарной орбиты.
Принято называть состояния атома, в которых:
l = 0 s - состоянием;
l = 1 p - состоянием;
l = 2 d – состоянием;
l = 3 f - состоянием и т д.
№24 слайд


Содержание слайда: Для р -, d -, f - состояний плотность электронного облака зависит не только от расстояния r от ядра, но и от направлений, определяемых углами .
Для р -, d -, f - состояний плотность электронного облака зависит не только от расстояния r от ядра, но и от направлений, определяемых углами .
В таких состояниях форма распределения объёмного заряда имеет форму эллипса.
Чем больше орбитальное квантовое число , тем более вытянутым является эллипс.
№26 слайд


Содержание слайда: За радиус атома принято считать расстояние r, на которое приходится 95 % объёмной плотности заряда.
За радиус атома принято считать расстояние r, на которое приходится 95 % объёмной плотности заряда.
Самый маленький размер атом имеет в основном состоянии.
Если атом возбудить, то его размеры возрастают, атом как бы «разбухает».
№27 слайд


Содержание слайда: Таким образом, волновой характер движения электрона приводит к тому, что понятие орбиты теряет классический смысл.
Таким образом, волновой характер движения электрона приводит к тому, что понятие орбиты теряет классический смысл.
Заряд электрона становится пространственно распределённым.
Можно говорить лишь об электронном облаке, имеющем различную форму в разных квантовых состояниях электрона в атоме.
№29 слайд


Содержание слайда: 7.3. Квантование орбитального момента импульса.
Согласно первому постулату Бора момент импульса электрона (L = mvr) квантуется по условию:
где n – главное квантовое число.
Условием квантования момента импульса электрона согласно квантовой механики является формула, в которой участвует орбитальное квантовое число l.
№30 слайд


Содержание слайда: При больших значениях n (l ~n ) обе формулы практически дают одинаковый ответ.
При больших значениях n (l ~n ) обе формулы практически дают одинаковый ответ.
Магнитный момент импульса Pm электрона и его механический момент импульса L связаны между собой соотношением:
.
Условие квантования для магнитного момента электрона:
№31 слайд


Содержание слайда: Единицей квантования орбитального механического момента импульса L является перечёркнутая постоянная Планка.
Единицей квантования орбитального механического момента импульса L является перечёркнутая постоянная Планка.
Единицей квантования орбитального магнитного момента импульса Pm является магнетон Бора.
№32 слайд


Содержание слайда: 7.4. Пространственное квантование.
Магнитное квантовое число
Рассмотрим атом, помещённый в магнитное поле.
Направления как механического , так и магнитного моментов электрона в пространстве не может быть произвольным.
Ориентация векторов и может быть только вполне определённой по отношению к направлению внешнего магнитного поля.
№33 слайд


Содержание слайда: В магнитном поле проекции указанных векторов могут принимать значения:
В магнитном поле проекции указанных векторов могут принимать значения:
Здесь m – магнитное квантовое число.
Физический смысл магнитного квантового числа проявляется только в том случае, если атом находится в магнитном поле.
№34 слайд


Содержание слайда: Магнитное квантовое число
Магнитное квантовое число
принимает целочисленные значения:
принимает всего (2l +1) значение при заданном значении орбитального квантового числа l;
квантует проекции орбитальных механического и магнитного моментов.
Явление квантования проекций векторов и получило название пространственного квантования.
№39 слайд


Содержание слайда: 7.5. Квантование собственного момента импульса.
Спиновое квантовое число
В 1925 году американские физики Уленбек и Гоудсмит для объяснения некоторых экспериментальных результатов, не объясняемых с точки зрения классической физики, ввели понятие спинового движения электрона.
Предполагалось, что спиновое движение обусловлено как бы вращением электрона вокруг своей оси (электрон уподоблялся волчку).
№40 слайд


Содержание слайда: По современным представлениям всем элементарным частицам природы (микрочастицам) приписывают наличие спина.
По современным представлениям всем элементарным частицам природы (микрочастицам) приписывают наличие спина.
Спин:
следует считать внутренним свойством, присущим микрочастице подобно тому, как ей присущи заряд и масса;
является свойством одновременно квантовым и релятивистским.
Спином обладают многие элементарные частицы (электроны, протоны, нейтроны, фотоны), кроме мезонов.
№42 слайд


Содержание слайда: К фермионам относятся микрочастицы с полуцелым спином:
К фермионам относятся микрочастицы с полуцелым спином:
К ним принадлежат электроны, протоны, нейтроны и другие элементарные частицы.
К бозонам относятся микрочастицы с нулевым или целым спином:
К ним принадлежат фотоны, фононы и другие элементарные частицы.
№51 слайд


Содержание слайда: 7.6. Энергетический спектр атома водорода
Значения полной энергии электрона в атоме водорода зависят от всех четырёх квантовых чисел:
n – главное квантовое число: 1, 2, 3, ….
l - орбитальное квантовое число: 0, 1, 2, …, n -1
m – магнитное квантовое число: - l, …,0, …, + l
s – спиновое квантовое число: 1/2
№52 слайд


Содержание слайда: Главное квантовое число определяет энергию стационарных состояний: .
Главное квантовое число определяет энергию стационарных состояний: .
Принято говорить, что энергетические уровни с данным числом «n» расщепляются с учётом остальных квантовых чисел на подуровни.
Если:
n = 1, то l = 0 – данный уровень не расщепляется;
n = 2, то l = 0, 1 – данный уровень расщепляется на два подуровня;
n = 3, то l = 0, 1, 2 – данный уровень расщепляется на три подуровня и т.д.
№55 слайд


Содержание слайда: Расщепление энергетических уровней по магнитному квантовому числу происходит в магнитном поле и названо тонким расщеплением.
Расщепление энергетических уровней по магнитному квантовому числу происходит в магнитном поле и названо тонким расщеплением.
Такое расщепление было обнаружено в 1896 году голландским учёным П. Зееманом.
Если:
l = 0, то m = 0 – уровень не расщепляется;
l = 1, то m = -1, 0, +1 – уровень расщепляется на три подуровня;
l = 2, то m = -2, -1, 0, +1, +2 – уровень расщепляется на пять подуровней.
№57 слайд


Содержание слайда: С учётом трёх квантовых чисел уровень с заданным числом n расщепляется на n2 подуровней.
С учётом трёх квантовых чисел уровень с заданным числом n расщепляется на n2 подуровней.
Число возможных состояний определяется формулой:
Вырожденными называются состояния с одинаковой энергией.
Кратностью вырождения называется число различных состояний с одинаковым значением главного квантового числа.
№58 слайд


Содержание слайда: Кратность тонкого вырождения уровней:
Кратность тонкого вырождения уровней:
первого: n = 1 равна 1;
второго: n = 2 равна 4;
третьего: n = 3 равна 9;
четвёртого: n = 4 равна 16.
Тонкое вырождение снимается магнитным полем.
В зависимости от числа m ориентации векторов
в поле различны, поэтому и энергии, соответствующие квантовым состояниям с разными проекциями
на направление поля, оказываются различными.
№59 слайд


Содержание слайда: Сверхтонким называется расщепление энергетических уровней по спиновому квантовому числу.
Сверхтонким называется расщепление энергетических уровней по спиновому квантовому числу.
Оно было обнаружено П. Зееманом в слабых магнитных полях при применении очень чувствительных спектральных приборов с большой разрешающей способностью.
Поскольку спиновой магнитный момент электрона
принимает только две проекции, то каждый уровень в слабом магнитном поле расщепляется на два подуровня.
№61 слайд


Содержание слайда: С учётом всех четырёх квантовых чисел число возможных энергетических состояний электрона в атоме водорода и любом другом атоме равно
С учётом всех четырёх квантовых чисел число возможных энергетических состояний электрона в атоме водорода и любом другом атоме равно
Состояние 1s (n = 1, l = 0) является основным состоянием атома водорода.
В этом состоянии атом может находиться бесконечно долго, обладая минимальной энергией.
Все остальные состояния называются возбуждёнными.
№62 слайд


Содержание слайда: Чтобы перевести атом из основного состояния в возбужденное, ему необходимо сообщить энергию.
Чтобы перевести атом из основного состояния в возбужденное, ему необходимо сообщить энергию.
Это может быть осуществлено за счет:
теплового соударения атомов;
столкновения атома с быстрым электроном;
за счет поглощения атомом фотона.
Скачать все slide презентации Квантовомеханическая модель атома водорода одним архивом:
Похожие презентации
-
 Содержание Атомная физика 1. Строение атома (Резерфода) 2. Модель атома водорода по Бору 3. Квантовые постулаты Бора 4. Испускание и п
Содержание Атомная физика 1. Строение атома (Резерфода) 2. Модель атома водорода по Бору 3. Квантовые постулаты Бора 4. Испускание и п -
 Постулаты Бора. Модель атома водорода по Бору.
Постулаты Бора. Модель атома водорода по Бору. -
 Постулаты Бора. Модель атома водорода по Бору
Постулаты Бора. Модель атома водорода по Бору -
 Глава 27. Теория атома водорода по Бору Большую роль в развитии атомистической теории сыграл Д. И. Менделеев, разработавший в 1869 г.
Глава 27. Теория атома водорода по Бору Большую роль в развитии атомистической теории сыграл Д. И. Менделеев, разработавший в 1869 г. -
 СОДЕРЖАНИЕ 1 модуль 1. Строение атома. Опыты Резерфорда. 2. Модель атома Резерфорда. 3. Радиоактивное превращение атомных ядер. 4. Со
СОДЕРЖАНИЕ 1 модуль 1. Строение атома. Опыты Резерфорда. 2. Модель атома Резерфорда. 3. Радиоактивное превращение атомных ядер. 4. Со -
 Планетарная (ядерная) модель атома Атом – микрочастица, состоящая из положительно заряженного ядра и окружающих его электронов
Планетарная (ядерная) модель атома Атом – микрочастица, состоящая из положительно заряженного ядра и окружающих его электронов -
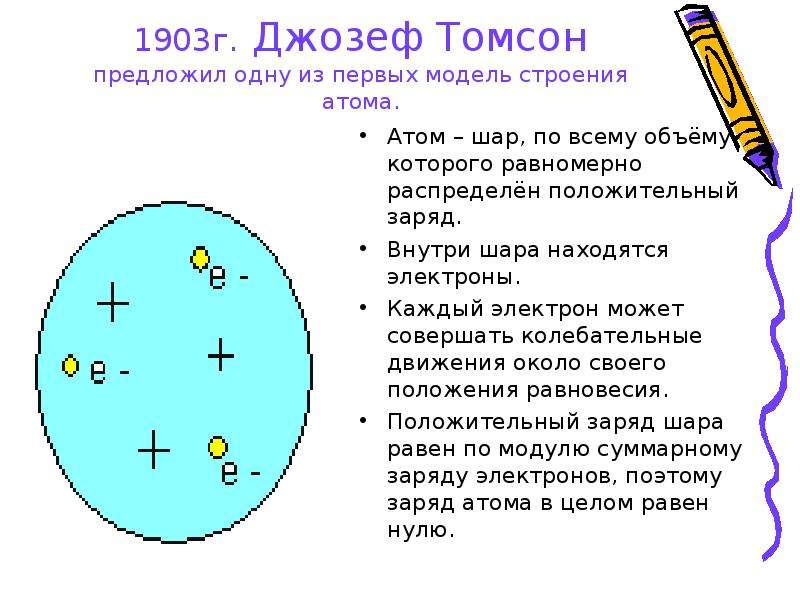 1903г. Джозеф Томсон предложил одну из первых модель строения атома.
1903г. Джозеф Томсон предложил одну из первых модель строения атома. -
 Ядерна модель атома. Квантові постулати Бора .
Ядерна модель атома. Квантові постулати Бора . -
 Історія розвитку вчення про будову атома. Ядерна модель атома
Історія розвитку вчення про будову атома. Ядерна модель атома -
 Модель атома Резерфорда Ядерная или Планетарная модель атома Вонс Диана и Тарамова Айза 10«Б»
Модель атома Резерфорда Ядерная или Планетарная модель атома Вонс Диана и Тарамова Айза 10«Б»




























