Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
15 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
342.00 kB
Просмотров:
165
Скачиваний:
1
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Лекции по физике. Молекулярная физика и основы термодинамики
Основные газовые законы.
№2 слайд
Содержание слайда: Основные газовые законы
Закон Бойля-Мариотта: PV=const при t0=const
Закон Шарля: P/T=const при V=const
Закон Гей-Люссака: V/T=const при P=const
Закон Авогадро: одинаковые количества газов при одинаковых температуре и давлении занимают одинаковый объём
№3 слайд
Содержание слайда: Основные газовые законы
Законы Шарля и Гей-Люссака имеют такой простой вид если температура измеряется по абсолютной шкале
Первоначально эти законы были сформулированы для температуры, измеренной в некоторой практической шкале. В этом случае они имеют более сложный вид:
P=P0[1+(t-t0)]
V=V0[1+(t-t0)]
при чём коэффициенты и оказались равными и не зависящими от рода газа
№4 слайд
Содержание слайда: Основные газовые законы
Процессы, описываемые уравнениями
1-3 называются изопроцессами:
Изотермическим
Изохорным
Изобарным
№5 слайд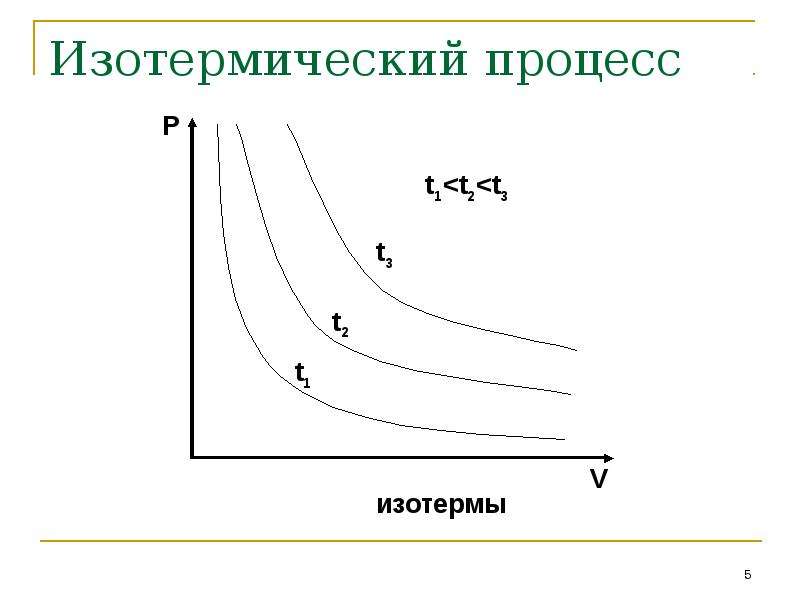
Содержание слайда: Изотермический процесс
№6 слайд
Содержание слайда: Изотермический процесс
№7 слайд
Содержание слайда: Изохорный процесс
№8 слайд
Содержание слайда: Изохорный процесс
№9 слайд
Содержание слайда: Изобарный процесс
№10 слайд
Содержание слайда: Изобарный процесс
№11 слайд
Содержание слайда: Основные газовые законы
Если измерять температуру по шкале Цельсия, то оказывается, что точка пересечения изохорного и изобарного процессов с осью температур имеет координату t=-373,15 0С. Это значит, что ==1/273,15 1/0С
№12 слайд
Содержание слайда: Основные газовые законы
Если ввести новую шкалу температур, такую, что Т=t+273,15, то уравнения примут более простой вид:
P/T=const
V/T=const
Определённая таким образом температура называется абсолютной температурой
№13 слайд
Содержание слайда: Основные газовые законы
Рассмотрим переход из состояния 1 в 2 через а на графике P-V:
Для 1а: P1/T1=const=Pa/Ta=Pa/T2 ()
Для а2: PaVa=PaV1=P2V2 Pa=P2V2/V1
Исключив Ра из (), получим: P1/T1=(P2V2)/(T2V1) или:
PV/T=const
т.о. мы пришли к уравнению состояния идеального газа
№14 слайд
Содержание слайда: Основные газовые законы
Из закона Авогадро следует, что величина соотношения (PV)/T не зависит от вида газа, значит мы можем записать, что для одного моля любого газа (PV)/T=R, где R – универсальная газовая постоянная, называемая постоянной Авогадро
R=8,31 Дж/(градмоль)
Из закона Дальтона следует, что при постоянных V и Т, Р является линейной функцией количества вещества
№15 слайд
Содержание слайда: Основные газовые законы
Т.о., мы пришли к уравнению Клапейрона-Менделеева:
PV=RT
или
PV=(m/)RT
























