Презентация Основные положения молекулярно-кинетической теории. Масса и размеры молекул. Термодинамическая система и параметры ее состояния онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Основные положения молекулярно-кинетической теории. Масса и размеры молекул. Термодинамическая система и параметры ее состояния абсолютно бесплатно. Урок-презентация на эту тему содержит всего 62 слайда. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Физика » Основные положения молекулярно-кинетической теории. Масса и размеры молекул. Термодинамическая система и параметры ее состояния
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:62 слайда
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:787.50 kB
- Просмотров:134
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№1 слайд


Содержание слайда: Лекция 9
Основные положения молекулярно-кинетической теории. Масса и размеры молекул. Термодинамическая система и параметры ее состояния
В основе молекулярно-кинетической теории лежат три основных положения:
1) Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы.
2) Атомы и молекулы находятся в непрерывном хаотическом движении.
3) Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
№2 слайд


Содержание слайда: Основы МКТ. 9.2
Идеальным газом называется газ, молекулы которого являются материальными точками, то есть расстояния между молекулами намного превосходят их размеры, а единственный вид их взаимодействий между собой – упругие механические столкновения.
Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур.
Относительной молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома) m0 данного вещества к 1/12 массы атома углерода m0c:
№4 слайд


Содержание слайда: Основы МКТ. 9.4
Всякая система может находиться в различных состояниях, отличающихся температурой, давлением, объемом и т.д. Подобные величины, характеризующие состояние системы, называются параметрами состояний. Не всегда какой-либо параметр имеет определенное значение. Например, если температура в разных точках тела не одинакова, то телу нельзя приписать определенное значение параметра Т. В этом случае состояние называется неравновесным. То же самое может иметь место и для других параметров. Равновесным состоянием системы называется такое состояние, при котором все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго. Процесс, состоящий из непрерывной последовательности равновесных состояний, называется, равновесны процессом.
№6 слайд


Содержание слайда: Основы МКТ. 9.6
где В – постоянная для данной массы газа величина. В соответствии с законом установленным Авогадро одинаковые количества различных идеальных газов при одинаковых условиях (давление, температура) занимают одинаковый объем. Следовательно, когда количество газа равно одному молю, величина В будет одинакова для всех газов. Обозначив соответствующую величину через R можно записать:
№7 слайд


Содержание слайда: Основы МКТ. 9.7
От уравнения для одного моля легко перейти к уравнению для любой массы газа m, приняв во внимание, что при одинаковых давлении и температуре n молей газа будут занимать в n раз больший объем чем один моль: V=nV. Умножив уравнение Клайперона на и заменив nV через V, получаем:
№9 слайд


Содержание слайда: Основы МКТ. 9.9
Изохорный процесс – это процесс равновесного нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным. Как следует из уравнения состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ T или
№11 слайд


Содержание слайда: Лекция 10
Связь кинетической энергии молекул газа с температурой и давлением. Равнораспределение энергии по степеням свободы. Число степеней свободы и средняя энергия многоатомной молекулы.
Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул. При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n. Таким образом, можно ожидать, что давление газа связано с концентрацией молекул и с энергией их движения.
№12 слайд


Содержание слайда: Основы МКТ. 10.2
При ударе о стенку сосуда молекула сообщает ей импульс, численно равный изменению импульса молекулы. Каждый элемент поверхности dS непрерывно подвергается бомбардировке большим количеством молекул, в результате чего за время dt получает суммарный импульс dp направленный по нормали к dS. Отношение dр к dt дает, как известно из второго закона Ньютона, силу, действующую на dS, а отношение этой силы к dS дает давление Р.
№13 слайд


Содержание слайда: Основы МКТ. 10.3
По третьему закону Ньютона стенка получает при ударе импульс 2mv, имеющий направление нормали. За время dt до элемента стенки dS долетят все движущиеся по направлению к нему молекулы, заключенные в объеме цилиндра с основанием dS и высотой vdt. Число этих молекул равно:
№15 слайд


Содержание слайда: Основы МКТ. 10.5
Отказ о предположении, о равенстве всех скоростей приводит к тому, что необходимо учитывать среднюю квадратичную скорость молекул газа или среднюю кинетическую энергию.
Давление равно двум третям кинетической энергии поступательного движении молекул, заключенных в единице объема.
Из полученного закона следует, что давление пропорционально средней кинетической энергии поступательного движение молекул. Вместе с тем оно пропорционально температуре газа. Следовательно, средняя кинетическая энергия пропорциональна температуре газа.
№18 слайд


Содержание слайда: Основы МКТ. 10.8
Очевидно, что число координат в трехмерном пространстве, а следовательно и число степеней свободы одноатомного газа, равно трем. Газ может быть двухатомным, трёхатомным и т. д. Для молекул таких газов характерно наличие внутренней структуры и, соответственно, дополнительных степеней свободы. Если атомы в молекуле жестко связаны между собой, в качестве дополнительных степеней свободы выступают вращательные степени, характеризующие угловое положение молекулы в пространстве.
№19 слайд


Содержание слайда: Основы МКТ. 10.9
В одноатомном газе молекула имеет три степени свободы, соответствующие трем пространственным координатам. Вследствие равноправности этих координат, можно, на основании связи кинетической энергии с температурой, сделать предположение, что на каждую степень свободы молекулы одноатомного газа приходится в среднем кинетическая энергия, равная
№21 слайд


Содержание слайда: Лекция 11
Внутренняя энергия термодинамической системы. Теплоемкость. Работа, совершаемая газом при изменении объема
Полная энергия термодинамической системы представляет собой сумму кинетической энергии движения всех тел, входящих в систему, потенциальной энергии взаимодействия их между собой и с внешними телами и энергии, содержащейся внутри тел системы. Если из полной энергии вычесть кинетическую энергию, характеризующую макроскопическое движение системы как целого, и потенциальную энергию взаимодействия её тел с внешними макроскопическими телами, то оставшаяся часть будет представлять собой внутреннюю энергию термодинамической системы.
Внутренняя энергия термодинамической системы включает в себя энергию микроскопического движения и взаимодействия частиц системы, а так же их внутримолекулярную и внутриядерную энергии.
Вследствие того, что молекулы идеального газа на расстоянии не взаимодействуют друг с другом внутренняя энергия такого газа будет складываться из энергий отдельных молекул. Следовательно, внутренняя энергия произвольной массы идеального газа m будет равна произведению числа молекул в данной массе газа на энергию одной молекулы
№23 слайд


Содержание слайда: Термодинамика. 11.3
Очевидно, что теплоемкость термодинамической системы изменяется при изменении количества вещества в ней. Для систем, находящихся в состоянии термодинамического равновесия, их теплоемкость пропорциональна количеству вещества. Это позволяет ввести для описания свойств тела удельную теплоемкость:
№24 слайд


Содержание слайда: Термодинамика. 11.4
Теплоемкость, так же как и количество переданной телу теплоты, зависит от того, каким образом, а точнее при осуществлении какого процесса, теплота передавалась этому телу. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const).
№28 слайд


Содержание слайда: Термодинамика. 11.8
Например, для молекул водорода, при температуре порядка 50 К вращательные степени свободы как бы "вымерзают" и его молярная теплоёмкость CV становится близкой к . А при температурах порядка 300 - 400 К вращательные степени свободы "включаются" и его теплоёмкость CV приобретает значение . При дальнейшем, значительном по сравнению с комнатной, повышении температуры начинают проявляться колебательные степени свободы. Для двухатомного газа, например водорода, это приводит к увеличению энергии его молекулы на величину kT, и соответственно к возрастанию молярной теплоемкости на R. Поэтому при очень высоких температурах молярная теплоёмкость водорода стремится к значению .
№29 слайд


Содержание слайда: Термодинамика. 11.9
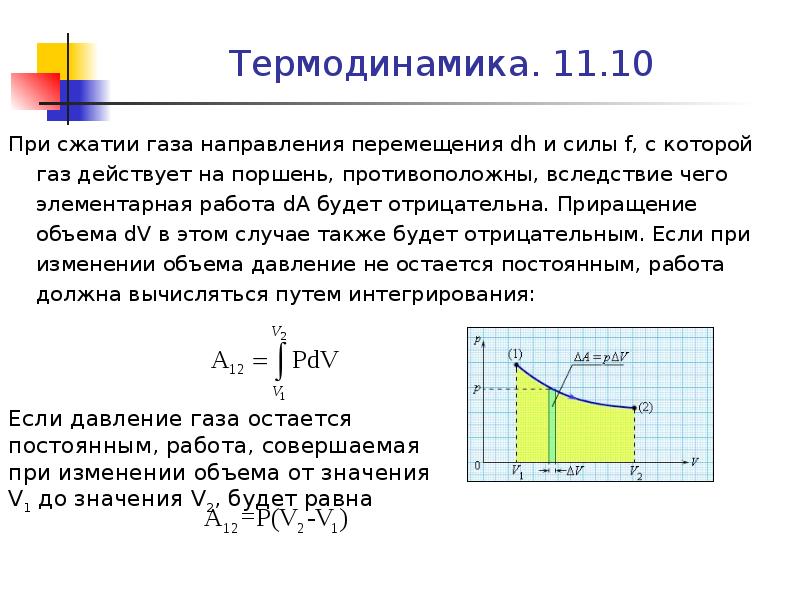
Пусть газ заключен в цилиндрический сосуд, закрытый плотно пригнанным легко скользящим поршнем. Если вследствие каких-либо причин газ станет расширяться, он будет перемещать поршень и совершать над ним работу. Элементарная работа, совершаемая газом при перемещении поршня на отрезок dh, равна
№30 слайд

Содержание слайда: Термодинамика. 11.10
При сжатии газа направления перемещения dh и силы f, с которой газ действует на поршень, противоположны, вследствие чего элементарная работа dA будет отрицательна. Приращение объема dV в этом случае также будет отрицательным. Если при изменении объема давление не остается постоянным, работа должна вычисляться путем интегрирования:
№31 слайд


Содержание слайда: Лекция 12
Распределение молекул газа по скоростям. Функция распределения Максвелла. Наиболее вероятная, средняя и средне квадратичные скорости молекул.
В сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям, зависящее от абсолютной температуры T. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а величины скоростей подчиняются определенной закономерности. Распределение молекул газа по величине скоростей называется распределением Максвелла.
№32 слайд


Содержание слайда: Распределение Максвелла. 12.2
Плотность точек может зависеть только от модуля скорости v. Предположим, что в газе содержится N молекул. Выделим в окрестности некоторой точки малый объем – dvxdvydvz. Относительное число точек (молекул) в этом объеме, или другими словами, вероятность dP того, что скорость молекулы, т.е. конец вектора v, попадает в этот объем, можно записать так:
№35 слайд


Содержание слайда: Распределение Максвелла. 12.5
Интегрирование в пределах от до не означает, что в газе есть молекулы с такими большими скоростями. Молекул с весьма большими скоростями очень мало, и они практически не вносят никакого вклада в нормировочный интеграл. Это и позволяет записывать такие пределы. Аналогичный вид имеют функции φ(vy) и φ(vz). Тогда f(v) будет иметь вид:
№39 слайд

Содержание слайда: Распределение Максвелла. 12.9
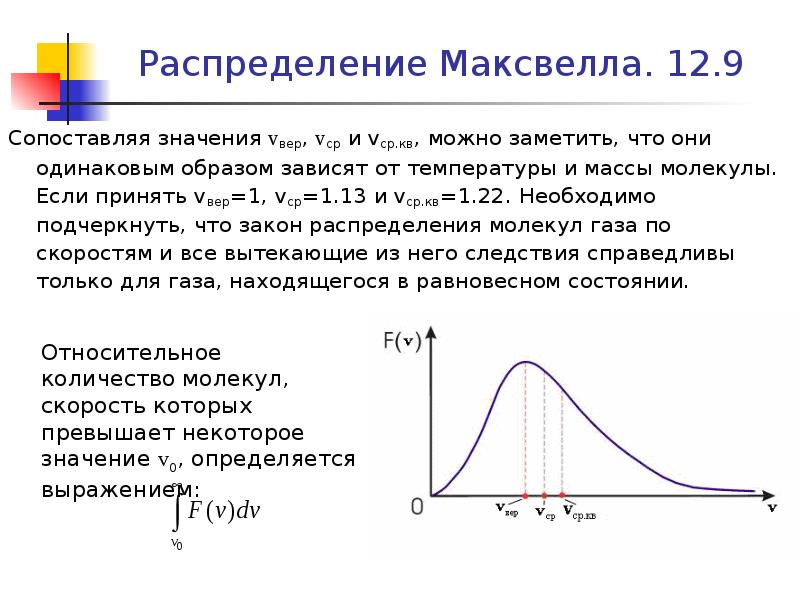
Сопоставляя значения vвер, vср и vср.кв, можно заметить, что они одинаковым образом зависят от температуры и массы молекулы. Если принять vвер=1, vср=1.13 и vср.кв=1.22. Необходимо подчеркнуть, что закон распределения молекул газа по скоростям и все вытекающие из него следствия справедливы только для газа, находящегося в равновесном состоянии.
№40 слайд


Содержание слайда: Распределение Максвелла. 12.10
Относительное число молекул, скорость которых превышает некоторое значение v0, сильно растет с температурой. В таблице приведены относительные количества молекул скорости которых лежат в определенных интервалов относительно наиболее вероятной скорости.
№41 слайд


Содержание слайда: Лекция 13
Опыты Штерна и Ламмерта. Идеальный газ в поле силы тяжести, барометрическая формула. Распределения Больцмана.
Первое экспериментальное определение скоростей молекул было проведено Штерном в1920 г. Прибор, использованный для этой цели, состоял из двух коаксиальных цилиндров. По оси цилиндров была натянута платиновая нить, покрытая серебром. При нагревании нити электрическим током с ее поверхности испарялись атомы серебра.
№42 слайд


Содержание слайда: Распределение Больцмана. 13.2
Смещение относительно первоначального положение равно
Δs = RΔφ
R – радиус внешнего цилиндра.
Δφ – угол на который повернутся цилиндры.
В свою очередь Δφ связано с угловой скоростью относительного вращения цилиндров
Δφ=ωt,
где t – время за которое атом серебра пролетает зазор между цилиндрами.
t =R/v.
Радиус внутреннего цилиндра мал. Окончательно получаем:
№43 слайд

Содержание слайда: Распределение Больцмана. 13.3
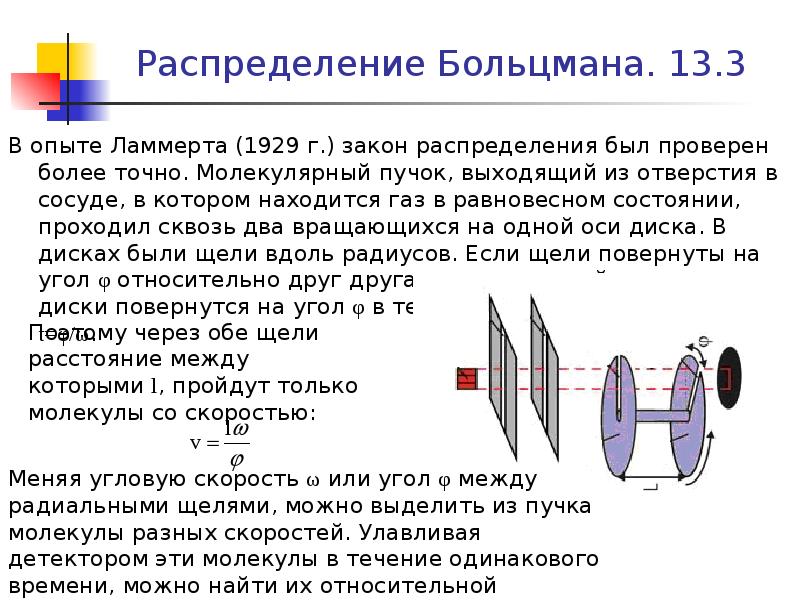
В опыте Ламмерта (1929 г.) закон распределения был проверен более точно. Молекулярный пучок, выходящий из отверстия в сосуде, в котором находится газ в равновесном состоянии, проходил сквозь два вращающихся на одной оси диска. В дисках были щели вдоль радиусов. Если щели повернуты на угол φ относительно друг друга, то при угловой скорости ω диски повернутся на угол φ в течении промежутка времени t=φ/ω.
№44 слайд


Содержание слайда: Распределение Больцмана. 13.4
В отсутствии внешних сил концентрация молекул газа в состоянии термодинамического равновесия всюду одинакова. Если же газ находится во внешнем поле сил, например в поле силы тяжести, то ситуация становится иной. При отсутствии теплового движение все молекулы “упали” бы на поверхность Земли. Наличие же теплового движения мешает этому. В результате совместного действия этих двух факторов устанавливается равновесия, и концентрация молекул становится зависящей от высоты. При тепловом равновесии температура Т должна быть одинакова по всей толщине газа, иначе бы возникли потоки тепла, и состояние газа не было бы равновесным, т.е. будет рассматриваться изотермическая атмосфера.
№45 слайд


Содержание слайда: Распределение Больцмана. 13.5
Атмосферное давление на какой-либо высоте h обусловлено весом вышележащих слоев газа. Пусть Р давление газа на высоте h. Тогда давление на высоте h+dh, будет P+dP, причем, если dh больше нуля, то dP будет меньше нуля, так как вес вышележащих слоев атмосферы, а следовательно, и давление с высотой убывают. Разность давлений P и P+dP равна весу газа, заключенного в объеме цилиндра с площадью основания, равной единице, и высотой dh:
№50 слайд


Содержание слайда: Распределение Больцмана. 13.10
Закон Максвелла дает распределение частиц по кинетической энергии (из распределения по v2, просто получить распределение по кинетической энергии), распределение Больцмана зависимость от потенциальной энергии. Эти распределения можно объединить в один закон Максвелла-Больцмана, согласно которому содержащееся в единице объема количество молекул, скорость которых лежит между v и v+dv, равно:
№51 слайд
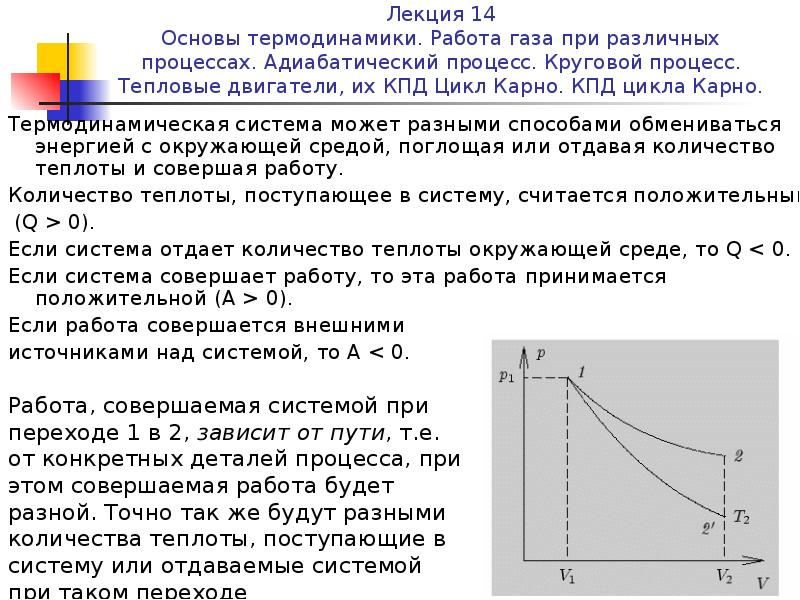

Содержание слайда: Лекция 14
Основы термодинамики. Работа газа при различных процессах. Адиабатический процесс. Круговой процесс. Тепловые двигатели, их КПД Цикл Карно. КПД цикла Карно.
Термодинамическая система может разными способами обмениваться энергией с окружающей средой, поглощая или отдавая количество теплоты и совершая работу.
Количество теплоты, поступающее в систему, считается положительным
(Q > 0).
Если система отдает количество теплоты окружающей среде, то Q < 0.
Если система совершает работу, то эта работа принимается положительной (А > 0).
Если работа совершается внешними
источниками над системой, то A < 0.
№52 слайд


Содержание слайда: Основы термодинамики. 14.2
Многочисленные эксперименты показывают, что разность Q - A не зависит от характера протекания процесса и определяется только начальным и конечным состояниями системы. Так как эти состояния обладают определенной внутренней энергией U, которая для идеального газа зависит только от температуры газа, то на основании закона сохранения энергии, обобщенного на случай тепловых явлений, можно записать:
№57 слайд


Содержание слайда: Основы термодинамики. 14.7
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в
№59 слайд


Содержание слайда: Основы термодинамики. 14.9
Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0. Полное количество теплоты Q, полученное рабочим телом за цикл, равно:
№60 слайд


Содержание слайда: Основы термодинамики. 14.10
Работа A, совершаемая рабочим телом за цикл, равна полученному за цикл количеству теплоты Q. Отношение работы A к количеству теплоты Q1, полученному рабочим телом за цикл от нагревателя, называется коэффициентом полезного действия η тепловой машины
№61 слайд


Содержание слайда: Основы термодинамики. 14.11
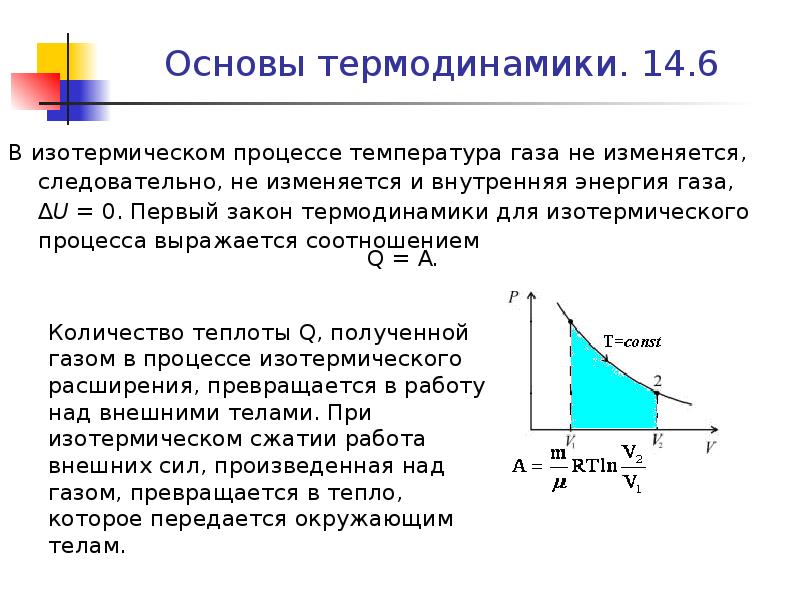
При изотермическом процессе внутренняя энергия идеального газа остается постоянной. Поэтому количество полученного газом тепла Q1 равно работе А12, совершаемой газом при переходе из состояния 1 в состояние 2 (изотермический процесс при большей температуре). Эта работа равна:
Скачать все slide презентации Основные положения молекулярно-кинетической теории. Масса и размеры молекул. Термодинамическая система и параметры ее состояния одним архивом:
Похожие презентации
-
 Тема занятия Основные положения молекулярно-кинетической теории
Тема занятия Основные положения молекулярно-кинетической теории -
 "Основные положения молекулярно-кинетической теории»
"Основные положения молекулярно-кинетической теории» -
 Скачать презентацию Основные положения молекулярно-кинетической теории
Скачать презентацию Основные положения молекулярно-кинетической теории -
 Основные-положения молекулярно-кинетической теории. Лекция 7
Основные-положения молекулярно-кинетической теории. Лекция 7 -
 Основные положения МКТ (молекулярная кинетическая теория) и их опытные обоснования
Основные положения МКТ (молекулярная кинетическая теория) и их опытные обоснования -
 Основные положения молекулярно-кинетической теории. (10 класс)
Основные положения молекулярно-кинетической теории. (10 класс) -
 Адиабатический процесс. Уравнение адиабаты При выводе основного уравнения молекулярно-кинетической теории идеальных газов (2.
Адиабатический процесс. Уравнение адиабаты При выводе основного уравнения молекулярно-кинетической теории идеальных газов (2. -
 Основное уравнение молекулярно-кинетической теории газов
Основное уравнение молекулярно-кинетической теории газов -
 Основные положения МКТ (молекулярная физика)
Основные положения МКТ (молекулярная физика) -
 Хочешь стать отличником? «Основы молекулярно-кинетической теории» Автор: Богомолова Н. В. учитель физики МОУ СОШ 3 г. Бийска Алт
Хочешь стать отличником? «Основы молекулярно-кинетической теории» Автор: Богомолова Н. В. учитель физики МОУ СОШ 3 г. Бийска Алт