Презентация ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ВНУТРЕННЯЯ ЭНЕРГИЯ. РАБОТА И ТЕПЛОТА 1. Внутренняя энергия. Работа и теплота 2. Теплоёмкость идеал онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ВНУТРЕННЯЯ ЭНЕРГИЯ. РАБОТА И ТЕПЛОТА 1. Внутренняя энергия. Работа и теплота 2. Теплоёмкость идеал абсолютно бесплатно. Урок-презентация на эту тему содержит всего 54 слайда. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Физика » ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ВНУТРЕННЯЯ ЭНЕРГИЯ. РАБОТА И ТЕПЛОТА 1. Внутренняя энергия. Работа и теплота 2. Теплоёмкость идеал
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:54 слайда
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:538.00 kB
- Просмотров:205
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№1 слайд


Содержание слайда: ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
ВНУТРЕННЯЯ ЭНЕРГИЯ. РАБОТА И ТЕПЛОТА
1. Внутренняя энергия. Работа и теплота
2. Теплоёмкость идеального газа. Уравнение Майера
3. Теплоёмкости одноатомных и многоатомных газов
4. Закон о равномерном распределении энергии по степеням свободы
5. Применение первого начала термодинамики к изопроцессам идеальных газов
№2 слайд


Содержание слайда: Внутренняя энергия. Работа и теплота
Внутренняя энергия – энергия покоя. Она складывается из теплового хаотического движения молекул, составляющих тело, потенциальной энергии их взаимного расположения, кинетической и потенциальной энергии электронов в атомах, нуклонов в ядрах и так далее.
№8 слайд


Содержание слайда: Правило знаков: если тепло передаётся от окружающей среды данной системе, и если система производит работу над окружающими телами, при этом . Учитывая правило знаков, первое начало термодинамики можно записать в виде:
– изменение внутренней энергии тела равно разности сообщаемой телу теплоты и произведённой телом работы.
№10 слайд


Содержание слайда: Важно отметить, что теплота Q и работа А зависят от того, каким образом совершен переход из состояния 1 в состояние 2 (изохорически, адиабатически и т.д.), а внутренняя энергия U не зависит.
Количество теплоты выражается в тех же единицах, что работа и энергия, т.е. в джоулях (Дж).
№14 слайд


Содержание слайда: Если то согласно первому началу термодинамики, т.е. нельзя построить периодически действующий двигатель, который совершал бы бóльшую работу, чем количество сообщенной ему извне энергии. Иными словами, вечный двигатель первого рода невозможен. Это одна из формулировок первого начала термодинамики.
№16 слайд


Содержание слайда: Теплоёмкость идеального газа. Уравнение Майера
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус
Размерность теплоемкости: [C] = Дж/К.
Теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости.
№17 слайд


Содержание слайда: Удельная теплоёмкость (Суд) – есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Дж/К.
Для газов удобно пользоваться молярной теплоемкостью Сμ количество теплоты, необходимое для нагревания 1 моля газа на 1 градус
[Cμ] = Дж/(мольК).
№18 слайд


Содержание слайда: Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.
Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV.
№21 слайд


Содержание слайда: Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что
Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Следовательно Q и С не являются функциями состояния. Величины СР и СV оказываются связанными простыми соотношениями. Найдём их.
№26 слайд


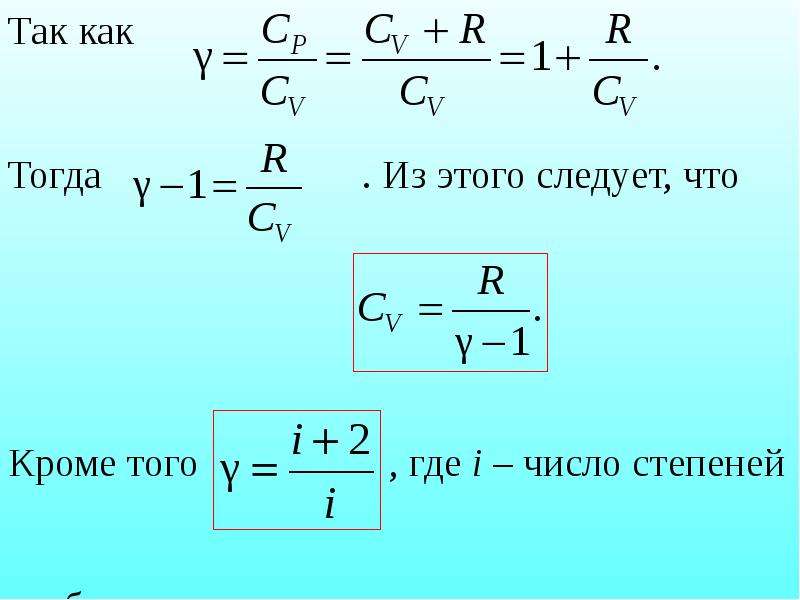
Содержание слайда: Это уравнение Майера для одного моля газа. Из него следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус при изобарическом процессе.
Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж.
№46 слайд


Содержание слайда: Для одноатомных газов это выполняется в очень широких пределах, а для двухатомных газов только в интервале от 100 1000 К. Отличие связано с проявлением квантовых законов. При низких температурах вращательное движение как бы «вымерзает» и двухатомные молекулы движутся поступательно, как одноатомные; равны их теплоёмкости.
При увеличении температуры, когда Т > 1000 К, начинают сказываться колебания атомов молекулы вдоль оси z (атомы в молекуле связаны не жёстко, а как бы на пружине).
№47 слайд


Содержание слайда: Одна колебательная степень свободы несет
энергии, так как при этом есть и кинетическая и потенциальная энергия, то есть появляется шестая степень свободы – колебательная. При температуре равной 2500 К, молекулы диссоциируют. На диссоциацию молекул тратится энергия раз в десять превышающая среднюю энергию поступательного движения. Это объясняет сравнительно низкую температуру пламени. Кроме того, атом – сложная система, и при высоких температурах начинает сказываться движение электронов внутри него.
Скачать все slide презентации ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ВНУТРЕННЯЯ ЭНЕРГИЯ. РАБОТА И ТЕПЛОТА 1. Внутренняя энергия. Работа и теплота 2. Теплоёмкость идеал одним архивом:
Похожие презентации
-
 Первое начало термодинамики. Внутренняя энергия. Работа и теплота. Теплоемкость идеального газа. (Лекция 7)
Первое начало термодинамики. Внутренняя энергия. Работа и теплота. Теплоемкость идеального газа. (Лекция 7) -
 Первое начало термодинамики. Работа. Внутренняя энергия. Теплота
Первое начало термодинамики. Работа. Внутренняя энергия. Теплота -
 Смеси идеальных газов. I закон термодинамики. Внутренняя энергия и работа
Смеси идеальных газов. I закон термодинамики. Внутренняя энергия и работа -
 Внутренняя энергия. Работа. 1 начало термодинамики
Внутренняя энергия. Работа. 1 начало термодинамики -
 Термодинамика – раздел физики, изучающий возможности использования внутренней энергии тел для совершения механической работы. В
Термодинамика – раздел физики, изучающий возможности использования внутренней энергии тел для совершения механической работы. В -
 По физике Внутренняя энергия Работа в термодинамике
По физике Внутренняя энергия Работа в термодинамике -
 Работа в термодинамике. Внутренняя энергия. Первый закон термодинамики. Адиабатный процесс
Работа в термодинамике. Внутренняя энергия. Первый закон термодинамики. Адиабатный процесс -
 Внутренняя энергия и работа в термодинамике
Внутренняя энергия и работа в термодинамике -
 Термодинамика. Основные понятия и определения. Теплота и работа как форма передачи энергии
Термодинамика. Основные понятия и определения. Теплота и работа как форма передачи энергии -
 Первое начало термодинамики. Теплота и работа
Первое начало термодинамики. Теплота и работа