Презентация Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение) онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение) абсолютно бесплатно. Урок-презентация на эту тему содержит всего 69 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Физика » Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение)
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:69 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:5.74 MB
- Просмотров:153
- Скачиваний:1
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: Жидкостная хроматография
метод разделения, в котором подвижная фаза представляет собой жидкость, а неподвижная – твердую или жидкую фазу (не смешивающуюся с подвижной фазой).
Различают:
А. колоночную (низкого и высокого давления – ВЭЖХ или ЖХВД) и планарную (ТСХ) хроматографии.
Б. по полярности неподвижной/подвижной фаз и по механизму удерживания/разделения:
- прямо-фазовую ЖХ (НФ – полярная, ПФ – неполярные жидкости)
- обращенно-фазовую ЖХ (НФ – неполярная или среднеполярная, ПФ – полярные жидкости).
- ионообменная или ионная.
- эксклюзионная (гель-хроматография).
№5 слайд


Содержание слайда: Варианты проведения ЖХ
1. Изократический режим – постоянный состав ПФ в течение всего анализа (разделение родственных веществ, мало отличающихся по полярности).
2. Градиентный режим – изменяется состав ПФ (линейный градиент – с постоянной скоростью и нелинейный градиент – изменение состава с переменной скоростью) – для разделения веществ, отличающихся по полярности (например, смесей водо- и жирорастворимых витаминов), для повышения эффективности разделения.
№7 слайд


Содержание слайда: Неподвижные фазы
Общие требования:
1. Для обеспечения высокой эффективности разделения – размер частиц сорбента должен быть четко установленного размера (1,8 – 10 мкм), четко сферической формы.
2. Должен быть устойчивым к повышенному давлению (нехрупким), к химическим веществам (устойчивость при рН 2-8) и температуре (до 60-80оС).
3. Обладать высокой удельной поверхностью (60-300 м2/г) и определенным размером пор (10-300 нм).
4. Обратимая сорбция разделенных соединений.
№13 слайд


Содержание слайда: Принципы разделения
1. Полярные фазы –
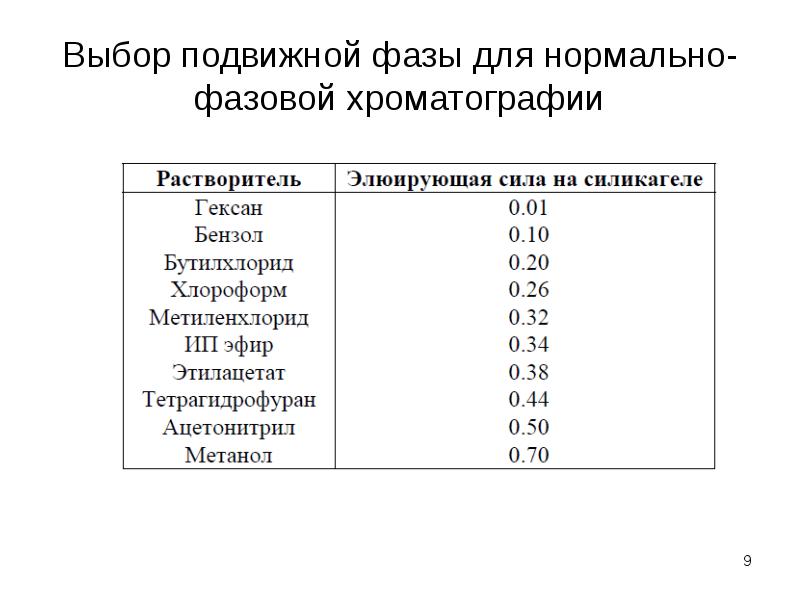
1.1. для разделения неполярных и малополярных веществ (слабо адсорбируются НФ) – малополярные элюенты (гексан (гептан) + низкая доля полярного растворителя, дихлорметан + низкая доля полярного растворителя).
1.2. для разделения полярных веществ (сильно адсорбируются НФ) – высокая доля полярных растворителей (метанол, ацетонитрил, вода), необходимо устанавливать рН (от 2 до 9), добавлять буферный раствор (ионная сила).
№14 слайд


Содержание слайда: Принципы разделения
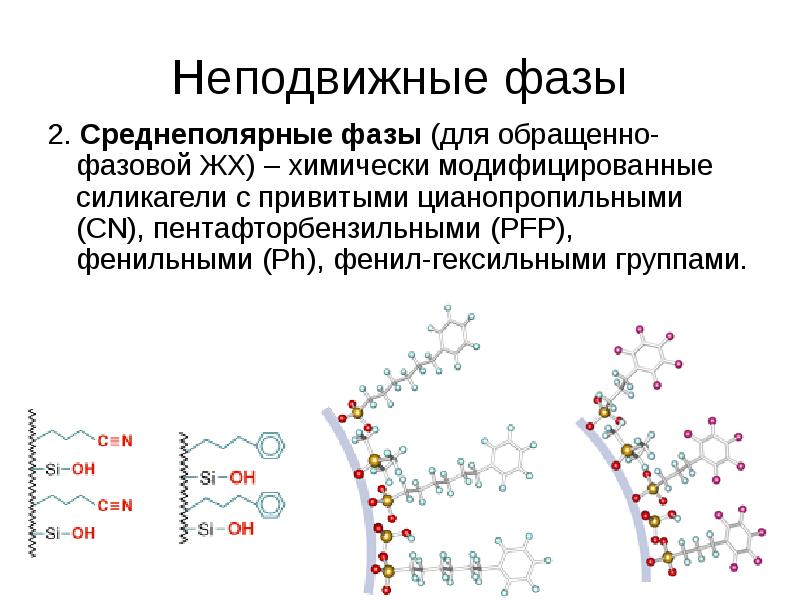
2. Средне- и неполярные фазы:
2.1. Для разделения неполярных веществ используются ПФ с высоким (40-100%) содержанием органического растворителя (ацетонитрил, метанол, тетрагидрофуран).
2.2. Для разделения ионизируемых органических веществ (кислот, оснований, амфолитов, ионов) необходимо использовать буферные растворы (рН 2-8 или для ряда колонок – 1-10).
2.3. Для разделения органических ионов и сильнополярных веществ – прибавляют ион-парные реагенты (алкилсульфонаты, четвертичные аммониевые соли).
№16 слайд


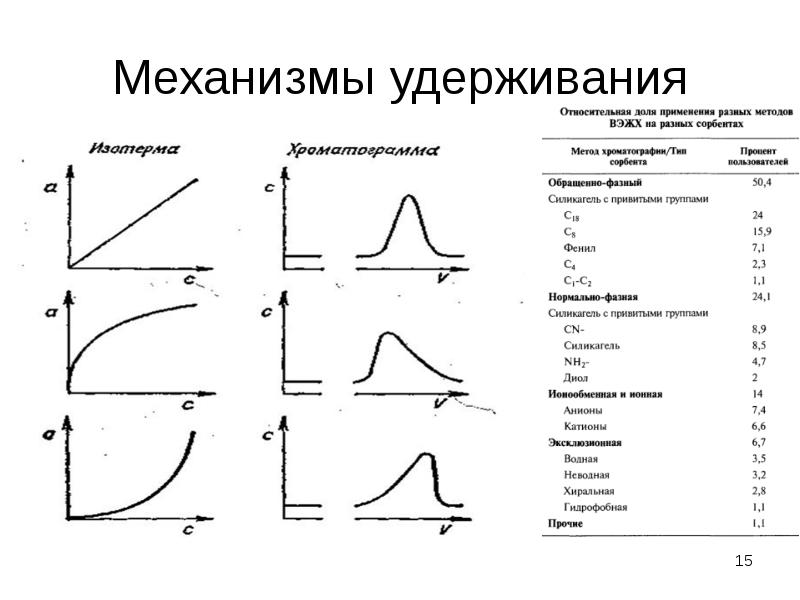
Содержание слайда: Закономерности удерживания в обращенно-фазовой ВЭЖХ
Вытеснительная модель удерживания:
1. Из ПФ на поверхности неполярного/среднеполярного сорбента адсорбируется органический компонент (метанол, ацетонитрил).
2. При введении органического вещества оно вытесняет с поверхности сорбента часть молекул органического модификатора. Данный процесс обратимый и при движении новой порции ПФ органический модификатор вновь вытесняет сорбат.
№17 слайд


Содержание слайда: Влияние рН ПФ и температуры
На неполярных фазах за счет дисперсионных взаимодействий лучше удерживаются неионизированные молекулы. При ионизации молекул удерживание при прочих равных условиях уменьшается.
Температура незначительно влияет на удерживание органических молекул в водно-органических фазах. При повышении температуры уменьшается вязкость ПФ и давление на колонке (возможно работать на более высоких скоростях ПФ).
№19 слайд
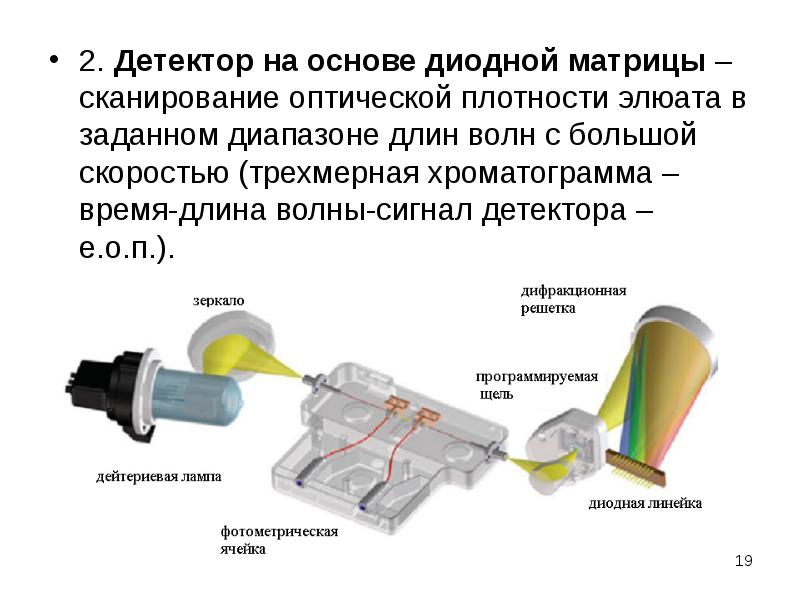

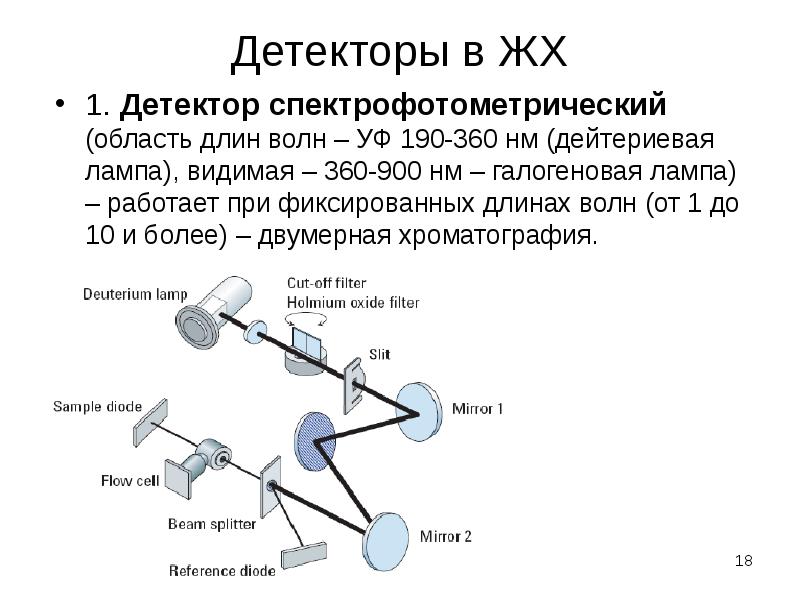
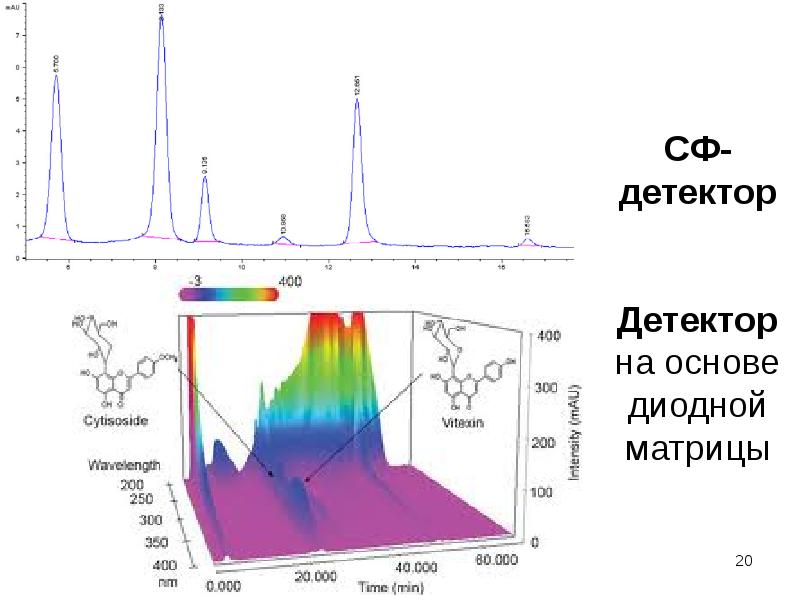
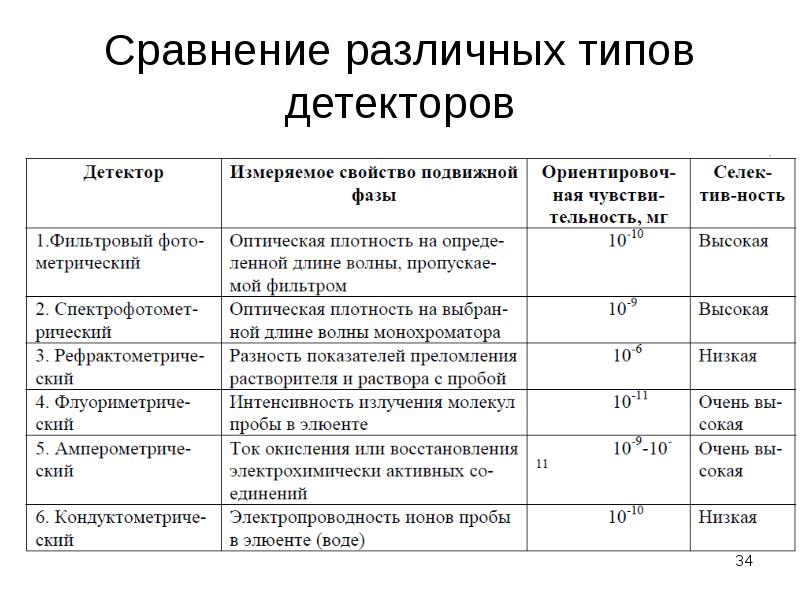
Содержание слайда: 2. Детектор на основе диодной матрицы – сканирование оптической плотности элюата в заданном диапазоне длин волн с большой скоростью (трехмерная хроматограмма – время-длина волны-сигнал детектора – е.о.п.).
2. Детектор на основе диодной матрицы – сканирование оптической плотности элюата в заданном диапазоне длин волн с большой скоростью (трехмерная хроматограмма – время-длина волны-сигнал детектора – е.о.п.).
№23 слайд
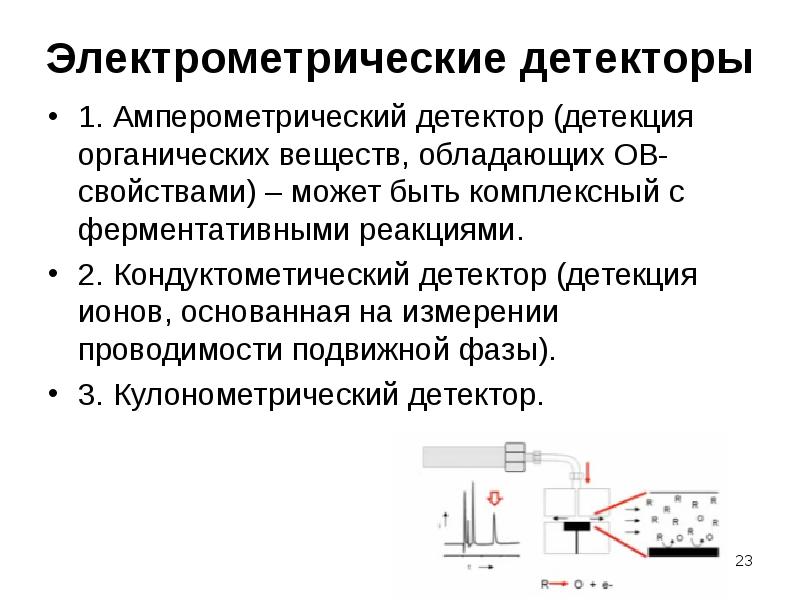

Содержание слайда: Электрометрические детекторы
1. Амперометрический детектор (детекция органических веществ, обладающих ОВ-свойствами) – может быть комплексный с ферментативными реакциями.
2. Кондуктометический детектор (детекция ионов, основанная на измерении проводимости подвижной фазы).
3. Кулонометрический детектор.
№32 слайд


Содержание слайда: Масс-анализаторы
А. непрерывные масс-анализаторы
1. Магнитный и электростатический секторный масс-анализатор (Sector)
2. Квадрупольный масс-анализатор (Quadrupole mass analyzer)
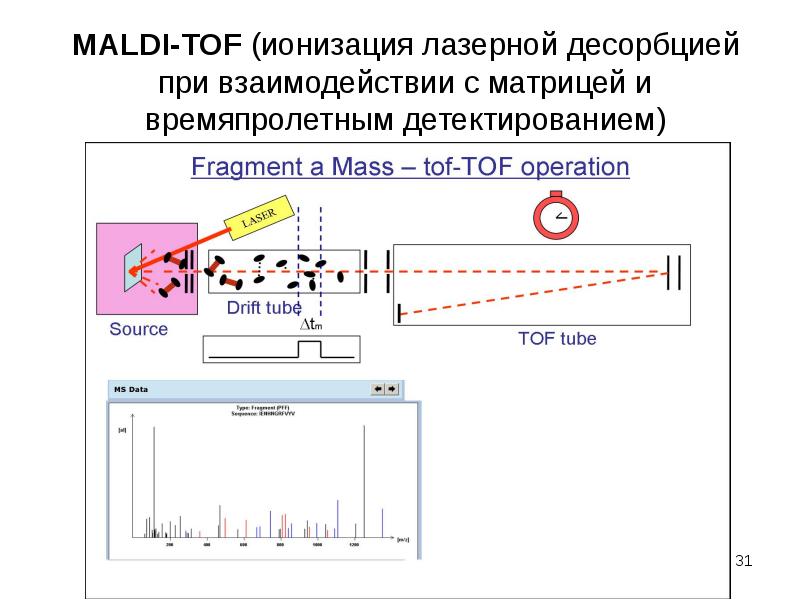
Б. импульсные масс-анализаторы
1. Времяпролётный масс-анализатор (Time-of-flight mass spectrometry)
2. Ионная ловушка (Ion trap)
3. Квадрупольная линейная ловушка (Quadrupole ion trap)
4. Масс-анализатор ионно-циклотронного резонанса с Фурье-преобразованием (Fourier transform ion cyclotron resonance)
5. Орбитрэп (Orbitrap)
№33 слайд


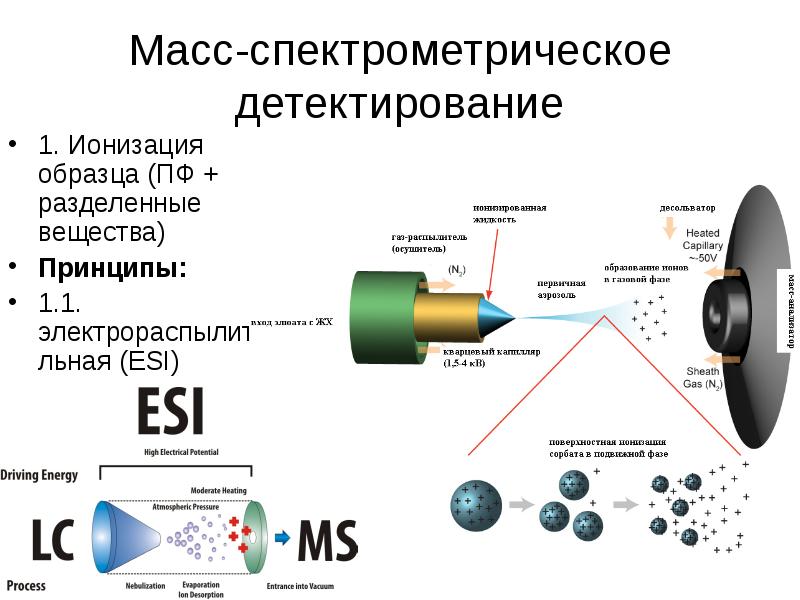
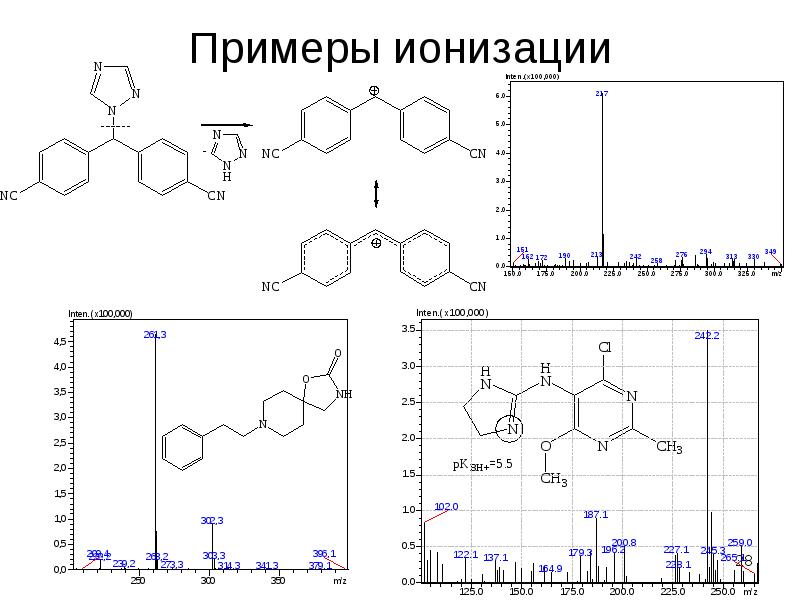
Содержание слайда: Масс-спектрометрическое детектирование
Достоинства:
1. Высочайшая чувствительность органических веществ, биополимеров (10-15 г/пробе).
2. Высокая специфичность детекции (последовательная масс-спектрометрия (дочерних ионов)).
3. Метод сбора информации о структуре молекул (точность установления молярных масс – до 0,0001-0,000001 а.е.м.).
4. Широкий линейный диапазон – 106-107.
5. Наличие баз данных по масс-спектрам огромного числа органических веществ (для ГХ/МС).
6. Основной детектор при проведении биоэквивалентных испытаний, допинг-контроля, судебно-химической экспертизы, исследования метаболизма, генеза БАВ и др.
Недостатки:
1. Сложность и высокая стоимость оборудования и расходных материалов.
2. Необходимо дополнительное обучение непосредственно масс-спектрометрии и интерпретации спектров.
№43 слайд


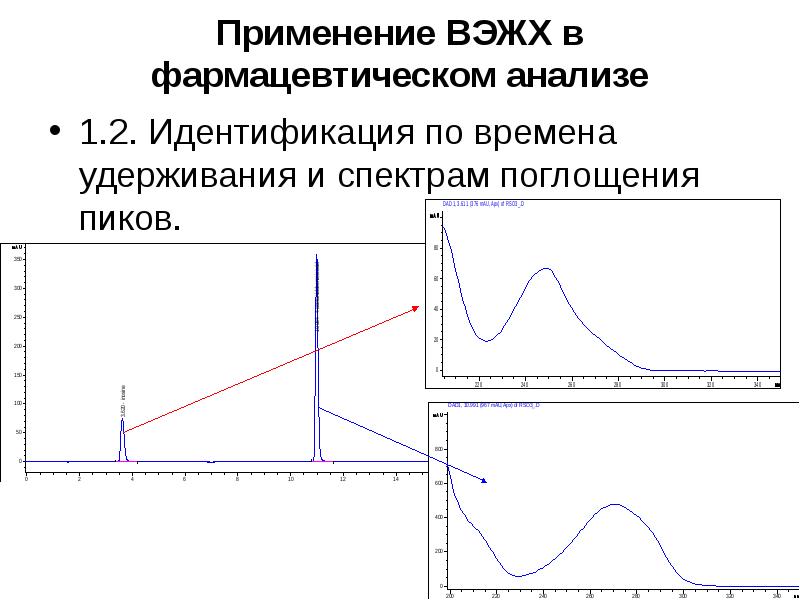
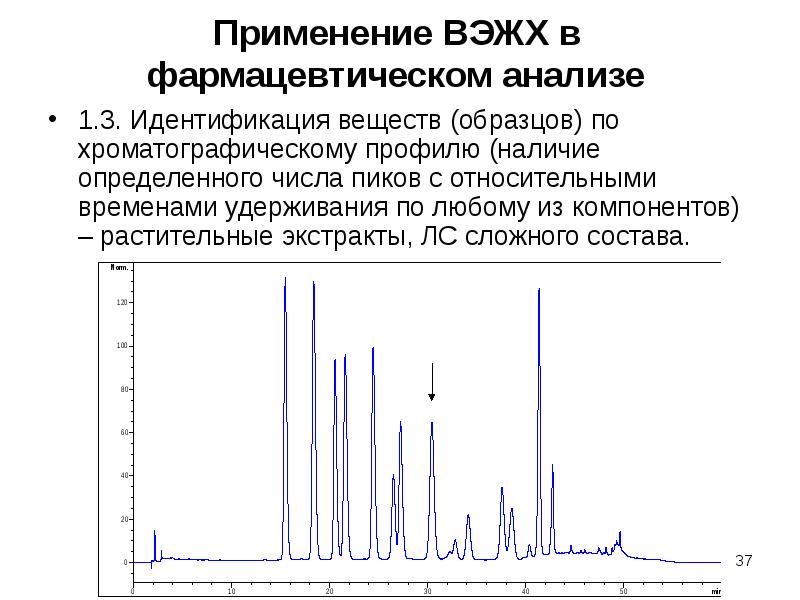
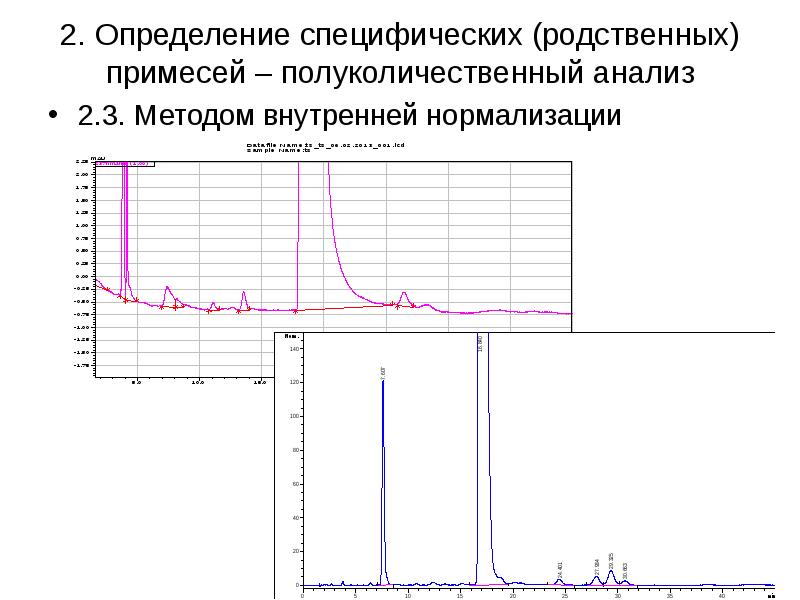
Содержание слайда: Применение ВЭЖХ в фармацевтическом анализе
3. Определение основных показателей готовых лекарственных средств – однородность дозированных единиц, тест «Растворение», количественное определение стабилизаторов, консервантов, красителей и др.
4. Определение пластификаторов в упаковочных материалах.
5. Определение остаточных количеств пестицидов (гербицидов, инсектицидов) в ЛРС, продуктах из ЛРС.
6. Определение остаточных количеств активных фармацевтических ингредиентов на оборудовании (контроль отмывки оборудования), в сточных водах.
№44 слайд


Содержание слайда: Капиллярный электрофорез
Метод капиллярного электрофореза (КЭ) основан на разделении заряженных компонентов сложной смеси в кварцевом капилляре под действием приложенного электрического поля за счёт подачи высокого напряжения к концам капилляра.
Наиболее распространёнными вариантами метода КЭ являются: 1 капиллярный зонный электрофорез (КЗЭ)
2. мицеллярная электрокинетическая хроматография (МЭКХ).
КЗЭ - метод разделения, реализуемый в капиллярах и основанный на различии в электрокинетических подвижностях заряженных частиц как в водных, так и в неводных электролитах.
№45 слайд


Содержание слайда: Капиллярный электрофорез
МЭКХ - вариант капиллярного электрофореза, который позволяет проводить разделение соединений ионного и нейтрального характера при использовании ПАВ. Разделение электро-нейтральных соединений осуществляется благодаря введению в состав ведущего электролита поверхностно-активных веществ - мицеллообразователей. Чаще всего используют анионный ПАВ (например, ДДС) в концентрациях, превышающих критическую концентрацию мицелообразования, что приводит к формированию так называемой «псевдостационарной фазы», и аналиты распределяются между мицеллой и буферным электролитом согласно их гидрофобности.
№46 слайд
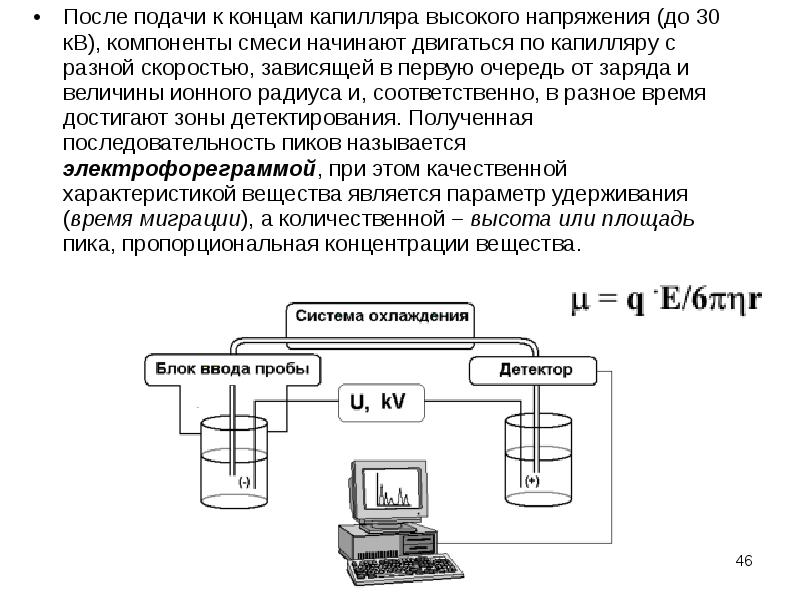

Содержание слайда: После подачи к концам капилляра высокого напряжения (до 30 кВ), компоненты смеси начинают двигаться по капилляру с разной скоростью, зависящей в первую очередь от заряда и величины ионного радиуса и, соответственно, в разное время достигают зоны детектирования. Полученная последовательность пиков называется электрофореграммой, при этом качественной характеристикой вещества является параметр удерживания (время миграции), а количественной – высота или площадь пика, пропорциональная концентрации вещества.
После подачи к концам капилляра высокого напряжения (до 30 кВ), компоненты смеси начинают двигаться по капилляру с разной скоростью, зависящей в первую очередь от заряда и величины ионного радиуса и, соответственно, в разное время достигают зоны детектирования. Полученная последовательность пиков называется электрофореграммой, при этом качественной характеристикой вещества является параметр удерживания (время миграции), а количественной – высота или площадь пика, пропорциональная концентрации вещества.
№47 слайд


Содержание слайда: Основные параметры КЭ
1. Время миграции (tм) - время, необходимое компоненту для прохождения им эффективной длины капилляра (Lэфф) от зоны ввода пробы (начала капилляра) до зоны детектирования;
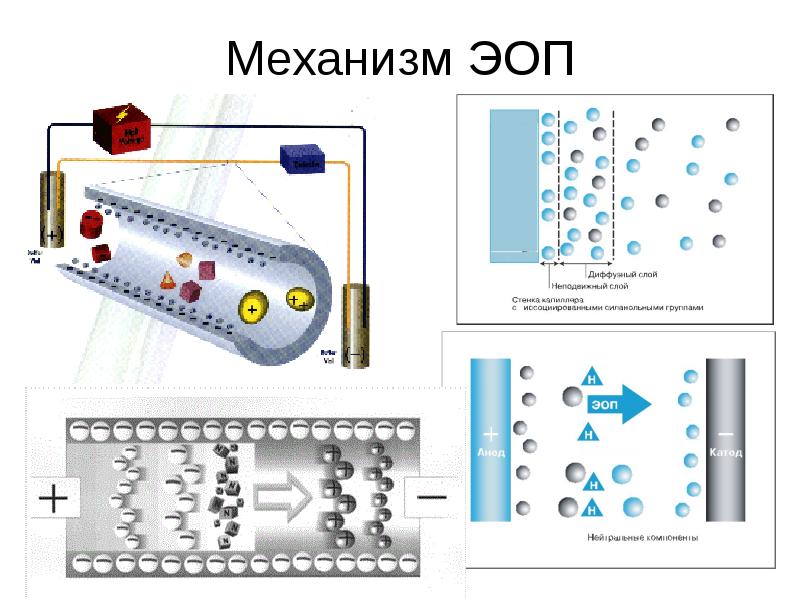
2. Электроосмотический поток (ЭОП) - течение жидкости в капилляре под действием приложенного электрического поля. Время, необходимое жидкости для преодоления эффективной длины капилляра вследствие возникающего ЭОП, называют временем ЭОП (tэоп) и экспериментально определяют из электрофореграммы по времени миграции нейтрального компонента – маркера ЭОП.
3. Подвижность ЭОП (μэоп) - представляет собой отношение скорости ЭОП к напряженности электрического поля. Скорость ЭОП положительна при направлении движения жидкости от входного участка капилляра к детектору и отрицательна при обратном направлении. В свою очередь, скорость ЭОП вычисляют по формуле:
νэоп= Lэфф / tэоп.
№50 слайд


Содержание слайда: Электроосмотический поток
Уникальной особенностью ЭОП является плоский профиль потока в капилляре. Такой профиль выгоден, поскольку уменьшается размывание зон разделяемых веществ. Следует отметить, что эффективность разделения в капиллярном электрофорезе прямо пропорциональна, а время анализа – обратно пропорционально напряжению, приложенному к электродам. Разделение в КЭ может быть выполнено как с положительной, так и отрицательной полярностью электродов. Зная значения рКа для компонентов пробы, можно выбрать буфер с подходящим значением рН и полярность электродов, чтобы образец двигался в сторону детектора. Скорость миграции зависит от напряженности электрического поля, которая обычно составляет 200-400 В/см.
№51 слайд


Содержание слайда: Капилляры для разделения
Подавляющее большинство разделений в КЭ проводят с использованием кварцевых капилляров имеющих внешнее полимерное покрытие, обычно - полиимидное, улучшающее их механическую прочность, и значительно реже полимерные капилляры, например из тефлона. Внутренний диаметр капилляров колеблется в пределах от 25 до 200 микрон, а длина капилляра в зависимости от поставленной задачи – от нескольких сантиметров до 1 метра. Поскольку внешнее полиимидное покрытие непрозрачно в УФ-области, то участок покрытия удаляют и создают окно для УФ-детектирования. Капилляр закрепляется в специальной пластиковой кассете.
Надежное термостатирование капилляра является основным условием получения воспроизводимых времен миграции определяемого соединения и площади результирующего пика, что важно для количественного анализа. Используют капилляры с внутренним диаметром 25-50 мкм, что является компромиссным решением между достаточно высокой чувствительностью и эффективностью разделения.
№52 слайд


Содержание слайда: Ввод образца
Проба может быть введена в капилляр электрофоретическим, электрокинетическим или вытеснительным способом. Объем вводимой пробы не превышает 2 нл, относительное стандартное отклонение составляет 0,03-0,04. При электрофоретическом вводе пробы, к концам капилляра прикладывается высокое напряжение на фиксированный промежуток времени, при этом входной конец капилляра погружают в раствор пробы. Ионы пробы перемещаются в капилляр пропорционально их электрофоретической подвижности. В случае электрокинетического ввода, компоненты пробы попадают в капилляр за счет комбинации электроэндоосмотического давления и электрофоретической подвижности. Вытеснительный ввод пробы достигается либо за счет создания избыточного внешнего давления инертного газа, приложенного к резервуару с образцом, либо за счет создания вакуума на выходе из капилляра или путем изменения уровня/высоты резервуара, содержащего образец, относительно резервуара с буферным раствором на выходе из капилляра (так называемое гравитационное введение пробы).
Скачать все slide презентации Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение) одним архивом:
Похожие презентации
-
 Хроматографические методы анализа и их применение для контроля качества лекарственных средств
Хроматографические методы анализа и их применение для контроля качества лекарственных средств -
 Спектральные методы анализа и их применение для контроля качества лекарственных средств
Спектральные методы анализа и их применение для контроля качества лекарственных средств -
 Методы анализа лекарственных средств
Методы анализа лекарственных средств -
 Применение методов проточной цитофлуорометрии для научных исследований
Применение методов проточной цитофлуорометрии для научных исследований -
 Роль физико-химических методов анализа потребительских товаров при установлении их безопасности и качества
Роль физико-химических методов анализа потребительских товаров при установлении их безопасности и качества -
 Основы рентгеноспектрального анализа и его применение для определения структурных характеристик молекул
Основы рентгеноспектрального анализа и его применение для определения структурных характеристик молекул -
 Анализ качества шоколада методом рентгеновской дифракции
Анализ качества шоколада методом рентгеновской дифракции -
 Сущность и применение метода импеданса с помощью прибора «БакТрак» для определения различных групп микроорганизмов
Сущность и применение метода импеданса с помощью прибора «БакТрак» для определения различных групп микроорганизмов -
 Оптические методы и приборы контроля качества продукции
Оптические методы и приборы контроля качества продукции -
 Физико-химические методы в анализе лекарственных веществ
Физико-химические методы в анализе лекарственных веществ