Презентация Дисперсные системы. Способы получения и очистки коллоидных систем. (Лекция 5) онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Дисперсные системы. Способы получения и очистки коллоидных систем. (Лекция 5) абсолютно бесплатно. Урок-презентация на эту тему содержит всего 39 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Дисперсные системы. Способы получения и очистки коллоидных систем. (Лекция 5)
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:39 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:542.50 kB
- Просмотров:115
- Скачиваний:5
- Автор:неизвестен
Слайды и текст к этой презентации:
№1 слайд


Содержание слайда: ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 5. Дисперсные системы. Способы получения и очистки коллоидных систем.
Основные понятия. Классификация дисперсных систем.
Коллоидная частица: строение мицеллы.
3. Методы получения коллоидных растворов.
4. Методы очистки коллоидных растворов.
№2 слайд


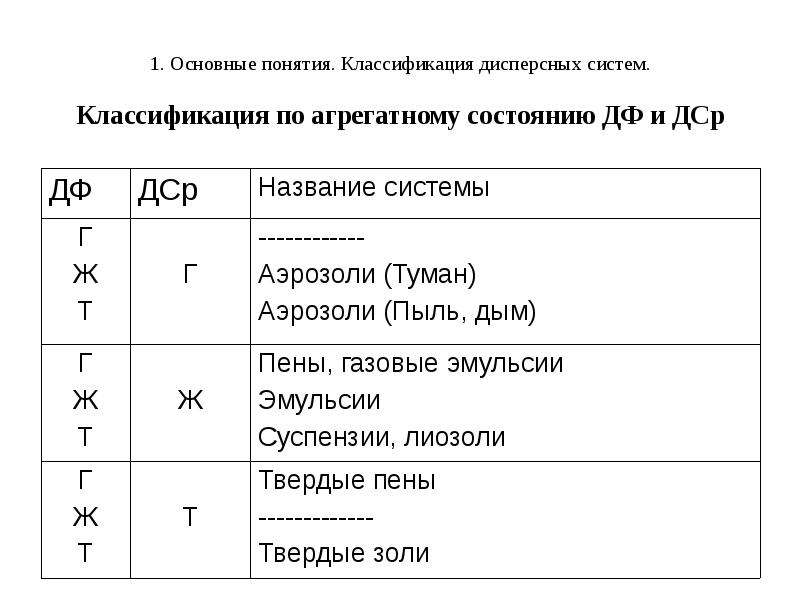
Содержание слайда: 1. Основные понятия. Классификация дисперсных систем.
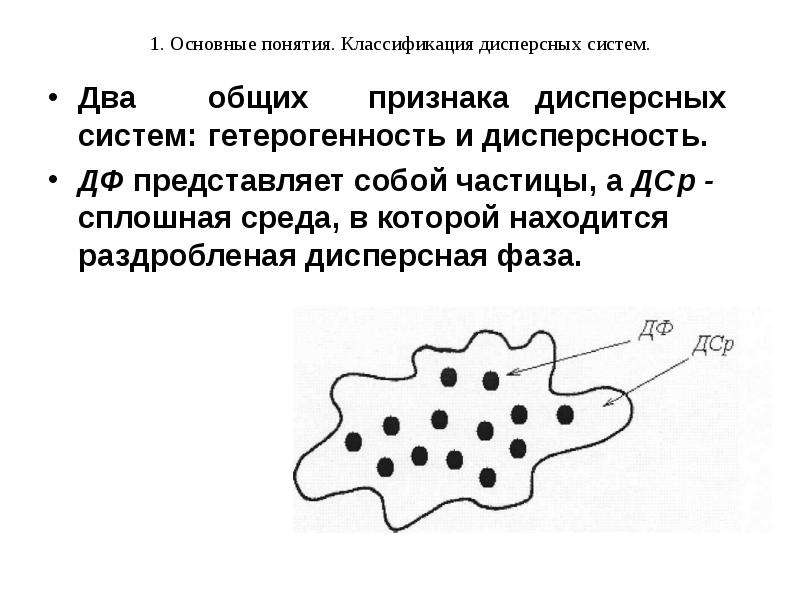
Дисперсной системой называется система, в которой одно вещество в более или менее раздробленном (дисперсном) состоянии равномерно распределено в массе другого вещества.
Раздробленное вещество в этом случае называется дисперсной фазой (ДФ), а среду, в которой оно распределено – дисперсионной средой (ДСр).
№4 слайд


Содержание слайда: 1. Основные понятия. Классификация дисперсных систем.
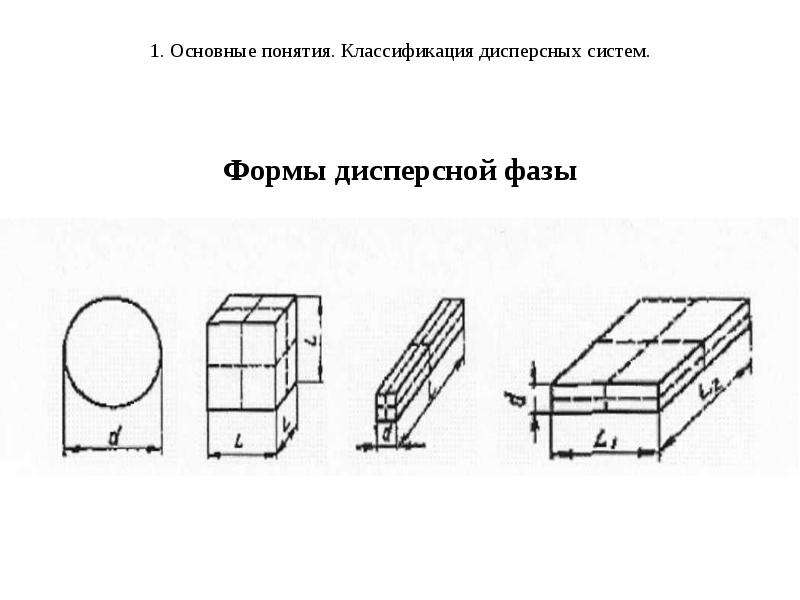
Количественные характеристики ДФ
Поперечный размер частиц ДФ (для сферических частиц это диаметр сферы d, для кубических частиц - ребро куба l, м-1; см-1) или дисперсность (D = 1/d, м-1, см-1).
Удельная поверхность Syд - это межфазная поверхность, приходящаяся на единицу объема ДФ (V) или ее массы (т).
№11 слайд


Содержание слайда: 1. Основные понятия. Классификация дисперсных систем.
Классификация по степени связи ДС и ДФ:
системы со слабым взаимодействием между ДФ и ДС называют лиофобными коллоидами (золями), с сильным взаимодействием – лиофильными.
Если ДС является вода, то системы соответственно называются гидрофобными и гидрофильными.
№12 слайд


Содержание слайда: 1. Основные понятия. Классификация дисперсных систем.
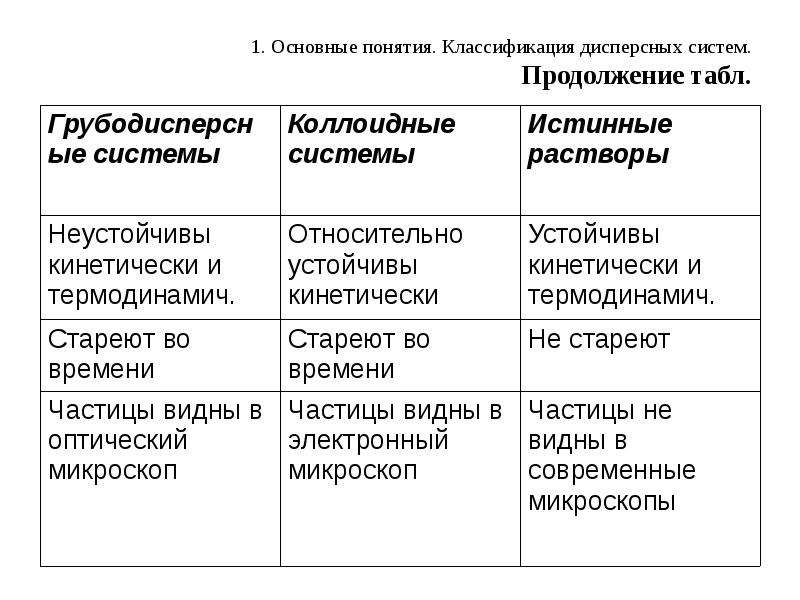
Лиофильные системы образуются самопроизвольно, следовательно, термодинамически устойчивы. Как правило, они представляют собой растворы полимерных органических соединений (белки, полисахариды).
Лиофобные системы являются термодинамически неустойчивыми. Они образуются из неорганических соединений (солей, оснований).
№13 слайд


Содержание слайда: 1. Основные понятия. Классификация дисперсных систем.
Классификация по взаимодействию частиц:
Свободнодисперсные (бесструктурные);
Связаннодисперсные (структурированные).
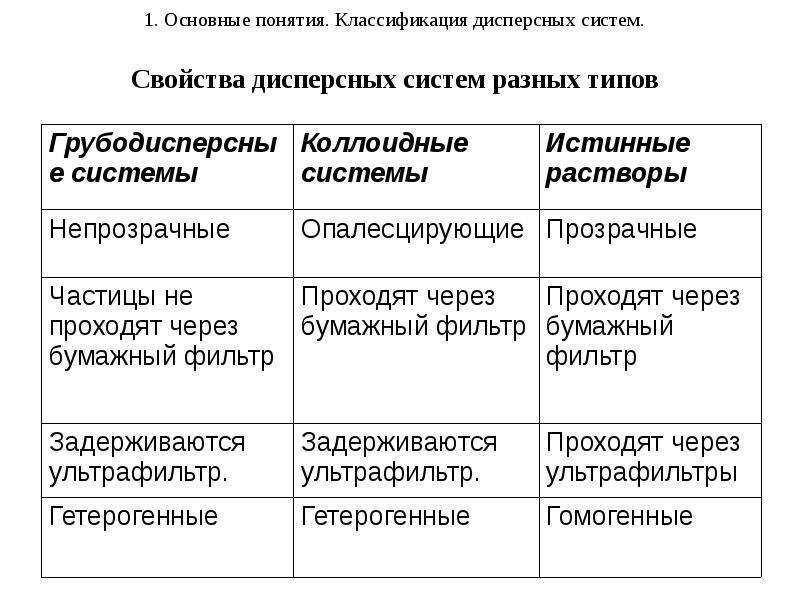
Золь – бесструктурный коллоидный раствор, в котором частицы ДФ слабо взаимодействуют между собой и свободно передвигаются друг относительно друга (например, золь серебра – колларгол). По внешнему виду золи напоминают истинные растворы.
№14 слайд


Содержание слайда: 1. Основные понятия. Классификация дисперсных систем.
Гель – структурированный коллоидный раствор, в котором частицы ДФ связаны между собой с образованием пространственной структуры типа каркасов. В них коллоидные частицы малоподвижны и способны совершать только колебательные движения. По внешнему виду гели желеобразны.
№15 слайд


Содержание слайда: 1. Основные понятия. Классификация дисперсных систем.
Особое место в классификации ДС занимают ВМС.
По многим свойствам их можно отнести к истинным растворам: они гомогенны, устойчивы, обратимы.
Однако размеры молекул ВМС настолько велики, что соизмеримы с размерами коллоидных частиц, что обуславливает проявление свойств коллоидных растворов: малая скорость диффузии, характерные кинетические и электрокинетические свойства, структурообразование и т.д.
№16 слайд


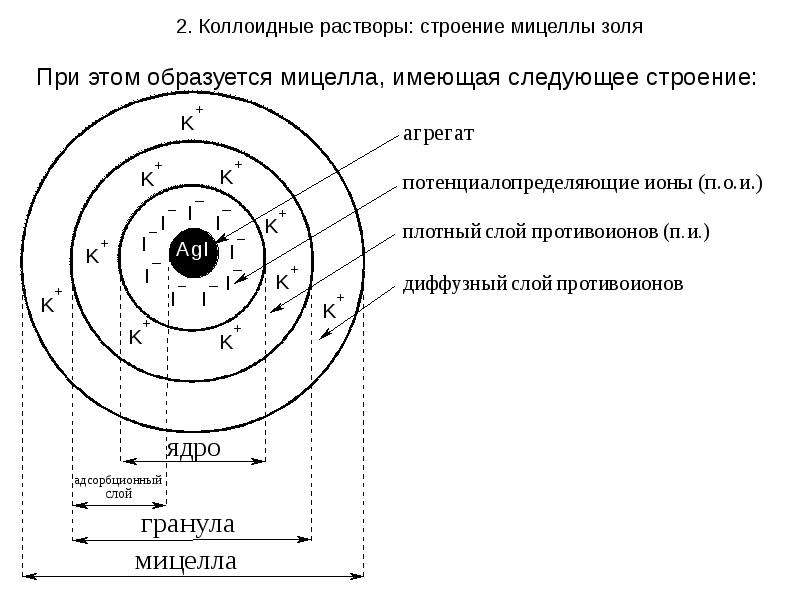
Содержание слайда: 2. Коллоидные растворы: строение мицеллы золя
Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь состоит из двух частей:
Мицелл - частиц ДФ. Они имеют сложную структуру, которая зависит от условий получения золей.
Интермицеллярной (т. е. межмицеллярной) жидкости - ДСр, разделяющей мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, являющиеся стабилизаторами коллоидной системы.
№19 слайд


Содержание слайда: 2. Коллоидные растворы: строение мицеллы золя
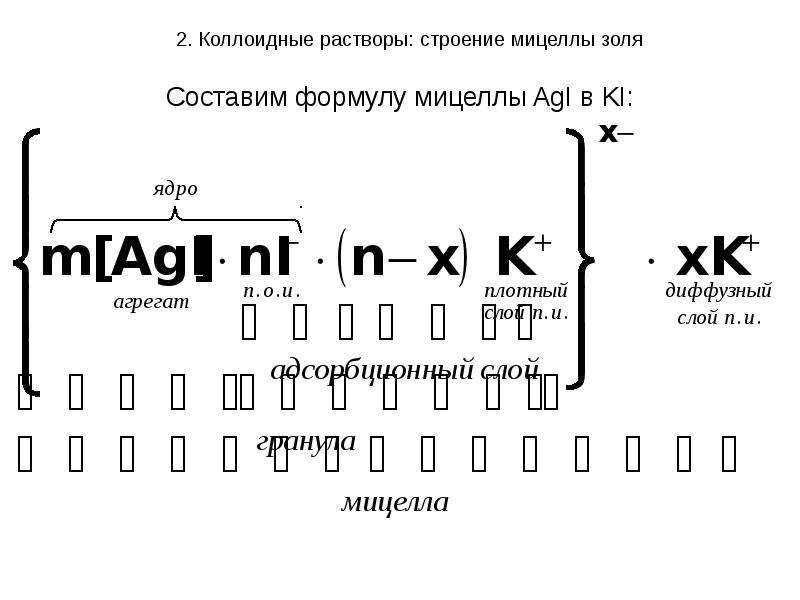
Осадок AgI является агрегатом мицеллы.
На твердой кристаллической поверхности осадка в соответствии с правилом Панета-Фаянса будут адсорбироваться ионы I-, достраивая кристаллическую решетку и сообщая частицам отрицательный заряд.
Ионы I- называются потенциалопределяющими.
Агрегат и потенциалопределяющие ионы составляют
ядро мицеллы.
К отрицательному заряду будут притягиваться противоионы K+, образуя плотный слой противоионов.
№20 слайд


Содержание слайда: 2. Коллоидные растворы: строение мицеллы золя
Потенциалопределяющие ионы и противоионы плотного слоя вместе образуют адсорбционный слой.
Адсорбционный слой вместе с агрегатом составляют гранулу (или частицу). Гранула заряжена, её заряд определятся знаком и величиной заряда потенциалопределяющих ионов.
Часть противоионов, не вошедших в адсорбционный слой, образуют диффузный слой.
Гранула и диффузный слой составляют мицеллу.
Мицелла таким образом электронейтральна.
№22 слайд


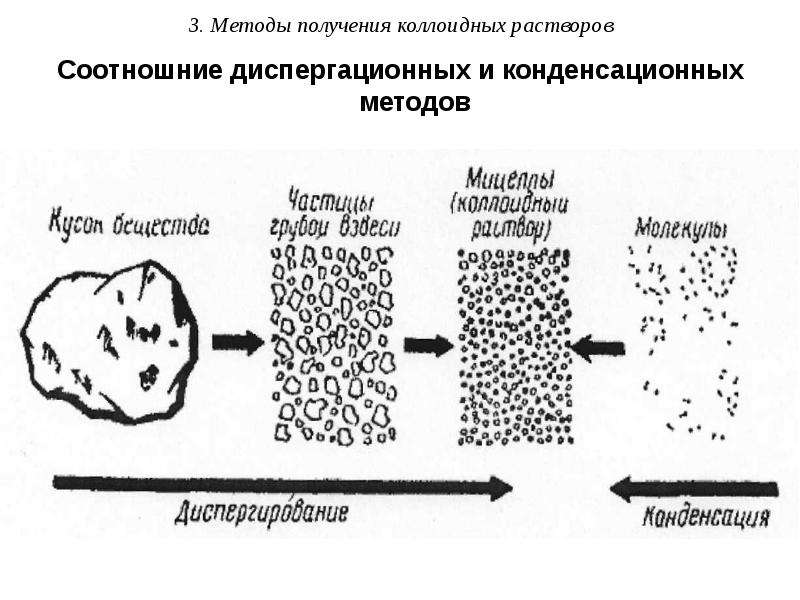
Содержание слайда: 3. Методы получения коллоидных растворов
Коллоидные системы занимают промежуточное положение между истинными растворами и грубодисперсными системами, что обусловливает возможность их получения диспергированием крупных частичек или конденсацией молекул. Соответственно методы получения коллоидных систем делят на диспергационные и конденсационные.
№24 слайд


Содержание слайда: 3. Методы получения коллоидных растворов
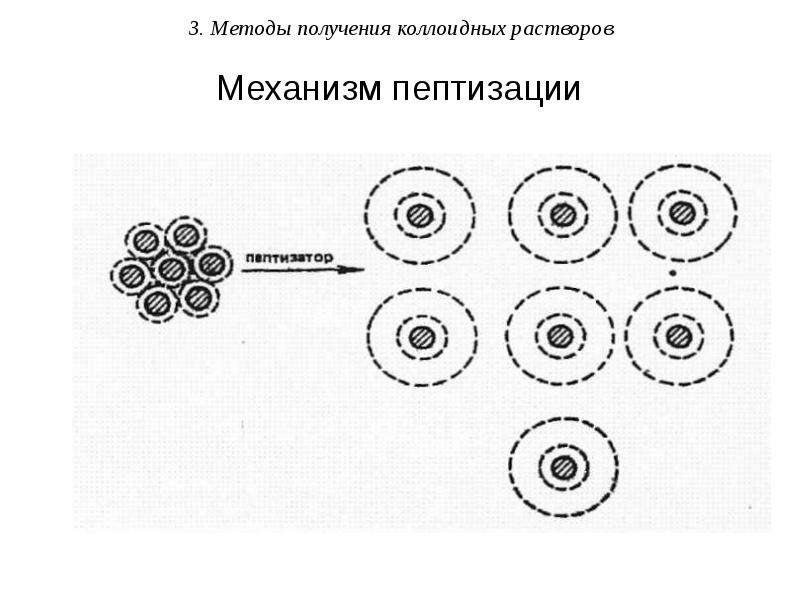
Методы диспергирования (от лат. – измельчать) – получение частиц ДФ путем дробления крупных частиц на более мелкие. Применяют механическое дробление (с помощью шаровых или коллоидных мельниц), ультразвуковое (под действием ультразвука), электрическое (при использовании электродов) и химическое диспергирование – пептизация (заключается в химическом воздействии на осадок).
№26 слайд


Содержание слайда: 3. Методы получения коллоидных растворов
Примером пептизации может служить переход в золь свежеполученного и промытого водой осадка гидроксида железа(III) при добавлении к нему небольших количеств раствора хлорида железа(III).
При этом частицы осадка Fe(OH)3 избирательно адсорбируют ионы Fe3+, которые сообщают частицам положительный электрический заряд. Вследствие этого между частицами возникают силы электростатического отталкивания и они переходят во взвешенное состояние – золь.
№28 слайд


Содержание слайда: 3. Методы получения коллоидных растворов
Конденсационные методы (от лат. – укрупнять) – получение частиц ДФ путем объединения атомов, молекул, ионов. Различают физическую и химическую конденсацию.
Физическая конденсация - чаще всего это метод замены растворителя. Сначала готовят истинный раствор вещества в летучем растворителе (например, канифоль в спирте) и добавляют к жидкости, в которой вещество нерастворимо (вода). В результате происходит резкое понижение растворимости и молекулы вещества конденсируются в частицы коллоидных размеров.
№29 слайд


Содержание слайда: 3. Методы получения коллоидных растворов
Химическая конденсация – для получения коллоидных растворов используют любые реакции, в результате которых образуются малорастворимые соединения (реакции обмена, гидролиза, восстановления и др.).
Чтобы в ходе реакции образовался коллоидный раствор, а не истинный раствор или осадок, необходимо соблюдение, по крайней мере, трех условий:
№30 слайд


Содержание слайда: 3. Методы получения коллоидных растворов
чтобы вещество ДФ было нерастворимо в ДСр;
чтобы скорость образования зародышей кристаллов ДФ была гораздо больше, чем скорость роста кристаллов; это условие выполняется обычно тог да, когда концентрированный раствор одного компонента вливается в сильно разбавленный раствор другого компонента при интенсивном перемешивании;
чтобы одно из исходных веществ было взято в избытке, именно оно является стабилизатором.
№32 слайд


Содержание слайда: 4. Методы очистки коллоидных растворов
Коллоидные растворы, как и истинные, хорошо фильтруются через бумажный пористый фильтр, но, в отличие от истинных, не проходят через полупроницаемые мембраны. На этом основана очистка коллоидных растворов от низкомолекулярных веществ (диализ, фильтрация, ультрацентрифугирование).
№33 слайд


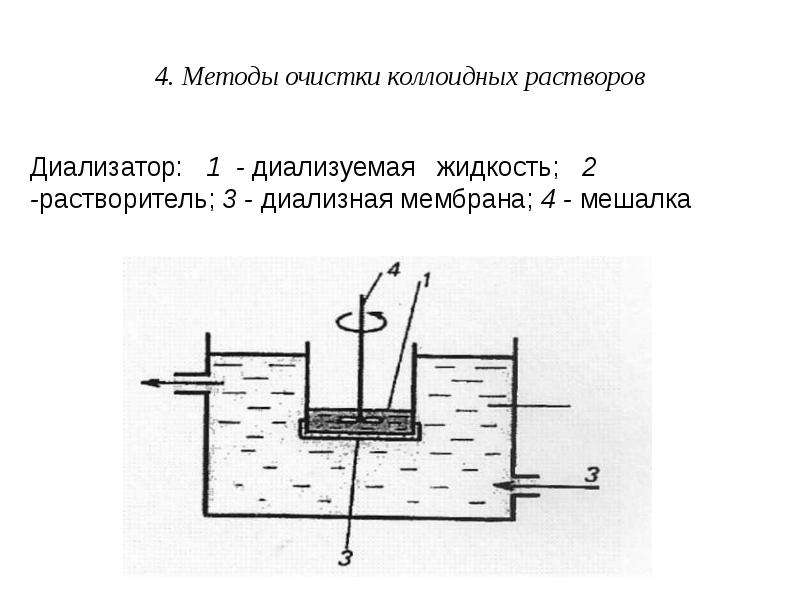
Содержание слайда: 4. Методы очистки коллоидных растворов
Диализ проводят с помощью прибора - диализатора. Он состоит из двух сосудов, отделенных полупроницаемой мембраной, способной пропускать молекулы и ионы низкомолекулярных веществ. Во внутренний сосуд наливается раствор золя, во внешнем – циркулирует растворитель (как правило, вода). Примеси удаляются через мембрану из раствора золя в растворитель.
Для ускорения процесса применяют электродиализ.
№35 слайд


Содержание слайда: 4. Методы очистки коллоидных растворов
С помощью компенсационного диализа можно количественно определить содержание низкомолекулярных веществ в биологических жидкостях. Сущность этого вида диализа заключается в том, что жидкость в диализаторе омывается не чистым растворителем, а растворами с различной концентрацией определяемого вещества. Концентрация низкомолекулярного вещества во внешнем растворе при диализе не меняется лишь в том случае, если она равна концентрации этого вещества в растворе золя.
№36 слайд


Содержание слайда: 4. Методы очистки коллоидных растворов
По принципу компенсационного диализа работает аппарат «искусственная почка», применяемый при ОПН.
Аппарат подключают к системе кровообращения больного, кровь под давлением протекает между двумя мембранами, омываемыми снаружи физраствором. При этом токсичные вещества поступают в физраствор, что способствует очищению крови от продуктов обмена и распада тканей (мочевины, креатина, ионов калия и др.).
№37 слайд


Содержание слайда: 4. Методы очистки коллоидных растворов
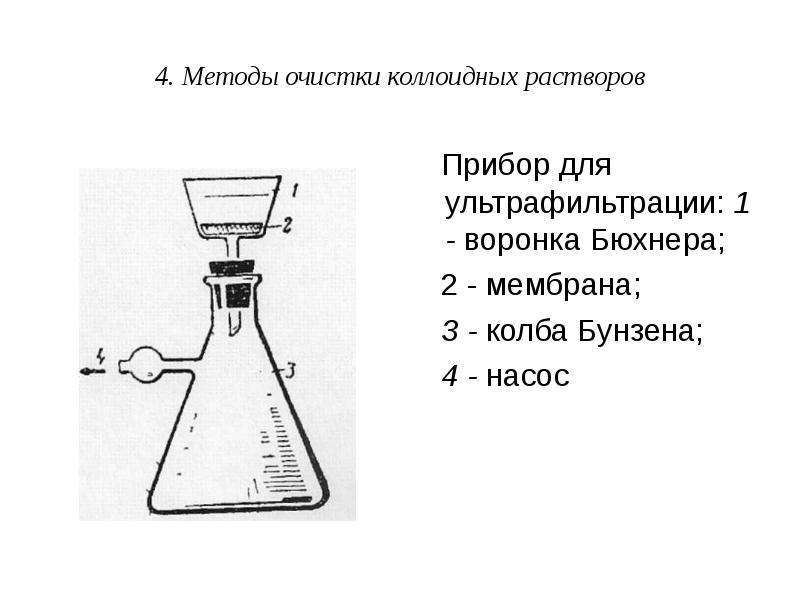
Для очистки коллоидных растворов от грубодисперсных частиц проводят фильтрование через обычные бумажные фильтры. Грубодисперсные частицы задерживаются на фильтре.
Для отделения ДФ от ДСр, применяют ультрафильтрацию. При этом используют специальные фильтры, не пропускающие коллоидные частицы или макромолекулы. Как правило, ультрафильтрацию проводят под давлением.
Скачать все slide презентации Дисперсные системы. Способы получения и очистки коллоидных систем. (Лекция 5) одним архивом:
Похожие презентации
-
 Коллоидные растворы. Методы получения и очистки коллоидных растворов. Строение мицеллы гидрофобных систем. (Часть 1)
Коллоидные растворы. Методы получения и очистки коллоидных растворов. Строение мицеллы гидрофобных систем. (Часть 1) -
 Классификация дисперсных систем. Электрокинетические свойства и устойчивость коллоидных растворов. (Лекция 8)
Классификация дисперсных систем. Электрокинетические свойства и устойчивость коллоидных растворов. (Лекция 8) -
 Дисперсные (коллоидные) системы и растворы
Дисперсные (коллоидные) системы и растворы -
 Молекулярно-кинетические свойства дисперсных систем. Лекция 09
Молекулярно-кинетические свойства дисперсных систем. Лекция 09 -
 Дисперсные системы: получение и свойства. Часть 2
Дисперсные системы: получение и свойства. Часть 2 -
 Различные виды дисперсных систем. Аэрозоли; эмульсии; коллоидные ПАВ; ВМС
Различные виды дисперсных систем. Аэрозоли; эмульсии; коллоидные ПАВ; ВМС -
 Физико-химия дисперсных систем. Коллоидные растворы
Физико-химия дисперсных систем. Коллоидные растворы -
 Дисперсные системы. Свойства коллоидных растворов
Дисперсные системы. Свойства коллоидных растворов -
 Поверхностные явления и дисперсные системы (коллоидная химия)
Поверхностные явления и дисперсные системы (коллоидная химия) -
 Физическая химия дисперсных систем. Коллоидные растворы
Физическая химия дисперсных систем. Коллоидные растворы