Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
19 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
403.50 kB
Просмотров:
254
Скачиваний:
4
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
№2 слайд
Содержание слайда: Содержание
Электролитическая диссоциация воды
Ионное произведение воды
Водородный показатель (рН)
Определение рН водных растворов
Буферные растворы
№3 слайд
Содержание слайда: Диссоциация воды
Упрощенная запись уравнения диссоциации воды :
H2O H+ + OH
Константа диссоциации воды
при 298 К
При повышении температуры возрастают концентрации
ионов H+ и OH
№4 слайд
Содержание слайда: Ионное произведение воды Kw
при Т=298 К
При повышении температуры Kw увеличивается
№5 слайд
Содержание слайда: Концентрации ионов H+ и OH−
Расчет [H+] и [OH-] в 0,01 М растворе NaOH
NaOH = Na+ + OH-
№6 слайд
Содержание слайда: Водородный показатель рН
pH = -lg [H+]
Расчет рН 0,01 М раствора соляной кислоты
HCl = H+ + Cl
Расчет рН 0,1 М раствора гидроксида калия
КОН = К+ + ОН-
№7 слайд
Содержание слайда: Расчет рН 0,01 М раствора HBrO
HBrO - слабый электролит
HBrO H+ + BrO−
[H+] = [BrO−]
№8 слайд
Содержание слайда: Расчет рН 0,01 М раствора аммиака
Гидрат аммиака - слабый электролит
№9 слайд
Содержание слайда: Количественные
характеристики среды
Нейтральная среда
Кислая среда
Щелочная среда
№10 слайд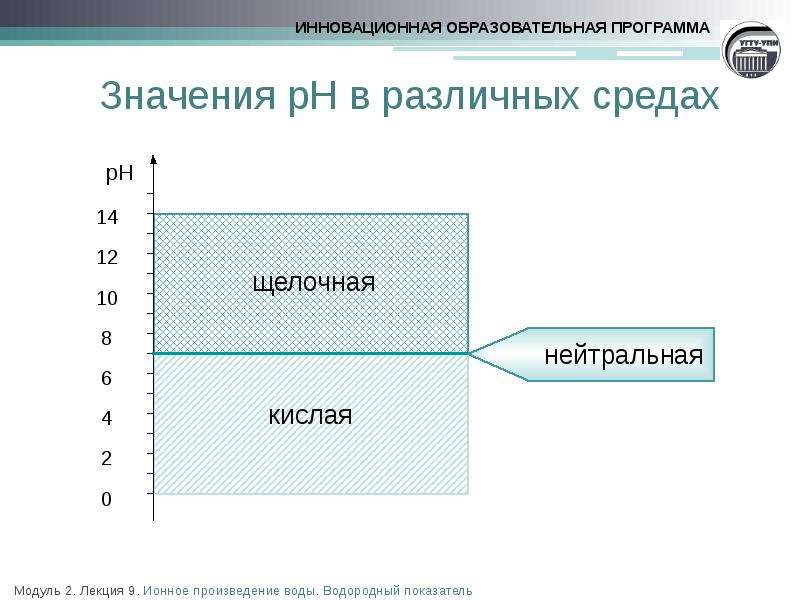
Содержание слайда: Значения рН в различных средах
№11 слайд
Содержание слайда: Схема измерения рН раствора
№12 слайд
Содержание слайда: Прибор для измерения рН
№13 слайд
Содержание слайда: Индикатор фенолфталеин
преобладает
молекулярная форма
№14 слайд
Содержание слайда: Индикатор метиловый оранжевый
преобладает
молекулярная форма
№15 слайд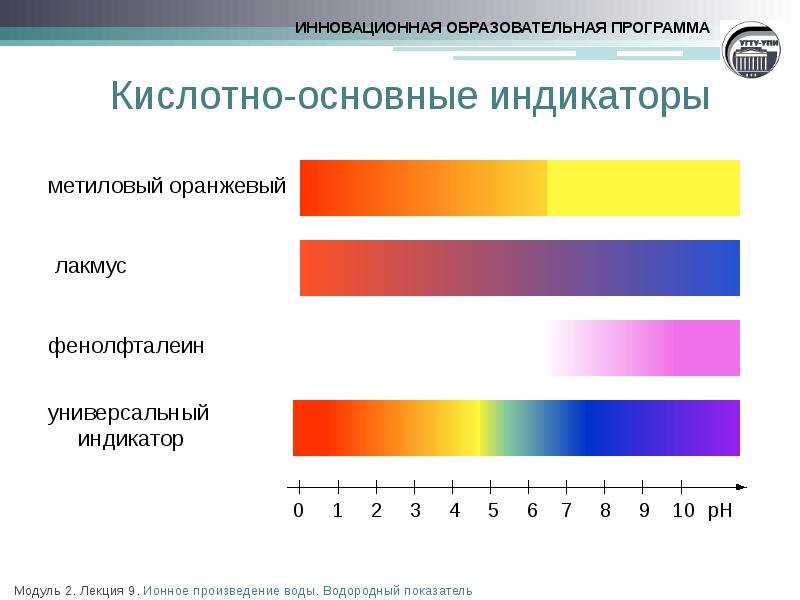
Содержание слайда: Кислотно-основные индикаторы
№16 слайд
Содержание слайда: Ацетатный буферный раствор -
– смесь уксусной кислоты и ее соли
СН3СООН СН3СОО− + Н+
СН3СООNa = СН3СОО− + Na+
[CH3COOH] ≈ Cкислоты
[CH3COO−] ≈ Ссоли
при разбавлении
при добавлении сильной кислоты
рН не изменяется CH3COO- + H+ = CH3COOH
при добавлении щелочи
OH‑ + CH3COOH = H2O + CH3COO‑
№17 слайд
Содержание слайда: Аммиачный буферный раствор –
– водный раствор аммиака с добавлением соли аммония
NН4Cl = NH4+ + Cl−
при разбавлении
при добавлении сильной кислоты
pH не изменяется + H+ =
при добавлении щелочи
=
№18 слайд
Содержание слайда: Заключение
Электропроводность чистой воды обусловлена ее автопротолизом. Вода проявляет свойства слабого электролита
Для воды и разбавленных водных растворов значение ионного произведения воды при данной температуре является постоянной величиной
Водородный показатель рН является количественной характеристикой кислотности или щелочности среды
Определение рН проводят с помощью приборов (рН-метров); для приблизительной оценки рН используют кислотно-основные индикаторы
Буферные растворы применяют для создания и сохранения постоянства значений рН раствора в определенном диапазоне
№19 слайд
Содержание слайда: Рекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш. шк., 1994
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия, 2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М.: Академия, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб.: Лань, 2000




























