Презентация Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. Лекция 2 онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. Лекция 2 абсолютно бесплатно. Урок-презентация на эту тему содержит всего 125 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. Лекция 2
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:125 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:12.94 MB
- Просмотров:112
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№6 слайд


Содержание слайда: Кислоты Бренстеда.
Кислоты Бренстеда.
Кислота Бренстеда – вещество, способное отдавать протоны, т.е. донор H+.
В зависимости от природы элемента, с которым связан H , кислоты делятся на:
C – H (углеводороды и их производные: алканы, алкены, алкины, арены)
N – H (амины, амиды, имины)
S – H (тиоспирты)
O – H (спирты, фенолы, карбоновые кислоты)
H и атом элемента называют кислотным центром.
№7 слайд
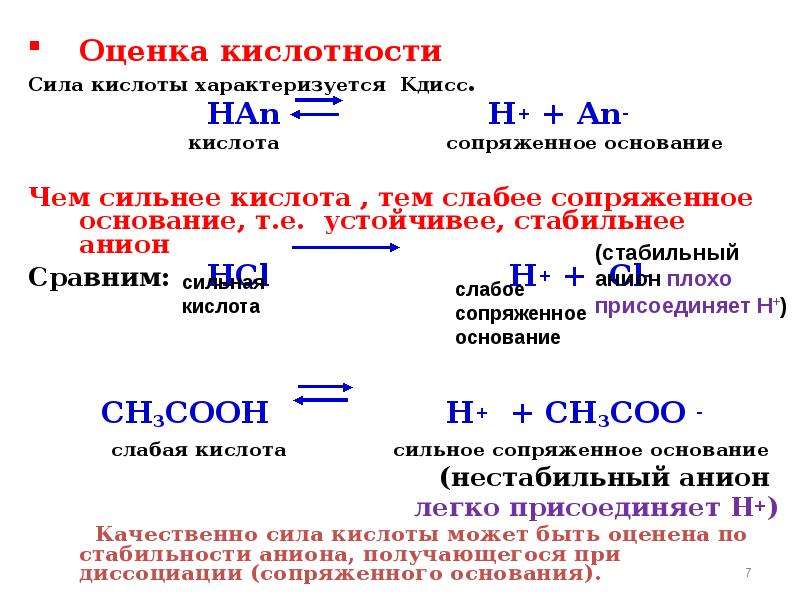

Содержание слайда: Оценка кислотности
Оценка кислотности
Сила кислоты характеризуется Kдисс.
HAn H+ + An-
кислота сопряженное основание
Чем сильнее кислота , тем слабее сопряженное основание, т.е. устойчивее, стабильнее анион
Сравним: HCl H+ + Cl-
CH3COOH H+ + CH3COO -
слабая кислота сильное сопряженное основание
(нестабильный анион
легко присоединяет Н+)
Качественно сила кислоты может быть оценена по стабильности аниона, получающегося при диссоциации (сопряженного основания).
№12 слайд


Содержание слайда: В молекуле барбитуровой кислоты существует С-Н кислотный центр (в СН2 – группе ). Благодаря влиянию двух соседних функциональных групп,обладающих –I эффектом, атом водорода становится подвижным.
В молекуле барбитуровой кислоты существует С-Н кислотный центр (в СН2 – группе ). Благодаря влиянию двух соседних функциональных групп,обладающих –I эффектом, атом водорода становится подвижным.
№17 слайд


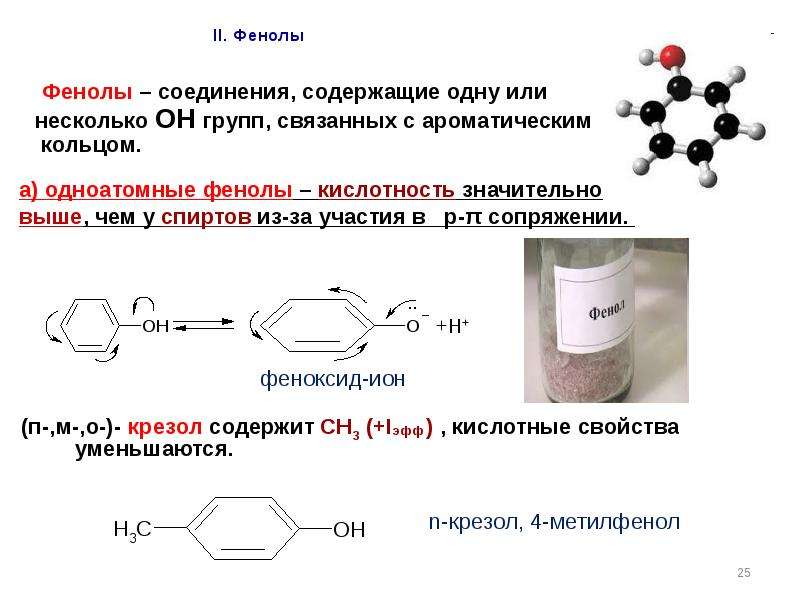
Содержание слайда: Кислотные свойства спиртов, фенолов, тиолов
Кислотные свойства спиртов, фенолов, тиолов
Спирт можно рассматривать как углеводород, в котором один или более атомов H замещены на OH группы.
Спирты классифицируются
по природе радикала (по характеру радикала): предельные, непредельные - алифатические, алициклические, ароматические
по характеру атома C с которым связана OH – группа: первичные, вторичные, третичные
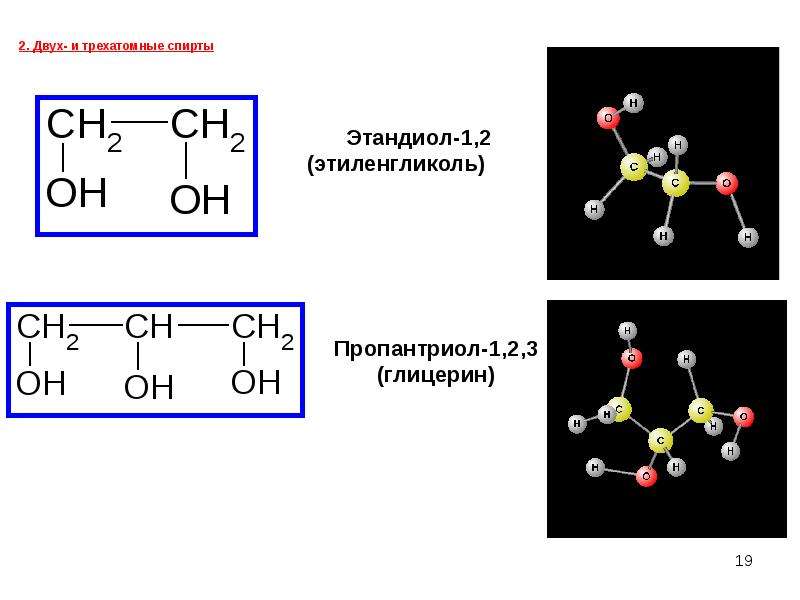
по количеству OH: одноатомные, двухатомные, трехатомные, многоатомные
№18 слайд


Содержание слайда: I. Спирты
I. Спирты
1. Одноатомные спирты – очень слабые кислоты
C2H5OH + Na C2H5ONa + 1/2 H2
этилат Na
или этоксид Na
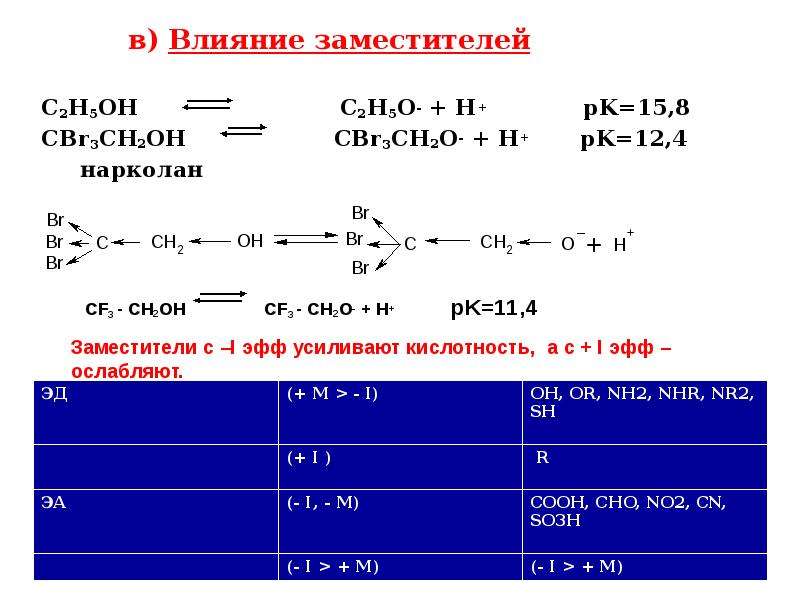
Кислотность спиртов уменьшается в следующей последовательности:
CH3
CH3OH > CH3 - CH2OH > CH3 – CH - CH3 > CH3 – C - CH3
OH OH
метанол этанол пропанол-2 2-метилпропанол-2
pK =15,2 pK =15,8 pK =16,9 pK =19,2
ROH + NaOH , но C2H5ONa + H2O C2H5OH + NaOH
№33 слайд


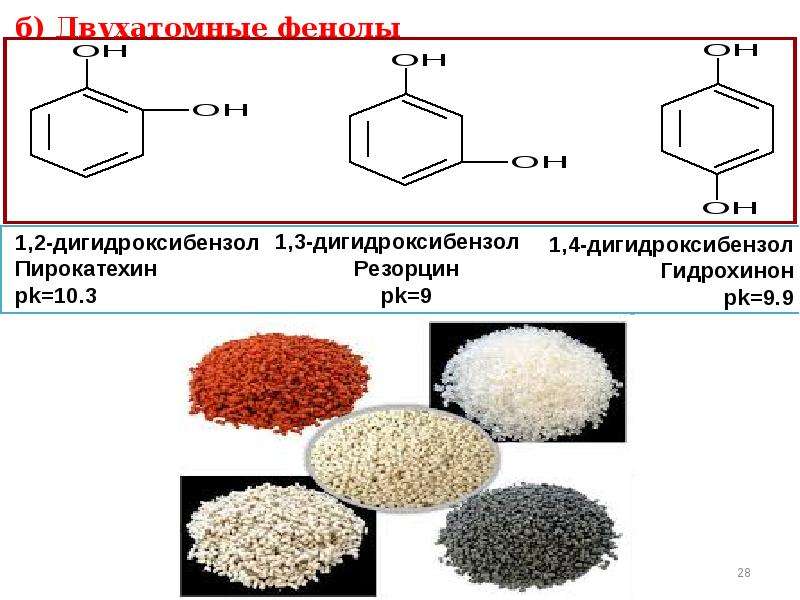
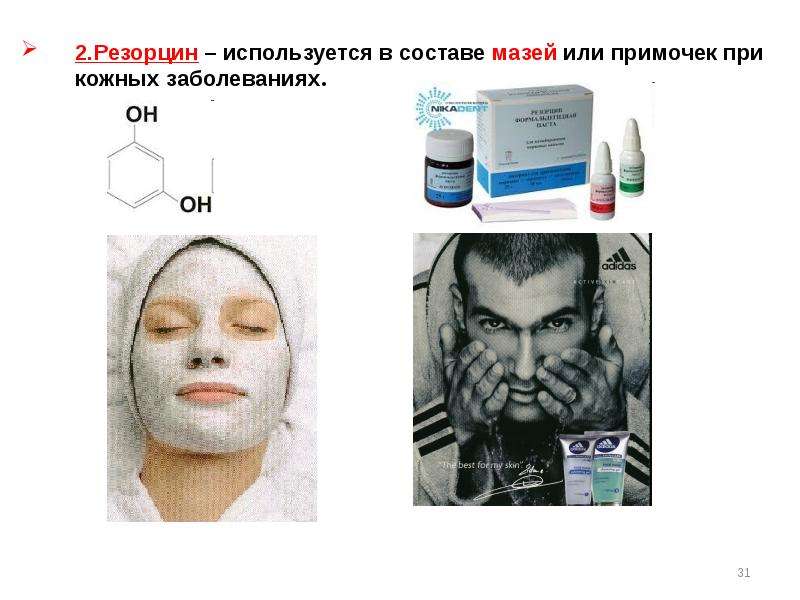
Содержание слайда: Гидрохинон – биологическая роль связана с окислительно-восстановительными свойствами,окисленная форма (хинон) и восстановленная (гидрохинон) входят в состав убихинонов.
Гидрохинон – биологическая роль связана с окислительно-восстановительными свойствами,окисленная форма (хинон) и восстановленная (гидрохинон) входят в состав убихинонов.
№36 слайд


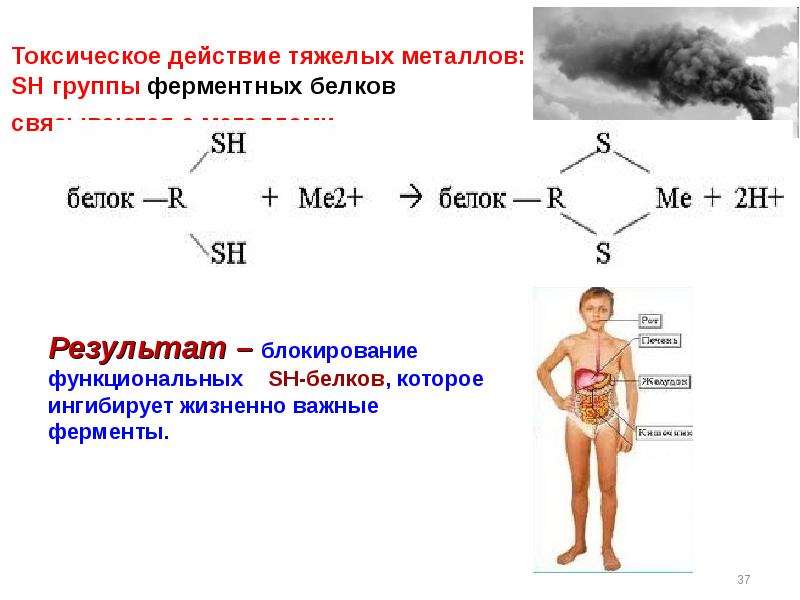
Содержание слайда: Особенность тиолов – образование труднорастворимых соединений с оксидами, гидроксидами, солями тяжелых металлов (Hg, Pb, Sb, Bi).
Особенность тиолов – образование труднорастворимых соединений с оксидами, гидроксидами, солями тяжелых металлов (Hg, Pb, Sb, Bi).
2C2H5SH + HgO (C2H5S)2Hg + H2О
В результате образуются МЕРКАПТИДЫ
№38 слайд

Содержание слайда: Антидоты – противоядия – содержат несколько SH групп, которые образуют более прочные растворимые комплексы с тяжелыми металлами, связывают свободный яд и освобождают инактивированный фермент.
Антидоты – противоядия – содержат несколько SH групп, которые образуют более прочные растворимые комплексы с тяжелыми металлами, связывают свободный яд и освобождают инактивированный фермент.
№39 слайд
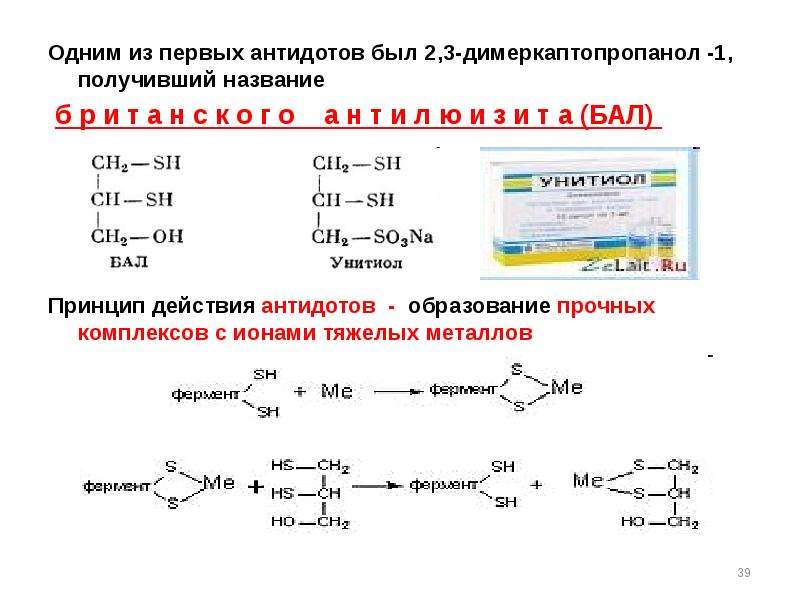

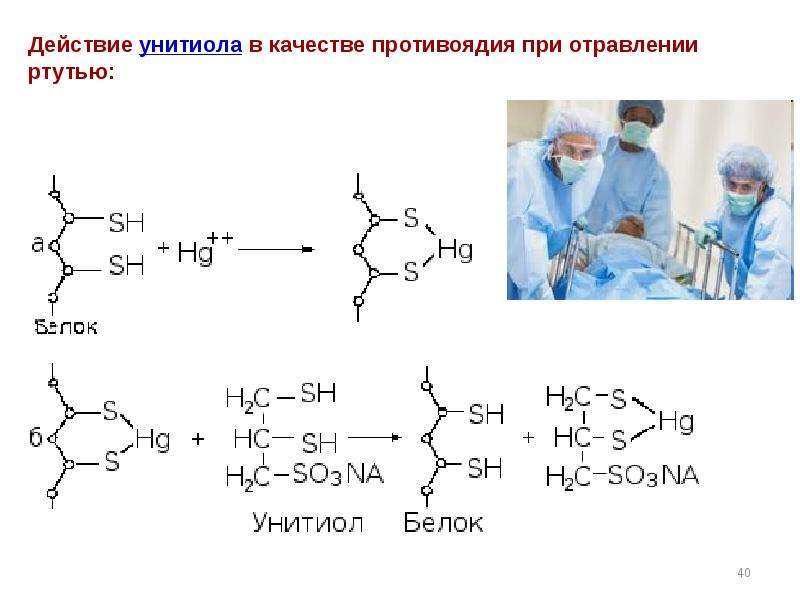
Содержание слайда: Одним из первых антидотов был 2,3-димеркаптопропанол -1, получивший название
Одним из первых антидотов был 2,3-димеркаптопропанол -1, получивший название
б р и т а н с к о г о а н т и л ю и з и т а (БАЛ)
Принцип действия антидотов - образование прочных комплексов с ионами тяжелых металлов
№53 слайд


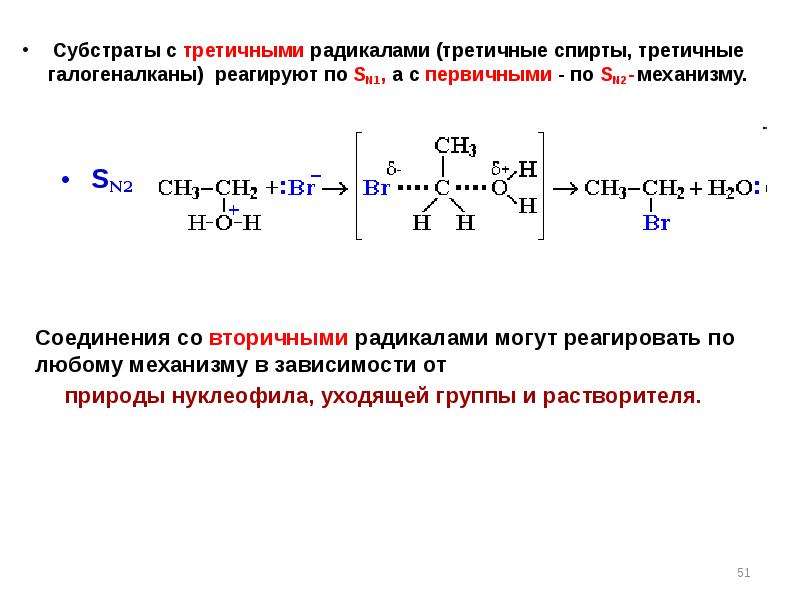
Содержание слайда: В целом способность вступать в реакцию нуклеофильного замещения для соединений различных классов меняется в следующей последовательности:
R – Г > R – OH > R – SH > RNH2
Группы SH ,NH2, NHR, NR2 чрезвычайно плохо уходящие группы.Их нуклеофильное замещение осуществляется специальными (специфическими )реакциями:
№60 слайд


Содержание слайда: IV. Окисление S-H.
IV. Окисление S-H.
В организме под влиянием ферментов:
S – H – S – S –
Eсв S-H = 330 кДж/моль, Eсв O-H = 462 кДж/моль
S-H расщепляются даже когда реагируют с мягкими окислителями (H2O2)
R-S-H + H2O2 R-S-S-R + H2O
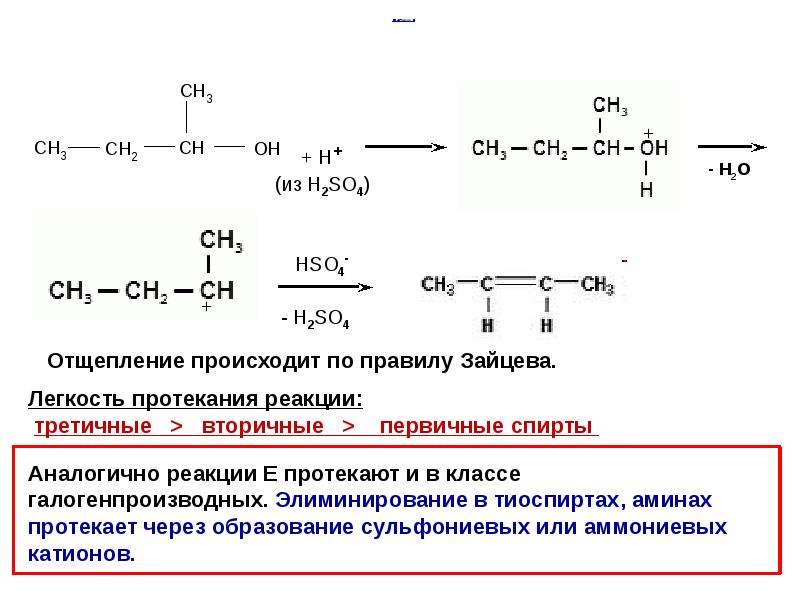
Спирты в аналогичных условиях не окисляются.
В спиртах подвергается окислению более слабая связь C-H, это приводит к другим продуктам окисления.
R-S-H R-SO3H
№63 слайд


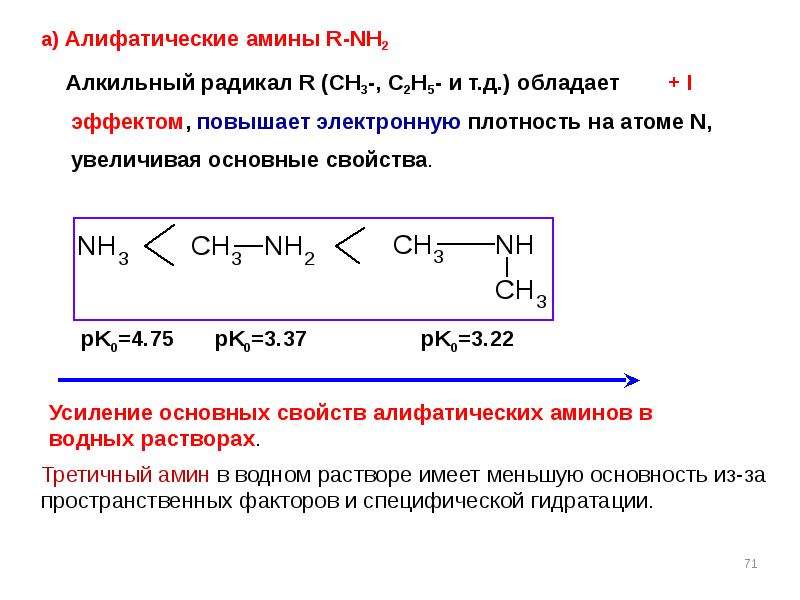
Содержание слайда: Факторы, влияющие на основность
Факторы, влияющие на основность
а) Электроотрицательность элемента
Чем меньше ЭО, тем сильнее основность
б) Размер гетероатома
Чем радиус меньше, тем основность больше
в) Влияние заместителей
ЭД заместители увеличивают основность, ЭА –
уменьшают
г) Влияние сопряжения
Участие в сопряжении ослабляет основность
№64 слайд


Содержание слайда: Основные центры в адреналине:
Основные центры в адреналине:
Основность этих центров ( с учетом влияния всех факторов) уменьшается:
4>3>2>1
Основность в ряду соединений различных классов, имеющих одинаковые радикалы, уменьшается в следующей последовательности:
R-NH2 > R-OH > R-SH
! Наиболее сильными органическими основаниями являются амины.
№74 слайд
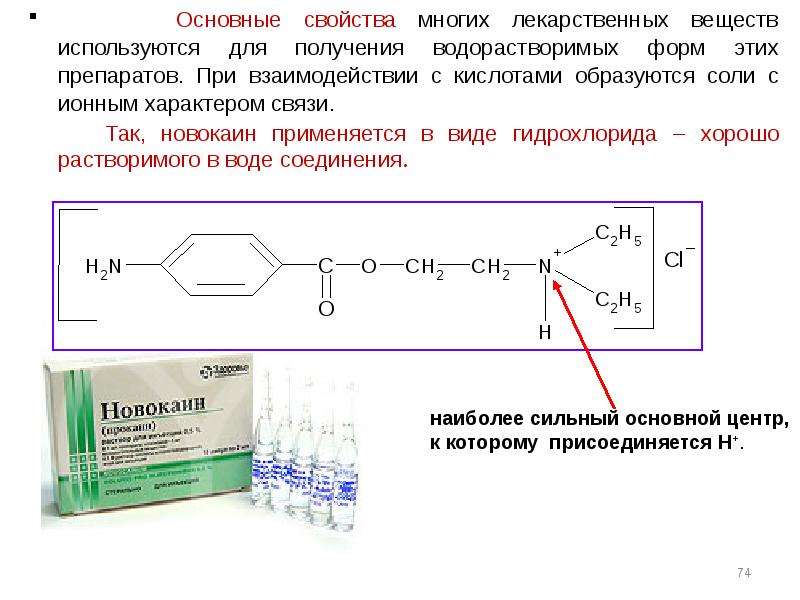

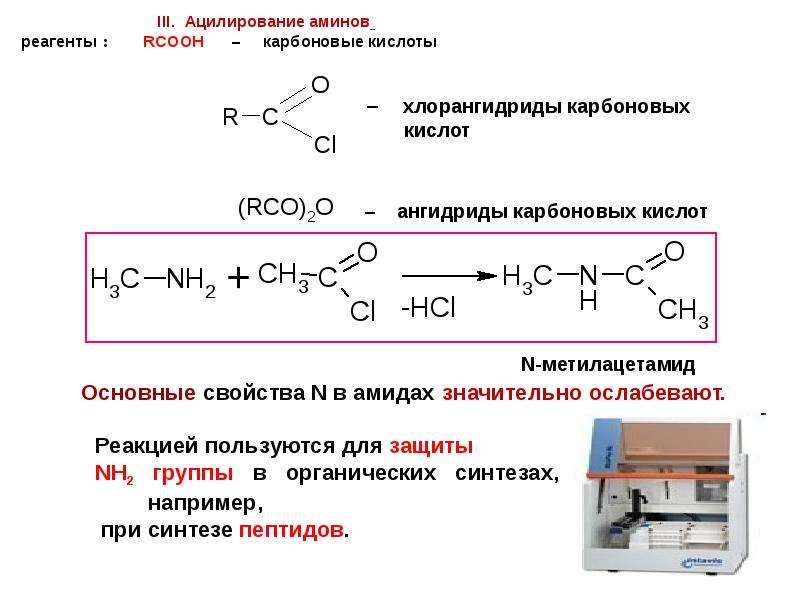
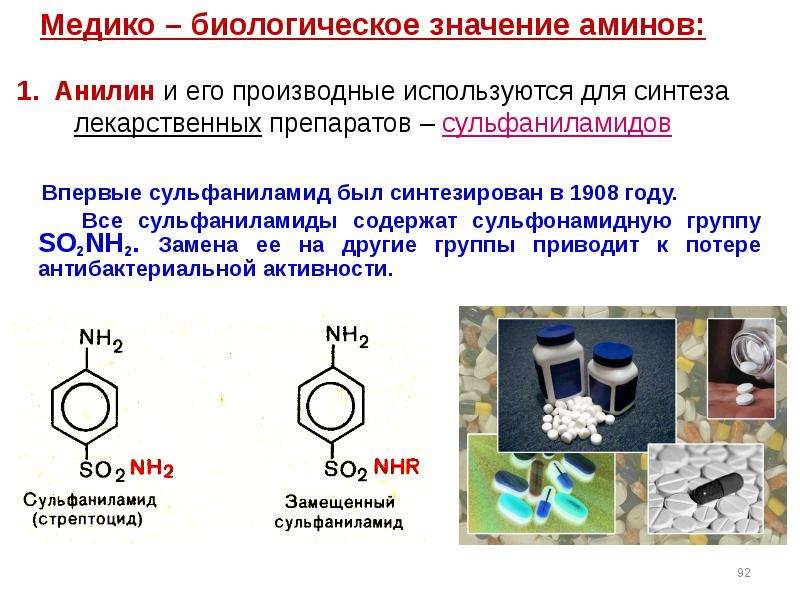
Содержание слайда: Основные свойства многих лекарственных веществ используются для получения водорастворимых форм этих препаратов. При взаимодействии с кислотами образуются соли с ионным характером связи.
Основные свойства многих лекарственных веществ используются для получения водорастворимых форм этих препаратов. При взаимодействии с кислотами образуются соли с ионным характером связи.
Так, новокаин применяется в виде гидрохлорида – хорошо растворимого в воде соединения.
№83 слайд


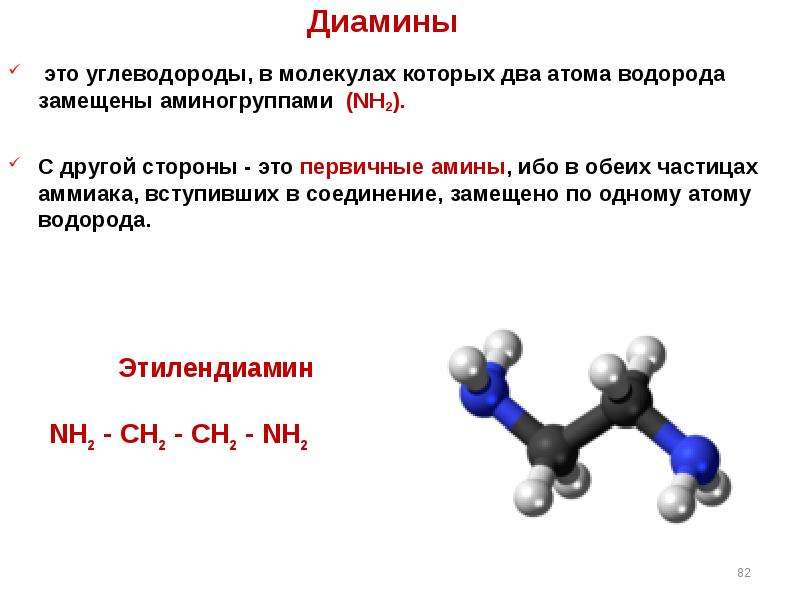
Содержание слайда: Путресцин H2N(CH2)4NH2
(1,4-диаминобутан или 1,4-тетраметилендиамин)
Путресцин образуется при гниении белков из орнитина (диаминокарбоновая кислота):
NH2-(CH2)3-CH(COOH)-NH2 → NH2-(CH2)4-NH2 + CO2↑
орнитин путресцин
Путресцин находится в моче при цистинурии и образуется при гниении мяса (в трупах, вместе с кадаверином) и рыбы (сельди). Искусственно получается всеми общими способами образования диаминов.
№85 слайд


Содержание слайда: Кадаверин
(1,5-диаминопентан или α-,ε- пентаметилендиамин)
от лат. cadaver — «труп». Содержится в продуктах гнилостного распада белков; образуется из лизина при его ферментативном декарбоксилировании:
NH2-(CH2)4-CH(COOH)-NH2 → NH2-(CH2)5-NH2 +CO2↑
лизин кадаверин
Кадаверин обладает неприятным запахом и принадлежит к группе птомаминов (трупных ядов), однако ядовитость кадаверина относительно невелика.
Птоамины – от греч. ptoma — «труп», группа азотсодержащих химических соединений, образующихся
при гнилостном разложении, с участием
микроорганизмов, белков мяса, рыбы,
дрожжей и пр.
№93 слайд

Содержание слайда: 2. Многие амины токсичны. Анилин и другие ароматические амины являются
кровяными и нервными ядами. Легко проникают в организм человека через кожу или при дыхании паров.
Более опасны аминопроизводные нафталина и дифенила, такие как -2-аминонафталин,
-2-аминодифенил, -бензидин вызывают раковые опухоли у человека.
№94 слайд
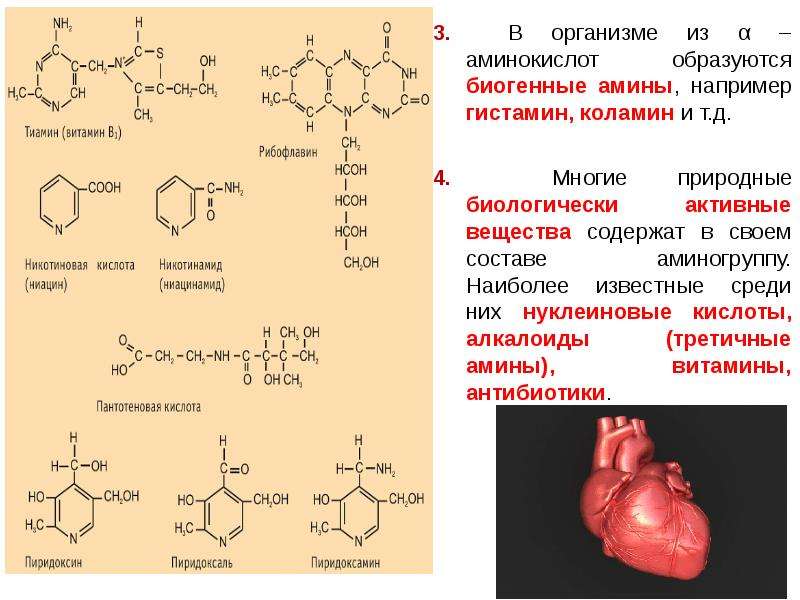

Содержание слайда: 3. В организме из α – аминокислот образуются биогенные амины, например гистамин, коламин и т.д.
3. В организме из α – аминокислот образуются биогенные амины, например гистамин, коламин и т.д.
4. Многие природные биологически активные вещества содержат в своем составе аминогруппу. Наиболее известные среди них нуклеиновые кислоты, алкалоиды (третичные амины), витамины, антибиотики.
№98 слайд
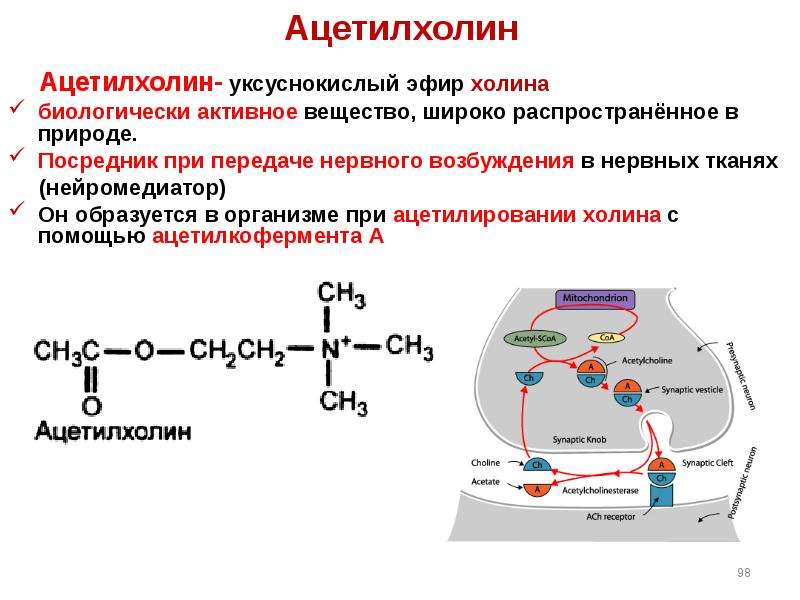

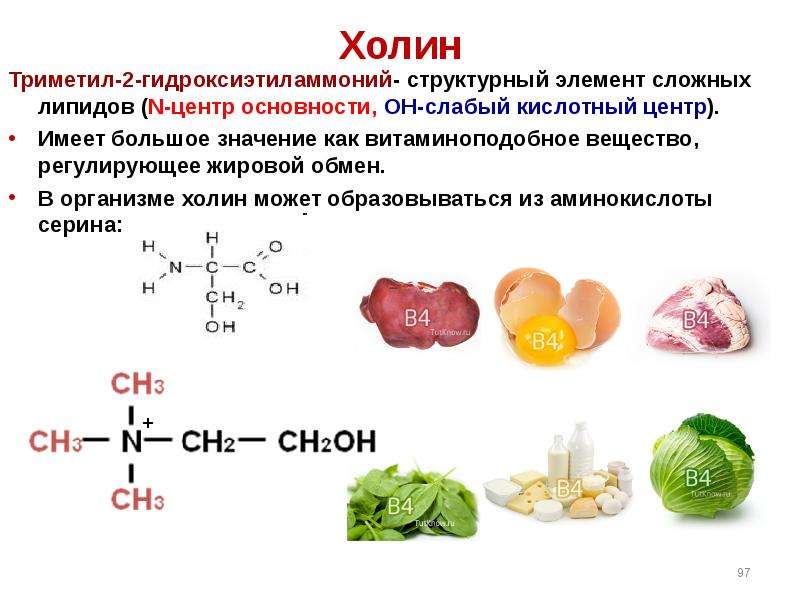
Содержание слайда: Ацетилхолин
Ацетилхолин- уксуснокислый эфир холина
биологически активное вещество, широко распространённое в природе.
Посредник при передаче нервного возбуждения в нервных тканях
(нейромедиатор)
Он образуется в организме при ацетилировании холина с помощью ацетилкофермента А
№99 слайд


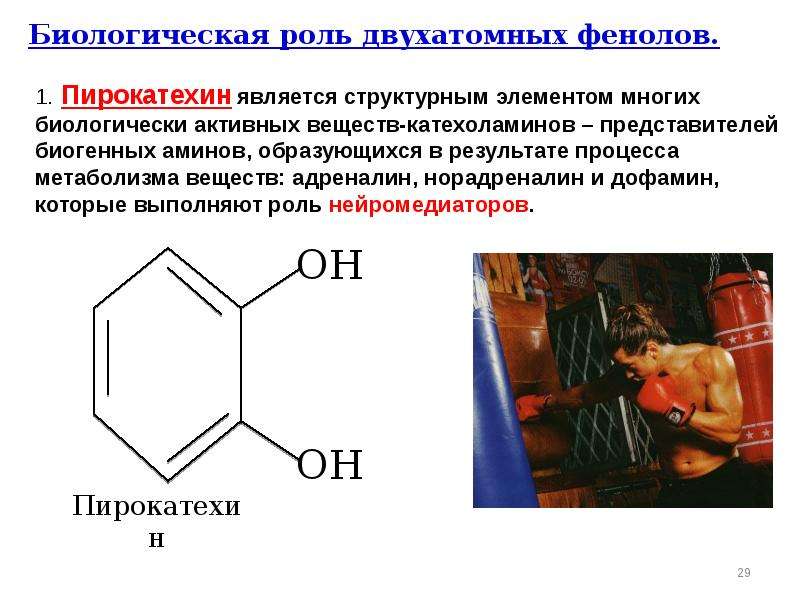
Содержание слайда: Аминофенолы, содержащие остаток пирокатехина, называются катехоламины и играют важную роль в организме (содержат основный центр NH2 или NHR и ОН- кислотный).
Аминофенолы, содержащие остаток пирокатехина, называются катехоламины и играют важную роль в организме (содержат основный центр NH2 или NHR и ОН- кислотный).
Катехоламины - биогенные амины, т.е. образующиеся в организме в результате процессов метаболизма. К ним относятся:
Дофамин
Норадреналин
Адреналин
№100 слайд


Содержание слайда: Катехоламины
Производные пирокатехина
активно участвуют в физиологических и биохимических процессах.
гормоны мозгового слоя надпочечников и медиаторы нервной системы.
они отражают и определяют состояние симпатического отдела вегетативной нервной системы.
играют важную роль в нейрогуморальной регуляции и нервной трофике.
№101 слайд


Содержание слайда: НОРАДРЕНАЛИН
Главным образом важна его роль именно как нейромедиатора. Синоним: норэпинефрин.
По действию на сердце, кровеносные сосуды, гладкие мышцы, а также на углеводный обмен Н. обладает свойствами гормона и близок к своему N-метильному производному — адреналину. Уровень Н. в крови, органах и выделениях организма позволяет судить о состоянии (тонусе и реактивности) симпатической нервной системы .
№102 слайд


Содержание слайда: Дофамин
Дофамин, 3,4-диоксифенилэтиламин, окситирамин, C6H3(OH)2CH2CH2(NH2), промежуточный продукт биосинтеза катехоламинов, образующийся в результате декарбоксилирования диоксифенилаланина (ДОФА).
Дофамин (ДОФА) – важнейший нейромедиатор, участвующий в так называемой «системе награды». Когда мы делаем что-то хорошее в мозге выделяется дофамин, что и создаёт ощущение удовольствия
Ряд органов и тканей (печень, лёгкие, кишечник и др.) содержат преимущественно Д. Наряду с адреналином и норадреналином Д. в небольших количествах секретируется надпочечниками.
№108 слайд


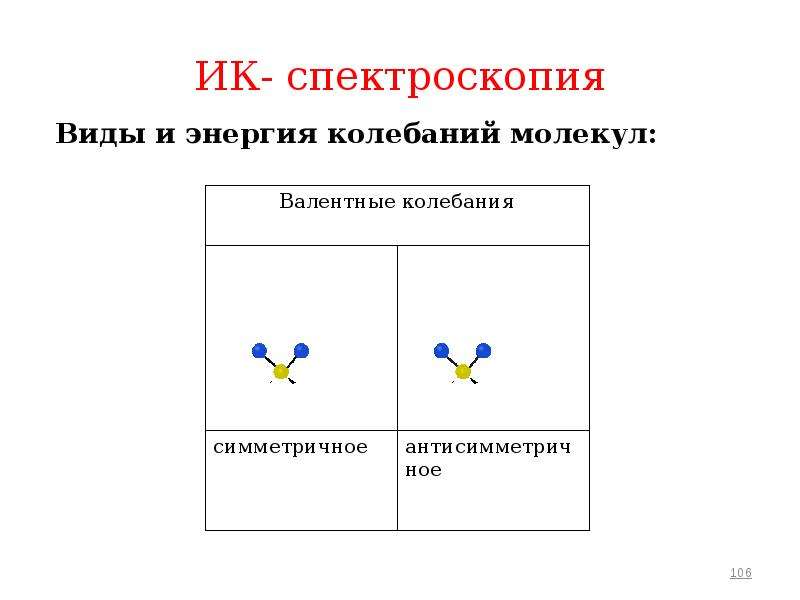
Содержание слайда: ИК- спектроскопия
При валентных колебаниях связь попеременно то растягивается, то укорачивается.
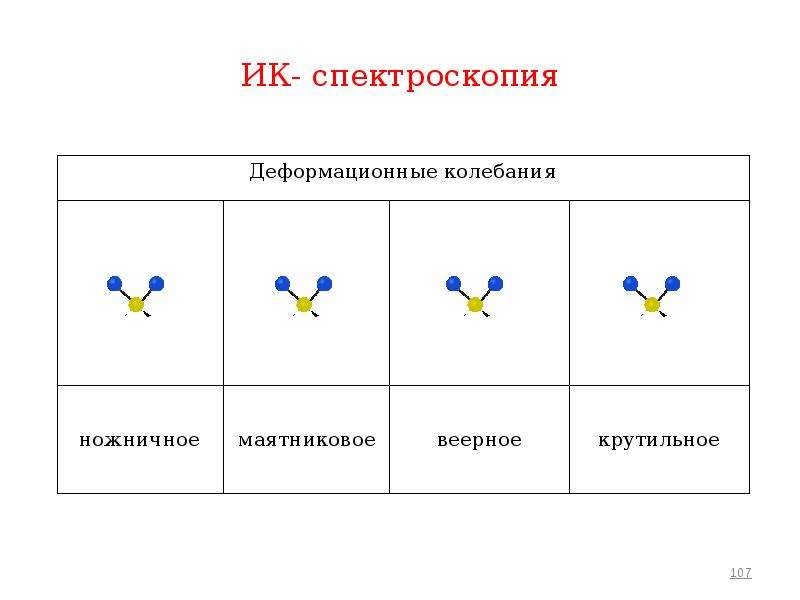
Деформационные колебания представляют собой изменение валентного угла между двумя связями одного атома .
Каждому типу колебаний соответствует собственная частота, которая определяется массой связанных между собой атомов и прочностью связи.
Чем больше масса атомов, тем ниже частота их колебаний и прочнее связь.
№109 слайд


Содержание слайда: ИК- спектроскопия
Для молекул и ковалентно связанных атомов действуют похожие закономерности. Частота колебаний связи О-Н выше, чем частота колебаний связи С-О, поскольку в первом случае масса атомов меньше. Частота колебаний С=О также больше, чем С-О, так как двойная связь более прочная.
Органические молекулы поглощают ИК-излучение, частота которого совпадает с собственной частотой колебаний атомов. При этом происходит усиление колебательного движения, энергия молекулы возрастает.
ИК- излучение поглощает только молекулы, в которых содержатся полярные ковалентные связи.
№110 слайд


Содержание слайда: ИК- спектроскопия
Каждый тип связей имеет индивидуальную комбинацию атомных масс и прочности связи и, следовательно, собственную частоту колебаний и поглощает ИК - излучение характерной для него частоты (длины волны)
С помощью прибора, который позволяет облучать вещество ИК-светом разной длины волны, можно определить длины волн, на которых происходит поглощение.
№114 слайд


Содержание слайда: Основные области ИК спектра
4000-2500 см-1 Область валентных колебаний простых связей X-H: O-H,C-H,S-H, N-H.
2500-1500 см-1 Область валентных колебаний кратных связей X=Y, X≡Y: C=C, C=O, C=N, C≡C, C≡N.
1500-500 см-1 Область валентных колебаний простых связей X-Y: C-C, C-N, C-O и деформационных простых связей X-H:C-H,C-O, C-N.
№115 слайд


Содержание слайда: ИК- спектроскопия
Большая часть спектральной информации, позволяющей обнаружить структурные группы, расположена в длинноволновой части ИК-спектра. Которую часто называют областью функциональных групп.
Интерпретировать коротковолновую часть спектра труднее. Здесь не удаётся соотнести каждую полосу с определённым фрагментом молекулы. Однако контур в этой области спектра индивидуален для каждого вещества.
№116 слайд
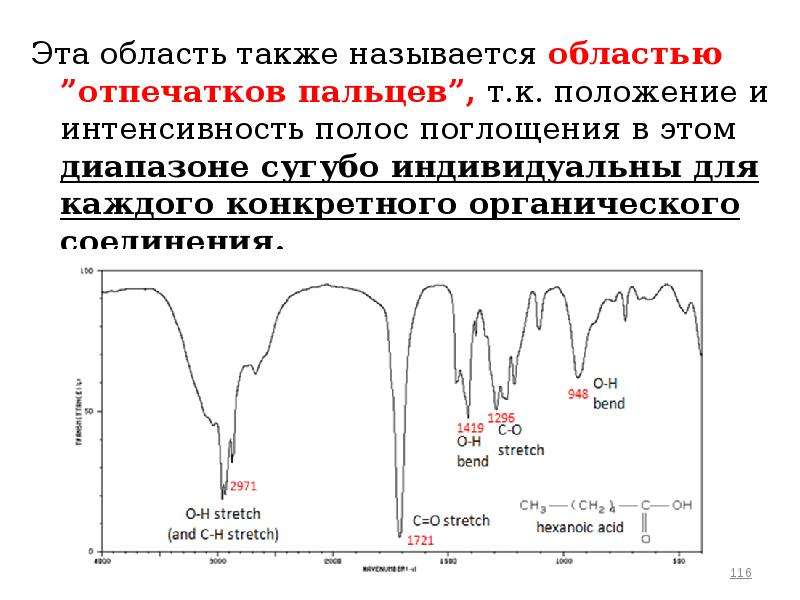

Содержание слайда: Эта область также называется областью ”отпечатков пальцев”, т.к. положение и интенсивность полос поглощения в этом диапазоне сугубо индивидуальны для каждого конкретного органического соединения.
Эта область также называется областью ”отпечатков пальцев”, т.к. положение и интенсивность полос поглощения в этом диапазоне сугубо индивидуальны для каждого конкретного органического соединения.
№120 слайд


Содержание слайда: ИК- спектроскопия
Итак, инфракрасный спектр соединения- это график зависимости интенсивности поглощения от волнового числа (величина обратная длине волны и пропорциональная частоте).
Положение полос поглощения в спектрк позволяет обнаруживать в молекуле вещества те или иные функциональные группы.
ИК –спектры позволяют отождествлять соединение с уже известным веществом
№124 слайд

Содержание слайда: диагностике мозгового инсульта, нейросифилиса, неспецифических гнойно-деструктивных заболеваний легких и плевры
диагностике мозгового инсульта, нейросифилиса, неспецифических гнойно-деструктивных заболеваний легких и плевры
в судебном анализе для изучения митохондриального генома при идентификации личности и определении отцовства
гинекологии для дифференциальной диагностики тубоовариальных образований
Скачать все slide презентации Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. Лекция 2 одним архивом:
Похожие презентации
-
 Кислотность и основность органических соединений. (Лекция 3)
Кислотность и основность органических соединений. (Лекция 3) -
 Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия -
 Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения
Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения -
 Введение. Теория строения органических соединений А. М. Бутлерова. Лекция 1
Введение. Теория строения органических соединений А. М. Бутлерова. Лекция 1 -
 Кислотность и основность органических соединений. Реакционная способность спиртов, фенолов, тиолов и аминов
Кислотность и основность органических соединений. Реакционная способность спиртов, фенолов, тиолов и аминов -
 Кислотность и основность органических соединений
Кислотность и основность органических соединений -
 Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) -
 Классификация и номенклатура органических соединений. (Лекция 1)
Классификация и номенклатура органических соединений. (Лекция 1) -
 Реакции окисления и восстановления биоорганических соединений. (Лекция 5)
Реакции окисления и восстановления биоорганических соединений. (Лекция 5) -
 Кислотные и основные свойства биоорганических соединений. (Лекция 2)
Кислотные и основные свойства биоорганических соединений. (Лекция 2)