Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
16 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
218.50 kB
Просмотров:
69
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Лектор
Турло Евгений Михайлович
Доцент кафедры химии,
кандидат педагогических наук
׀-410
№2 слайд
Содержание слайда: Консультации
Четверг 15-25-18-30
д/з №3635
Методичка к лабораторным работам
№3 слайд
Содержание слайда: Свойства электрона
Электрон имеет двойственную природу (частица и волна). Движение электрона подчиняется законам квантовой механики.
Связь между волновыми и корпускулярными свойствами электрона отражает соотношение де Бройля:
l =h/mv ,где l - длина волны электрона;
m - его масса; v - скорость;
h = 6.62Ч10-34 ДжЧс - постоянная Планка.
№4 слайд
№5 слайд
Содержание слайда: Свойства электрона
№6 слайд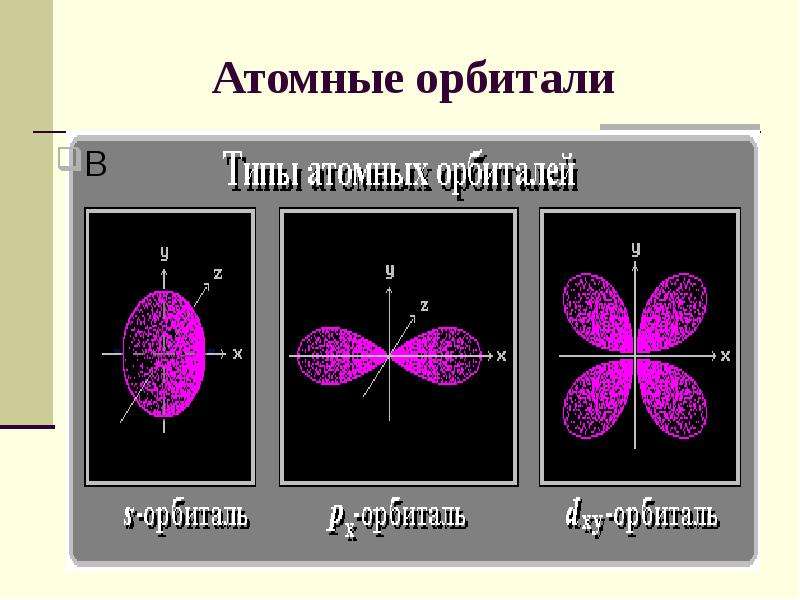
Содержание слайда: Атомные орбитали
№7 слайд
Содержание слайда: Квантовые числа
Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
1. Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .).
№8 слайд
Содержание слайда: Квантовые числа
2. Орбитальное (побочное) квантовое число l определяет форму атомной орбитали.
Значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы.
l = 0 s-орбиталь, l = 1 - р-орбиталь,
l = 2 - d-орбиталь, l = 3 - f-орбиталь
№9 слайд
Содержание слайда: Квантовые числа
3. Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля.
m = 2 l +1
Значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
№10 слайд
Содержание слайда: Квантовые числа
4.Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2.
Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином.
Для обозначения электронов с различными спинами используются символы: ↑ и ↓ .
№11 слайд
Содержание слайда: Пример орбиталей
№12 слайд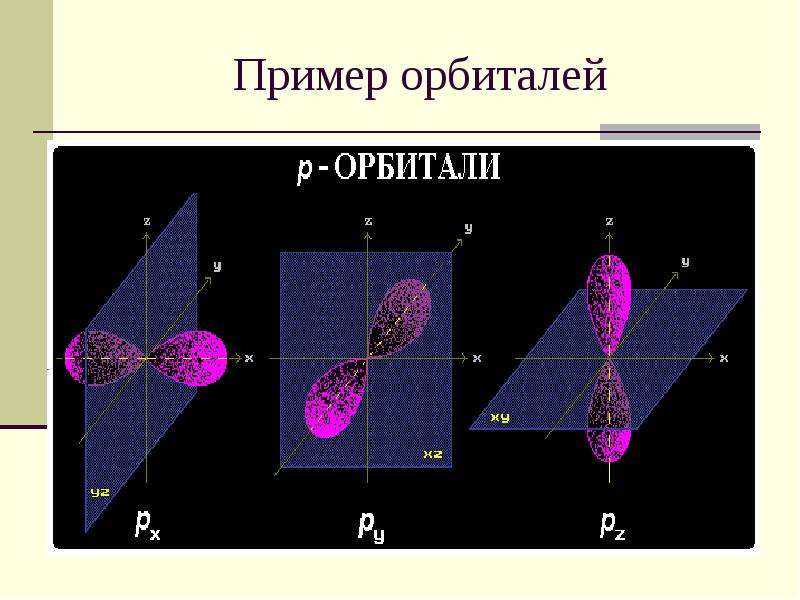
Содержание слайда: Пример орбиталей
№13 слайд
Содержание слайда: Заполнение атомных орбиталей электронами
При заполнении атомных орбиталей электронами соблюдаются три основные правила.
Принцип Паули.
Правило Хунда.
Принцип устойчивости Клечковского.
№14 слайд
Содержание слайда: Заполнение атомных орбиталей электронами
Принцип Паули:
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми
№15 слайд
Содержание слайда: Заполнение атомных орбиталей электронами
Принцип Хунда:
Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально
№16 слайд
Содержание слайда: Заполнение атомных орбиталей электронами
Принцип устойчивости Клечковского.
АО заполняются электронами в порядке повышения их энергетических уровней. В первую очередь заполняются те орбитали, у которых min сумма n+l. При равных суммах n+l заполняются те, у которых n меньше
1s < 2s < 2p < 3s < 3p < 4s < 3d ...
4s (4+0)

























