Презентация Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота абсолютно бесплатно. Урок-презентация на эту тему содержит всего 30 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:30 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:908.67 kB
- Просмотров:52
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: Зачем необходимо определять влагу в лекарственных средствах
В фармацевтическом анализе определение летучих веществ и воды имеет большое значение.
Содержание влаги в лекарственных веществах точно нормируется ГФ, поскольку нарушение этого показателя может привести к изменениям качества препаратов: разложению активных молекул, потере фармакологической активности или появлению токсических эффектов.
В таких препаратах, как эфир для наркоза, следы влаги не допускаются вовсе.
№3 слайд


Содержание слайда: Промышленное значение определения влаги
Кроме фармацевтических лабораторий определение влаги широко применяется в сельском хозяйстве для определения влажности пшеничного зерна (ГОСТ 13586.5-93), в целлюлозно-бумажной промышленности для определения влажности бумаги и картона (ГОСТ 13525.19-91), в пищевой промышленности для определения влаги в пищевых концентратах (ГОСТ 15113.4-77), в топливной промышленности для определения влаги в воздушно-сухом топливе (угли, горючие сланцы, ГОСТ 27314-91) и т.д.
Определение воды методом К. Фишера проводят в сырой нефти (ГОСТ Р 54284-2010), в жареном молотом кофе (ГОСТ Р 52795-2007), некоторых промышленных реактивах.
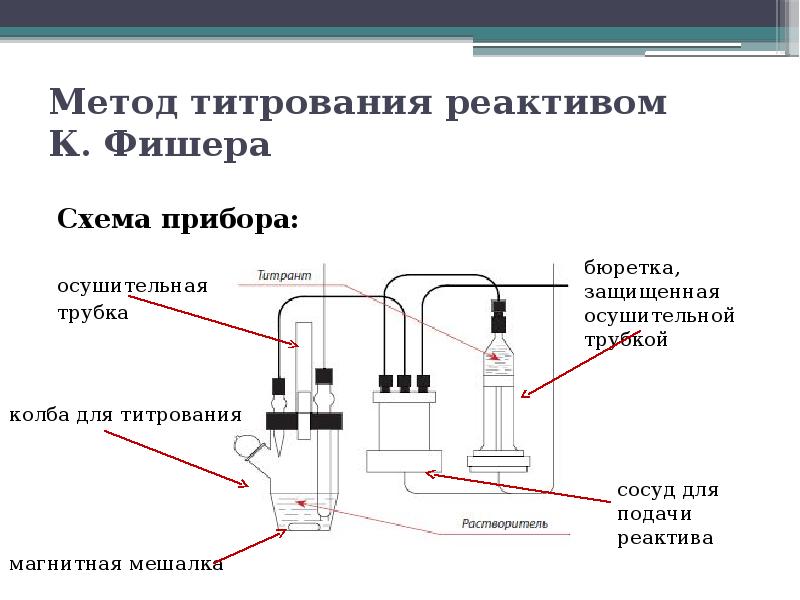
№4 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
– классический метод титрования в аналитической химии - получил наиболее широкое распространение в фармацевтическом анализе, в практическом отношении является наиболее удобным для субстанций и дозированных препаратов.
Метод основан на взаимодействии реактива Фишера и воды.
№5 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
Плюсы метода:
Высокая точность определения при малых навесках субстанций, в отличие от потери в массе при высушивании
Селективен по воде и позволяет определить как гигроскопическую, так и связанную воду
Легкая пробоподготовка, малое время анализа
Можно анализировать твердые вещества, жидкости и газы
Пригоден для автоматизации.
№6 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
Ограничения метода:
Неприменим для анализа соединений, реагирующих с одним или несколькими компонентами реактива Фишера, например, аскорбиновой кислоты, меркаптанов, сульфидов, гидрокарбонатов и карбонатов щелочных металлов и др.
Разновидности метода:
Кулонометрическое и объемное титрование (для обоих разработаны автоматические титраторы).
№7 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
Реактив К. Фишера:
Представляет собой раствор двуокиси серы, йода и пиридина в метиловом спирте.
Получают его растворением сублимированного I2 в смеси безводного пиридина и абсолютного метанола, р-р охлаждают льдом и добавляют жидкий или газообразный SO2 (соотношение SO2:I2= 1:1,3)
Предложен К. Фишером в 1935 году.
Реактивы и растворы, применяемые в данном методе, очень гигроскопичны, поэтому должны быть приняты меры предохранения их от атмосферной влаги.
№8 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
Взаимодействие реактива К. Фишера с водой:
Основано на окислении диоксида серы йодом в присутствии воды. Продукты реакции (H2SO4 и HI) связываются пиридином.
Протекает в две стадии стехиометрически по уравнениям:
I2 + SO2 + H2O + 3C5H5N 2C5H5N∙HI + C5H5NSO3
C5H5NSO3 + CH3OH C5H5N∙HSO4CH3
№11 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
Методика определения:
Точную навеску препарата, содержащую приблизительно от 0,03 до 0,05 г воды, помещают в сухую колбу вместимостью 100 мл, в которую предварительно внесено 5 мл метилового спирта.
Перемешивают 1 мин и титруют реактивом К. Фишера, прибавляя его при приближении к конечной точке по 0,1 - 0,05 мл.
№12 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
Методика определения:
Конец титрования может быть определен как визуально по изменению окраски от желтой до красновато-коричневой, так и электрометрическим титрованием «до полного прекращения тока» (см. «Электрометрические методы титрования»).
Изменение тока в конечной точке титрования при этом выражено настолько четко, что для ее определения построение графиков не обязательно.
Параллельно титруют 5 мл метилового спирта (контрольный опыт).
№14 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
Приготовление реактива:
Имеющийся в продаже реактив К. Фишера (ТУ 6-09-1487-76) состоит из двух отдельных растворов № 1 и 2, которые перед употреблением смешивают в объемном соотношении 1:2,17.
Титр полученного реактива около 0,004 г/мл. Разбавленный реактив с титром около 0,001 г/мл готовят, смешивая полученный раствор с метиловым спиртом в соотношении 1:1, и применяют только при электрометрическом определении конечной точки титрования.
№15 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
Установка титра:
Около 0,04 г воды (точная навеска) вносят в сухую колбу вместимостью 100 мл, содержащую 5 мл метилового спирта, и титруют реактивом К. Фишера, прибавляя его в конце титрования по 0,1 - 0,05 мл.
Параллельно титруют 5 мл метилового спирта.
№16 слайд


Содержание слайда: Метод титрования реактивом
К. Фишера
Установка титра:
Титр в граммах на миллилитр (W) реактива К. Фишера вычисляют по формуле:
а - навеска воды, г
б - объем реактива К. Фишера, на титрование H2O, мл
в - объем реактива К. Фишера, в к.о., мл
При установке титра разбавленного реактива берут точную навеску воды около 0,01 г.
Титр реактива устанавливают каждый раз перед употреблением. Реактив К. Фишера хранят в сухом, защищенном от света месте в бутылях, плотно закрытых стеклянной пробкой.
№19 слайд


Содержание слайда: Кислотное число
количество миллиграммов едкого кали, необходимое для нейтрализации свободных кислот, содержащихся в 1 г исследуемого вещества
Природные жиры нейтральны. Однако при хранении или переработке могут частично произойти процессы омыления или окисления, вследствие чего образуется примесь свободных жирных кислот. Количество этих кислот может быть охарактеризовано кислотным числом. По величине кислотного числа можно определить качество продукции. В Государственных стандартах и Технических условиях приводятся допустимые значения кислотных чисел для различных масел, жиров, восков, смол.
№21 слайд


Содержание слайда: Кислотное число
Кислотное число вычисляют по формуле:
Кч=,
а - количество 0,1 н. р-ра NaOH, пошедшего на титрование, мл;
б - навеска испытуемого вещества, г.
5,61 – количество миллиграммов едкого кали, соответствующее 1 мл раствора едкого натра.
Для веществ с кислотным числом меньше 1 титрование проводят из микробюретки.
№23 слайд


Содержание слайда: Число омыления
Является одним из показателей подлинности жирных масел.
В жирах и маслах, содержащих, преимущественно, триглицериды, определяется средней молекулярной массой жирных кислот, входящих в них.
Число омыления для большинства жиров обычно колеблется в пределах от 150 до 195.
Малые числа омыления указывают на присутствие высокомолекулярных кислот или неомыленных веществ.
Высокое число омыления свидетельствует о повышенном содержании кислот относительно низкомолекулярных.
№24 слайд


Содержание слайда: Число омыления
Методика определения:
Около 2 г испытуемого вещества (точная навеска) помещают в колбу емкостью 200-250 мл, прибавляют 25 мл 0,5 н. спиртового раствора едкого кали.
Колбу соединяют с обратным холодильником и греют на кипящей водяной бане в течение 1 ч.
Конец омыления определяют по образованию совершенно прозрачного и однородного раствора.
При омылении трудно омыляющегося вещества прибавляют 5-10 мл ксилола и нагревают более продолжительное время.
№25 слайд


Содержание слайда: Число омыления
Методика определения:
Сняв холодильник, прибавляют 1 мл раствора фенолфталеина и 25 мл свежепрокипяченной горячей воды и титруют горячий раствор 0,5 н. раствором соляной кислоты до обесцвечивания.
Проводят контрольный опыт. Для этого берут 25 мл 0,5 н. спиртового раствора КОН.
Число омыления вычисляют по формуле, исходя из того, что 1 мл 0,5 н. раствора едкого кали содержит 28,05 мг едкого кали.
Скачать все slide презентации Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота одним архивом:
Похожие презентации
-
 По Химии "Методы определения соединений азота в атмосферном воздухе" - скачать смотреть
По Химии "Методы определения соединений азота в атмосферном воздухе" - скачать смотреть -
 Определение активной реакции воды (рН)
Определение активной реакции воды (рН) -
 Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель -
 Способы определения УЭС пластовой воды
Способы определения УЭС пластовой воды -
 Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова -
 Соли как производные кислот и оснований. Цель урока: 1. Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1. Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить -
 Кислотные оксиды
Кислотные оксиды -
 Кислотность почв с. Берёзовка МОУ «СОШ с. Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с. Берёзовка МОУ «СОШ с. Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс -
 Подгруппа азота
Подгруппа азота -
 Обобщение темы «Неметаллы» (Подгруппа азота)
Обобщение темы «Неметаллы» (Подгруппа азота)