Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
35 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
2.38 MB
Просмотров:
67
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
№2 слайд
Содержание слайда: План лекции
1. Сущность периодического закона. Причина периодической повторяемости химических свойств и количественных характеристик атомов с увеличением зарядов их ядер.
2. Строение периодической системы химических элементов Д.И. Менделеева. Характер и причины изменения металлических и неметаллических свойств, радиусов, энергии ионизации, энергии сродства к электрону, электроотрицательности атомов в периодах и группах периодической системы.
3. Электронные s-, p-, d- и f – семейства.
4. Основные типы химической связи (ковалентная, ионная, металлическая, водородная), механизм их образования и свойства.
№3 слайд
№4 слайд
№5 слайд
№6 слайд
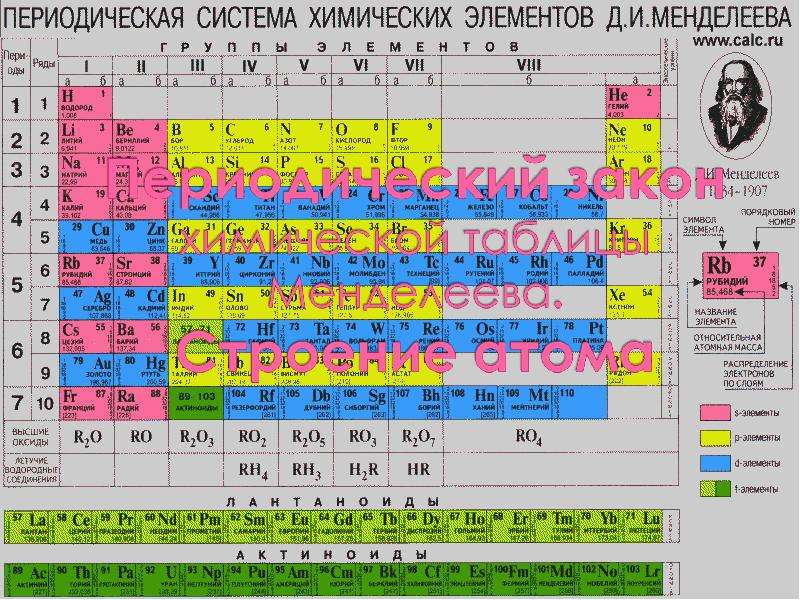
Содержание слайда: Периодическая таблица Д.И. Менделеева
№7 слайд
№8 слайд
Содержание слайда: Периодический закон
"Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости (или, выражаясь алгебраически, образуют периодическую функцию) от величины атомных весов элементов».
№9 слайд
Содержание слайда: Периодический закон сегодня:
"Свойства химических элементов, а также образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра".
Заряд ядра атома определяет число электронов.
Электроны заселяют атомные орбитали таким образом, что строение внешней электронной оболочки периодически повторяется.
Это выражается в периодическом изменении химических свойств элементов и их соединений.
№10 слайд
Содержание слайда: Периодическая система химических элементов
Периодическая система химических элементов - естественная классификация химических элементов, являющаяся табличным выражением периодического закона Д.И. Менделеева.
Прообразом Периодической системы химических элементов послужила таблица, составленная Д.И. Менделеевым 1 марта 1869 г.
В 1870 г. Менделеев назвал систему естественной, а в 1871 г. - периодической.
Формы периодической таблицы: короткопериодная, длиннопериодная
№11 слайд
Содержание слайда: Периодичность
Периодичность – это повторяемость химических и физических свойств элементов и их соединений по определенному направлению периодической системы при изменении порядкового номера элементов.
Виды периодичности: вертикальная, горизонтальная.
№12 слайд
№13 слайд
Содержание слайда: Энергия ионизации
Энергия (потенциал) ионизации атома Ei - минимальная энергия, необходимая для удаления электрона из атома:
Х = Х+ + е−; Ei
Значения Ei (кДж/моль):
H 1312,1
K 418,7 F 1680,8 He 2372
Rb 403,0 Cl 1255,5 Ne 2080
Cs 375,7 Br 1142,6 Ar 1520
№14 слайд
Содержание слайда: Сродство к электрону
Сродство атома к электрону Ee – способность атомов присоединять добавочный электрон и превращаться в отрицательный ион.
Мерой сродства к электрону служит энергия, выделяющая при присоединении электрона к нейтральному атому,
при этом: Х + е− = Х− ; Ee
Значения Ee (кДж/моль)
F −345,7
Cl −366,7
№15 слайд
Содержание слайда: Электроотрицательность
№16 слайд
Содержание слайда: Периодическая таблица Д.И. Менделеева
№17 слайд
Содержание слайда: Периодичность
Вертикальная периодичность
заключается в повторяемости свойств химических элементов в вертикальных столбцах Периодической системы и обусловливает объединение элементов в группы. Элементы одной группы имеет однотипные электронные конфигурации.
Горизонтальная периодичность заключается в появлении максимальных и минимальных значений свойств простых веществ и соединений в пределах каждого периода.
№18 слайд
Содержание слайда: П.3 Электронные s-,p-,d и f- семейства
это связь между положением элемента в периодической системе и электронным строением его атома; от того, какой энергетический подуровень заполняется последним, различают 4 электронных семейства: s-, p-, d- и f.
S-Элементы – семейство химических элементов, у которых при заполнении электронных подуровней последний электрон заполняет s-подуровень внешнего энергетического уровня. Это главные подгруппы I и II групп. ns1,2; (n=1-7).
14 s-элементов.
Р-Элементы – семейство химических элементов, у которых при заполнении электронных подуровней последний электрон заполняет р-подуровень внешнего энергетического уровня. Это элементы главных подгрупп III – VIII групп.
ns2nр1-6 . (n=2-7). 36 р-элементов.
d-Элементы – заполняется d-подуровень предвнешнего уровня. Это элементы побочных подгрупп; входят в 4-7 периоды. ns2(n-1)d1-10 ; (n=4-7).
40 d-элементов.
f- Элементы – заполняется f-подуровень предпредвнешнего уровня (3-ий снаружи). Это элементы 6 и 7 периодов, соответственно, лантаноиды: № 58 (церий) - №71(лютеций) и актиноиды: №90 (торий) - №103 (лоуренсий).
ns2(n-2)f1-14; (n=6,7).
28 f- элементов
№19 слайд
Содержание слайда: п.3. Основные типы химической связи (ковалентная, ионная, металлическая, водородная), механизм их образования и свойства.
Под химической связью понимают
такое взаимодействие атомов,
которое связывает их в молекулы,
ионы, радикалы, кристаллы
№20 слайд
Содержание слайда: Ковалентная химическая связь
это связь, возникающая между атомами за счет образования общих электронных пар
№21 слайд
Содержание слайда: Механизмы образования ковалентной связи: обменный и донорно-акцепторный
Обменный механизм
№22 слайд
№23 слайд
Содержание слайда: Способ перекрывания электронных орбиталей: - и - связи
№24 слайд
Содержание слайда: Полярность ковалентной связи
степень смещенности общих электронных пар к одному из связанных ими атомов
№25 слайд
Содержание слайда: Кратность ковалентной связи
число общих электронных пар, связывающих атомы
№26 слайд
Содержание слайда: Донорно-акцепторный механизм
№27 слайд
Содержание слайда: Гибридизация атомных орбиталей
Гибридизация – это выравнивание (усреднение) энергетических и геометрических характеристик атомных орбиталей разных подуровней при образовании химических связей.
№28 слайд
Содержание слайда: Примеры гибридизации (sp)
№29 слайд
Содержание слайда: Примеры гибридизации (sp2)
№30 слайд
Содержание слайда: Примеры гибридизации (sp3)
№31 слайд
Содержание слайда: Ионная химическая связь
это связь, образовавшаяся за счет
электростатического притяжения
катионов к анионам
№32 слайд
Содержание слайда: Водородная связь
Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, О, N и реже С1 и S) другой молекулы (или ее части)
O H…..O H…..O H….
H H H
№33 слайд
Содержание слайда: Металлическая связь
связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке
№34 слайд
№35 слайд