Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
21 слайд
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
273.50 kB
Просмотров:
93
Скачиваний:
1
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Классификация химических реакций, протекающих в организме человека
Реакционная способность и механизм
№2 слайд
Содержание слайда: Изучение общих закономер-ностей реакционной способ-ности биоорганических соединений является осно-вой понимания механизмов их биологического функцио-нирования
№3 слайд
Содержание слайда: Классификация химических реакций
1. По результату химического взаимодействия. Различают реакции замещения, присоединения, элиминирования, окисления, восстановления, кислотно-основные взаимодействия, лигандообменные процессы.
2. По механизму реакции, определяемому природой активных частиц, ведущих химический процесс. Выделяют реакции электрофильного, нуклеофильного замещения и присоединения, свободнорадикальные процессы.
3. По числу молекул, принимающих участие в элементарном акте (моно-, ди-, тримолекулярные реакции).
№4 слайд
Содержание слайда: В ходе биохимических и химических процессов превращению подвергается не вся молекула, а лишь какая-либо часть (фрагмент) достаточно сложной структуры. Отсюда вытекает понятие реакционного центра.
Отдельные части молекулы могут выполнять роль реакционного центра в совершенно разных реакциях, реагировать с определенными активными частицами и реагентами.
№5 слайд
Содержание слайда: Понятие реагента и субстрата
Реагентом считают соединение, из которого образуется актив-ная частица.
Субстратом называют молеку-лу, которая превращается в хо-де химического процесса, пре-доставляя для взаимодействия атомы С, Р, N и др.
№6 слайд
Содержание слайда: Реагент, который генерирует в ходе реакции электрофильные частицы (Е+), называется электрофильным.
Реагент, который предоставляет отрицательно заряженные частицы (Nu-), называется нуклеофильным.
Активные частицы, имеющие неспа-ренные или валентные электроны, называются свободными радика-лами (R•).
№7 слайд
Содержание слайда: Типы разрыва связи
Свободнорадикальные частицы образуются при гомолитическом разрыве ковалентной связи
Е •|• Y → E• + Y •
Электрофильные и нуклеофильные реагенты образуются при гетероли-тическом разрыве ковалентной связи
Е | •• Y → E+ + Y -
№8 слайд
Содержание слайда: Природа активных частиц
Свободнорадикальные частицы (имеют неспаренный или валентный электрон)
(ОH•, Br •,Cl •, CH3 •, RO2 •и т.д.)
Электрофильные частицы (имеют не заполненный электронный уровень)
NO2+,SO3H+,CH3+, CH3 CO+, Сl+, Br+
Нуклеофильные частицы (имеют неподеленную электронную пару на внешнем электронном уровне или являются анионом)
ОН-, OCH3, NH3, NH2-, CN- и др.
№9 слайд
Содержание слайда: Классификация органических реакций
1. Реакции замещения (Substitution)
SR – радикального замещения
SЕ – электрофильного замещения
SN – нуклеофильного замещения
2. Реакции присоединения (Addition)
АR – радикального присоединения
АЕ – электрофильного присоединения
АN – нуклеофильного присоединения
№10 слайд
Содержание слайда: Классификация органических реакций
3. Реакции элиминирования (отщепления) (eliminination) (E)
4. Окислительно-восстановительные реакции (Oxidation-reduction) (реакции эпоксидирования, гидроксилирования)
5. Кислотно-основные взаимодействия
6. Лигандообменные процессы
7. Перегруппировки
№11 слайд
Содержание слайда: Реакции электрофильного присоединения
Субстратом реакций AE являются алкены, алкины, реакции протекают по реакционному центру, представляю-щему собой кратную связь. [ Н+ ]
НООС- СН=СН- СООН + НОН ─→
Фумаровая кислота [ О ]
НООС- СН – СН2- СООН → НООС-С-СН2СООН
| ||
ОН О
Яблочная кислота Щавелевоуксусная
№12 слайд
Содержание слайда: Пример реакции АЕ
СООН [ Н+ ]
НООС-СН2 –С=СН-СООН + НОН ─→
Цис-аконитовая кислота
СООН
НООС-СН2 – CH - СН-СООН
ОН
Изолимонная кислота
№13 слайд
Содержание слайда: Пример реакции АЕ
СН3-(СН2)7 -СН=СН- (СН2)7-СООН + Br2 →
Олеиновая кислота
СН3-(СН2)7 -СН─СН- (СН2)7-СООН
| |
Br Br
№14 слайд
Содержание слайда: Механизм реакций АЕ
Образование электрофильной частицы
HOBr → OH- + Br+ (E+)
2. Образование пи-комплекса
СН2=СН2 + Br+ → СН2=СН2 → СН2 ─ СН2
Br+ Br+
пи-комплекс сигма-комплекс
СН2─СН2 катион бромония
| |
Br OH
№15 слайд
Содержание слайда: Механизм реакций АЕ
Реакция бромирования
2. Образование пи-комплекса
СН2=СН2 + Br2 (Br+-Br-) → СН2=СН2
Br+-Br-
пи-комплекс
→ СН2 ─ СН2 + Br- → СН2─СН2
Br+ | |
сигма-комплекс - Br Br
катион бромония 1,2-дибромэтан
№16 слайд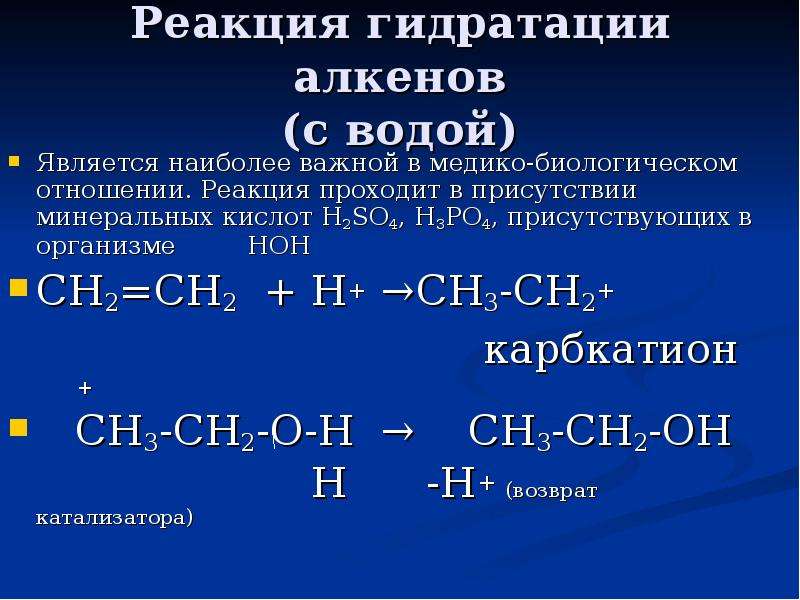
Содержание слайда: Реакция гидратации алкенов
(с водой)
Является наиболее важной в медико-биологическом отношении. Реакция проходит в присутствии минеральных кислот Н2SO4, H3PO4, присутствующих в организме НОН
СН2=СН2 + Н+ →СН3-СН2+
карбкатион
+
СН3-СН2-О-Н → СН3-СН2-ОН
Н -Н+ (возврат катализатора)
№17 слайд
Содержание слайда: Правило Марковникова
Нессиметричные алкены.
Реакция гидрогалогенирования, гидратации протекает таким образом, что протон присоединяется к наиболее гидрированному атому углерода.
Акролеин. Реакция протекает против правила Марковникова, что связано с мезомерным эффектом карбонильной группы
№18 слайд
Содержание слайда: Скорость и направление реакций АЕ
Определяется двумя факторами: статическим и динамическим. Статический фактор связан с электронным эффектом заместителей, а динамический – с устойчивостью образующихся карбокатионов.
СН2=С-СН3> СН3- СН=СН-СН3> СН2=С-СН3
СН3
СН2=СН2
Электронодоноры увеличивают, а электроно- акцепторы уменьшают стабильность карбкатионов (сигма – комплексов)
-СН3, -СН2-СН3; (электронодоноры)
+
-СООН; -СF3; -NO2; -С≡N; -N(CH3)3 (электроноакцепторы)
№19 слайд
Содержание слайда: Особенности присоединения к сопряженным диенам
Реакция идет по двум направлениям (1-2 и 1,4 присоединение), что связано с эффектом сопряжения в этих структурах.
СН2=СН-СН=СН2 + НBr →
СН2 - СН-СН=СН2 + СН2 – СН=СН - СН2
| | | |
Br Br Br Br
3,4-дибром-бутен-1 1,4-дибром-бутен-2
(20%) (80%)
№20 слайд
Содержание слайда: Реакции электрофильного замещения (SE)
Реакция образования электрофильной частицы
1.1 Реакция алкилирования
СН3Сl + AlCl3 → CH3+ + AlCl4-
1.2 Реакция ацилирования
СН3СOCl + AlCl3 → CH3CO+ + AlCl4-
1.3 Реакция нитрования
НNO3+2 H2SO4→ NO2+ + H3O+ + 2 HSO3-
1.4 Реакция сульфирования
Н2SO4 → HSO3+ + OH-
3
№21 слайд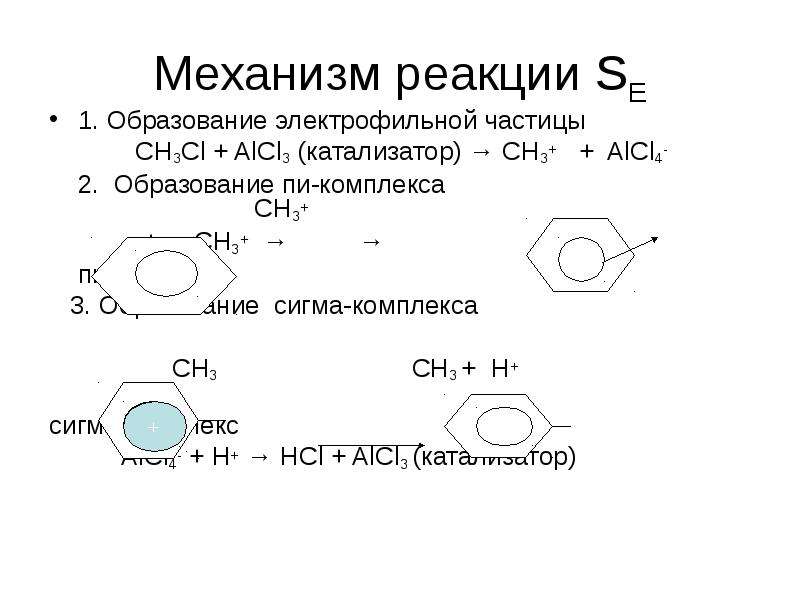
Содержание слайда: Механизм реакции SЕ
1. Образование электрофильной частицы
СН3Сl + AlCl3 (катализатор) → CH3+ + AlCl4-
2. Образование пи-комплекса СН3+
+ СН3+ → →
пи-комплекс
3. Образование сигма-комплекса
СН3 СН3 + Н+
сигма-комплекс
AlCl4- + H+ → HCl + AlCl3 (катализатор)






























