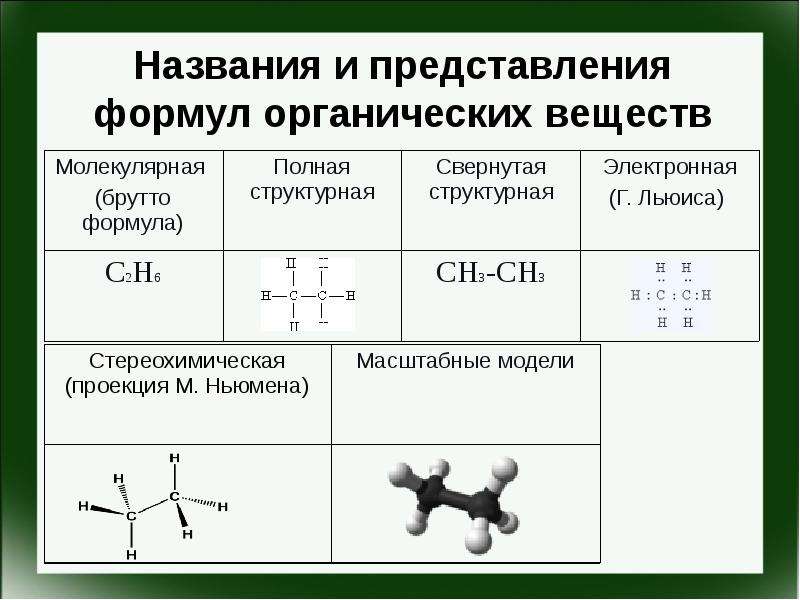
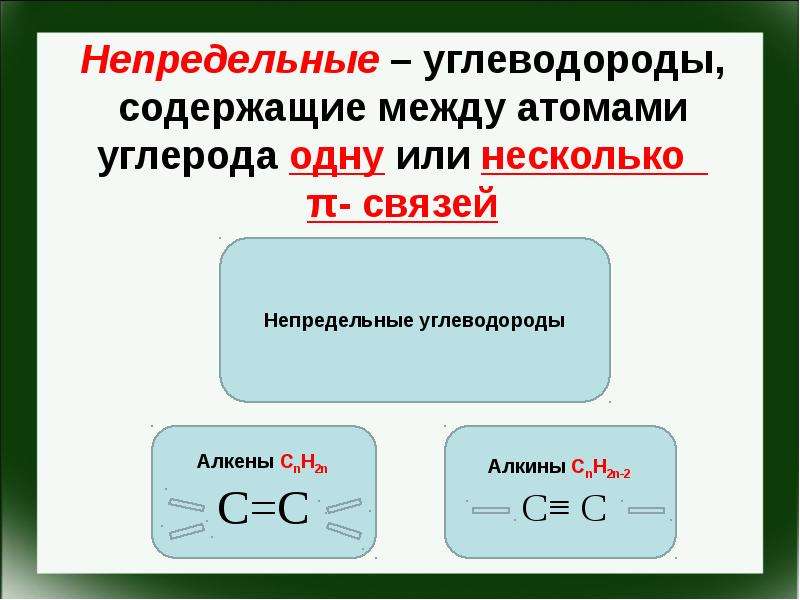
Презентация Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах абсолютно бесплатно. Урок-презентация на эту тему содержит всего 35 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:35 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:1.64 MB
- Просмотров:78
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений. Согласно этой теории:
атомы в органических молекулах соединены друг с другом в соответствии с валентностью, при этом углерод всегда четырехвалентен;
Поскольку углерод в органических соединениях всегда четырехвалентен, то каждый атом углерода может образовывать четыре связи (четыре черточки).
№4 слайд
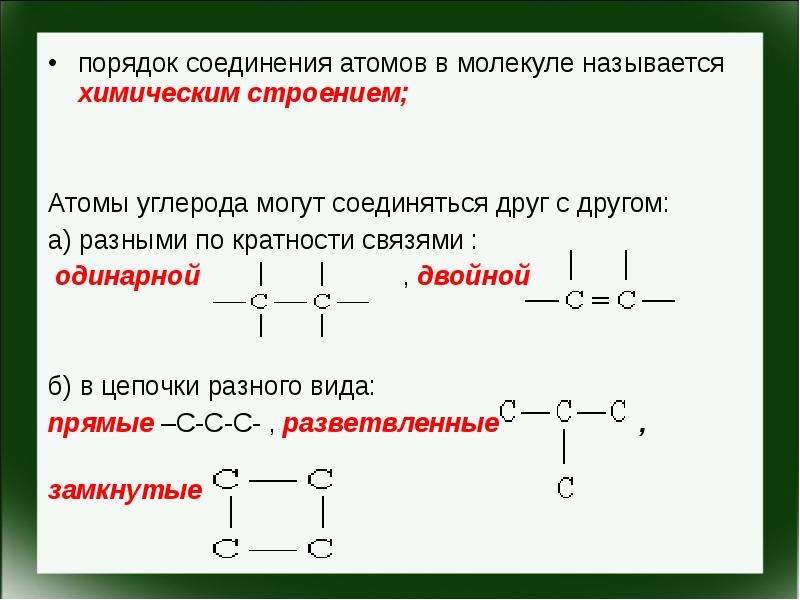

Содержание слайда: порядок соединения атомов в молекуле называется химическим строением;
порядок соединения атомов в молекуле называется химическим строением;
Атомы углерода могут соединяться друг с другом:
а) разными по кратности связями :
одинарной , двойной
б) в цепочки разного вида:
прямые –С-С-С- , разветвленные ,
замкнутые
№10 слайд


Содержание слайда: Бесцветный газ (в нормальных условиях) без запаха. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека. Накапливаясь в закрытом помещении, метан взрывоопасен. Горит в воздухе голубоватым пламенем.
Бесцветный газ (в нормальных условиях) без запаха. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека. Накапливаясь в закрытом помещении, метан взрывоопасен. Горит в воздухе голубоватым пламенем.
Основной компонент природного газа (77—99 %), попутных нефтяных газов (3190 %), рудничного и болотногогазов (отсюда произошли другие названия метана — болотный или рудничный газ).
№12 слайд


Содержание слайда: Этан при н. у. — бесцветный газ, без запаха и вкуса. В природе содержится в составе природного газа, нефти и других углеводородах. По сравнению с метаном и более пожаро- и взрывоопасен.
Этан при н. у. — бесцветный газ, без запаха и вкуса. В природе содержится в составе природного газа, нефти и других углеводородах. По сравнению с метаном и более пожаро- и взрывоопасен.
№14 слайд


Содержание слайда: Этен - при н. у. — бесцветный горючий газ со слабым запахом. Плохо растворим в воде. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этен - при н. у. — бесцветный горючий газ со слабым запахом. Плохо растворим в воде. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
По месту двойной связи присоединяет – водород, галогены, галогеноводороды, воду. Полимеризуется. Обесцвечивает желто-оранжевый раствор бромной воды Br2 и краснофиолетовый перманганата калия KMnO4
№15 слайд


Содержание слайда: Этин - при нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах. Малорастворим в воде, может взрываться от удара, горит красноватым пламенем 3150 С0.
Этин - при нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах. Малорастворим в воде, может взрываться от удара, горит красноватым пламенем 3150 С0.
По месту тройной связи присоединяет – водород, галогены, галогеноводороды, воду до уксусного альдегида (р-я Кучерова). Полимеризуется до бензола. Обесцвечивает желто-оранжевый раствор бромной воды Br2 и красно-фиолетовый перманганата калия KMnO4. Реагирует с аммиачным раствором оксида серебра Ag2O.
№16 слайд


Содержание слайда: Спирты́ (устаревшее алкого́ли)
— органические соединения, содержащие одну или несколько гидроксильных групп (гидроксил, OH), непосредственно связанных с атомом углерода в углеводородном радикале.
Общая формула спиртов СxHy(OH)n
Общая формула одноатомных предельных спиртов СnН2n+1ОН
№18 слайд


Содержание слайда: Метано́л (метиловый спирт, древесный спирт) — CH3OH, простейший одноатомный спирт,бесцветная ядовитая
Метано́л (метиловый спирт, древесный спирт) — CH3OH, простейший одноатомный спирт,бесцветная ядовитая
жидкость. Метанол смешивается в любых соотношениях с водой. В органической химии метанол используется в качестве растворителя. Может использоваться в качестве топлива.
№19 слайд
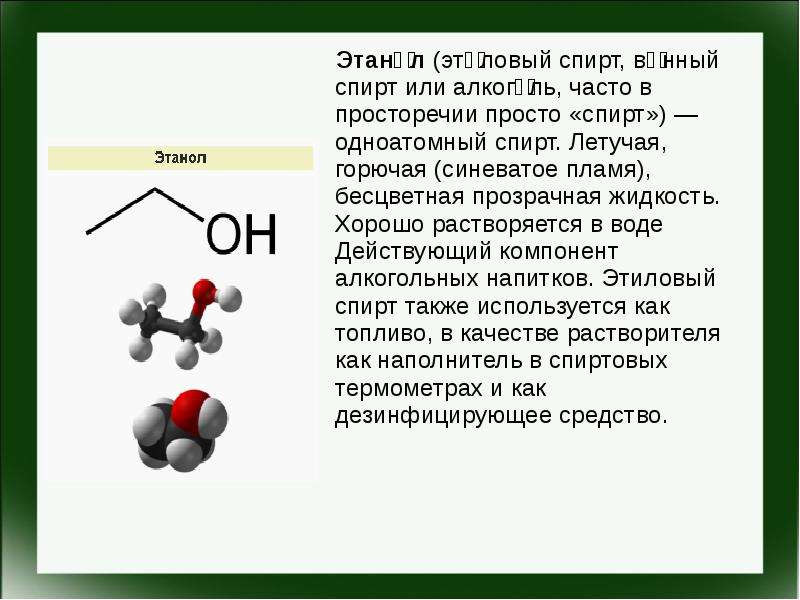

Содержание слайда: Этано́л (эти́ловый спирт, ви́нный спирт или алкого́ль, часто в просторечии просто «спирт») — одноатомный спирт. Летучая, горючая (синеватое пламя), бесцветная прозрачная жидкость. Хорошо растворяется в воде Действующий компонент алкогольных напитков. Этиловый спирт также используется как топливо, в качестве растворителя как наполнитель в спиртовых термометрах и как дезинфицирующее средство.
Этано́л (эти́ловый спирт, ви́нный спирт или алкого́ль, часто в просторечии просто «спирт») — одноатомный спирт. Летучая, горючая (синеватое пламя), бесцветная прозрачная жидкость. Хорошо растворяется в воде Действующий компонент алкогольных напитков. Этиловый спирт также используется как топливо, в качестве растворителя как наполнитель в спиртовых термометрах и как дезинфицирующее средство.
№24 слайд


Содержание слайда: Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде.
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде.
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70—80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15 % — уксусом.
Обладает некоторыми свойствами неорганических кислот.
№25 слайд


Содержание слайда: Химически чистая стеариновая кислота имеет вид бесцветных кристаллов, нерастворима в воде, не имеет запаха.
Химически чистая стеариновая кислота имеет вид бесцветных кристаллов, нерастворима в воде, не имеет запаха.
Растворяется в водных растворах щелочей (с образованием
стеаратов):
C17H35COOH + NaOH → C17H35COONa + H2O
Широко используется в косметической промышленности: стеарат натрия является одним из основных компонентов мыла.
№30 слайд
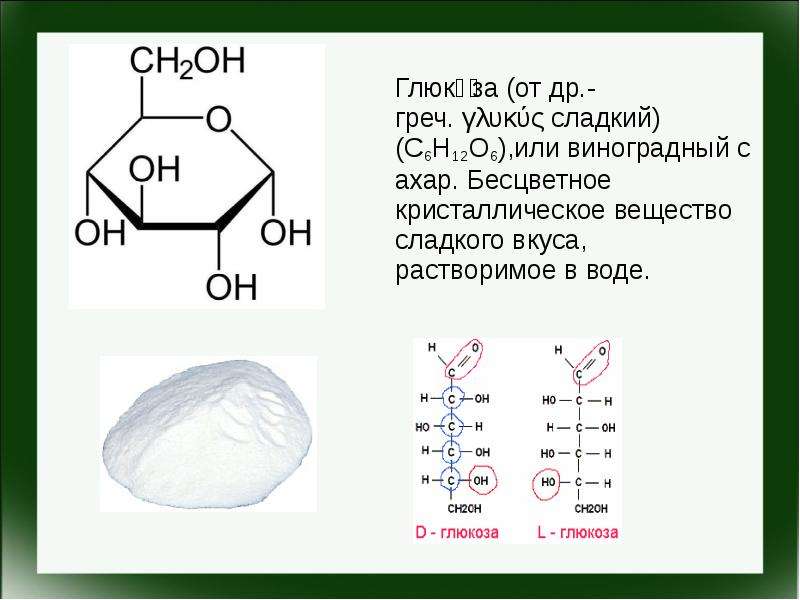

Содержание слайда: Глюко́за (от др.-греч. γλυκύς сладкий) (C6H12O6),или виноградный сахар. Бесцветное кристаллическое вещество сладкого вкуса, растворимое в воде.
Глюко́за (от др.-греч. γλυκύς сладкий) (C6H12O6),или виноградный сахар. Бесцветное кристаллическое вещество сладкого вкуса, растворимое в воде.
Скачать все slide презентации Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах одним архивом:
Похожие презентации
-
 Классификация органических веществ Химия. 10 класс Абрамова С. И.
Классификация органических веществ Химия. 10 класс Абрамова С. И. -
 Тема: «Первоначальные сведения о строении вещества»
Тема: «Первоначальные сведения о строении вещества» -
 « Обобщение сведений об основных классах неорганических веществ». « Обобщение сведений об основных классах неорганических вещес
« Обобщение сведений об основных классах неорганических веществ». « Обобщение сведений об основных классах неорганических вещес -
 Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне Ким Елена Петро
Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне Ким Елена Петро -
 По Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть
По Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть -
 Скачать презентацию Обобщение сведений об основных классах неорганических веществ
Скачать презентацию Обобщение сведений об основных классах неорганических веществ -
 Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества -
 Генетическая связь между неорганическими соединениями.
Генетическая связь между неорганическими соединениями. -
 Изомерия. Классификация органических веществ.
Изомерия. Классификация органических веществ. -
 Органическая химия Жиры
Органическая химия Жиры