Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
29 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
871.62 kB
Просмотров:
86
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Азот: кислородные соединения.
Особенности химии фосфора и элементов его подгруппы
№2 слайд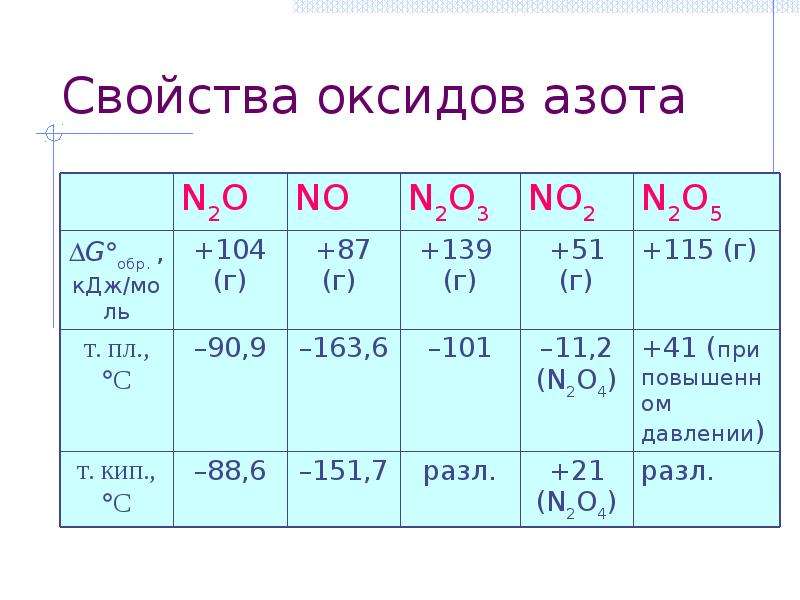
Содержание слайда: Свойства оксидов азота
№3 слайд
Содержание слайда: Оксид диазота N2O
N2O – бесцв. газ со слабым приятным запахом и слабонаркотическим действием, т.пл. –91 °С, т.кип. –89 °С.
N2O – несолеобр. оксид, сильный окислитель.
Разложение:
2N2O = 2N2O + O2
№4 слайд
Содержание слайда: Монооксид азота NO
NO – бесцв. газ, несолеобр. оксид, т. пл. –164 °С, т. кип. –152 °С.
Димеризация:
2NO(г) N2O2(ж)
Окисление:
2NO + O2 = 2NO2
Получение:
3Cu + 8HNO3 =
= 3Cu(NO3)2 + 2NO + 4H2O
3SO2 + 2HNO3 + 4H2O =
= 3H2SO4 + 2NO
№5 слайд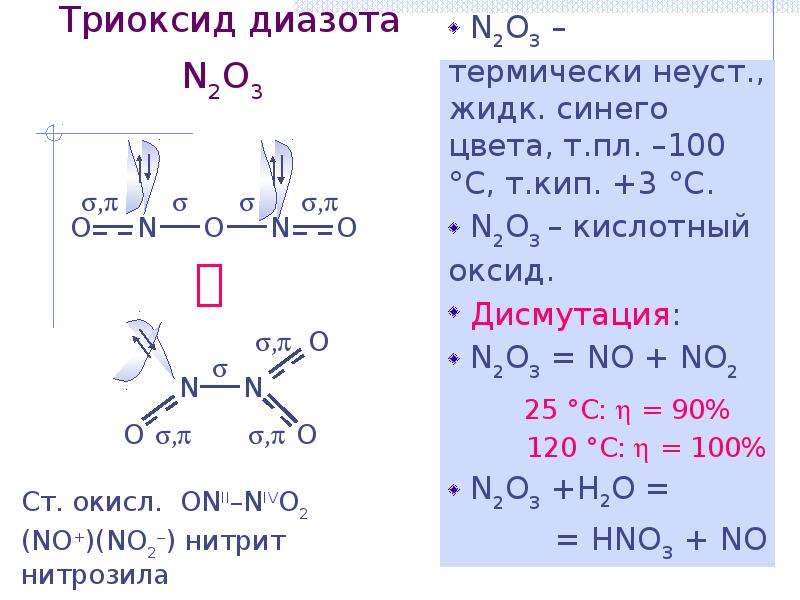
Содержание слайда: Триоксид диазота N2O3
N2O3 – термически неуст., жидк. синего цвета, т.пл. –100 °С, т.кип. +3 °С.
N2O3 – кислотный оксид.
Дисмутация:
N2O3 = NO + NO2
25 °С: = 90%
120 °С: = 100%
N2O3 +H2O =
= HNO3 + NO
№6 слайд
Содержание слайда: Азотистая кислота HNO2
Протолиз в водном р-ре:
HNO2 + H2O NO2– + H3O+; KK = 5,13 · 10–4
Устойчивы соли MIANO2, MIIA(NO2)2
Гидролиз: NO2– + H2O HNO2 + OH–; рН > 7
№7 слайд
Содержание слайда: Окислительно-восстановительные свойства
Окислительные свойства
рН > 7: NO2–+ H2O + 2e = NO + 2OH;
= –0,45 В
рН < 7: HNO2 + H+ + 2e = NO + H2O;
= +1,00 В
Восстановительные свойства
рН > 7: NO2– + 2OH – 2e = NO3– + H2O;
= +0,01 В
рН < 7: HNO2 + H2O – 2e = NO3– +3H+;
= +0,93 В
№8 слайд
Содержание слайда: Диоксид азота ·NO2
2NO2 N2O4
бурый газ бесцв. жидк.
N2O4(ж) (NO+)(NO3)
Дисмутация:
3N2O4 + 2H2O = 4HNO3 + 2NO
3NO2 + H2O = 2HNO3 + NO
2NO2 + 2KOH =
= KNO3 + KNO2 + H2O
№9 слайд
Содержание слайда: Получение
В промышленности
2NO + O2 2NO2
2NO2 + O2 + H2O = 2 HNO3
В лаборатории
Cu + 4HNO3(конц) =
= Cu(NO3)2 + H2O + 2NO2
(c примесями)
2Pb(NO3)2 = 2PbO + 4NO2 + O2 (+t)
2NO2 N2O4 (–t)
2N2O4 + H2O = 2HNO3 + N2O3
№10 слайд
Содержание слайда: Пентаоксид диазота N2O5
N2O5 – бесцв. крист., гигроскопичен, т.пл. +41 °С, т.субл. +32 °С.
N2O5 – сильнейший окислитель.
Получение:
2NO2 + O3 = N2O5 + O2
4HNO3 + P4O10 =
= (HPO3)4 + 2N2O5
№11 слайд
Содержание слайда: Азотная кислота HNO3
HNO3 – бесцветная жидкость, дымящая на воздухе, т. пл. –41,6 С, т.кип. +82,6 С, гигроскопична, неогранич. р-рима в воде.
HNO3 – сильная к-та:
HNO3 + H2O = NO3– + H3O+
Разложение на свету:
4HNO3 = 4NO2 + O2 + H2O
№12 слайд
Содержание слайда: Окислительные свойства HNO3
NO3 + 2H+(конц.) + 1e =
= NO2 + H2O; = +0,77В
NO3 + 4H+(разб.) + 3e =
= NO + 2H2O; = +0,96 В
NO3 + 10H+(оч.разб.) + 8e =
= NH4+ + 3H2O; = +0,88 В
№13 слайд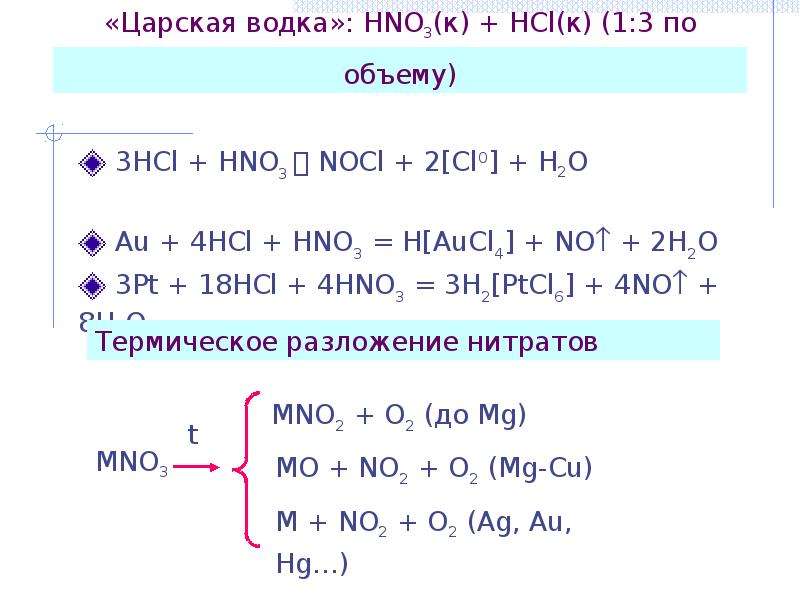
Содержание слайда: «Царская водка»: HNO3(к) + HCl(к) (1:3 по объему)
3HCl + HNO3 NOCl + 2[Cl0] + H2O
Au + 4HCl + HNO3 = H[AuCl4] + NO + 2H2O
3Pt + 18HCl + 4HNO3 = 3H2[PtCl6] + 4NO + 8H2O
№14 слайд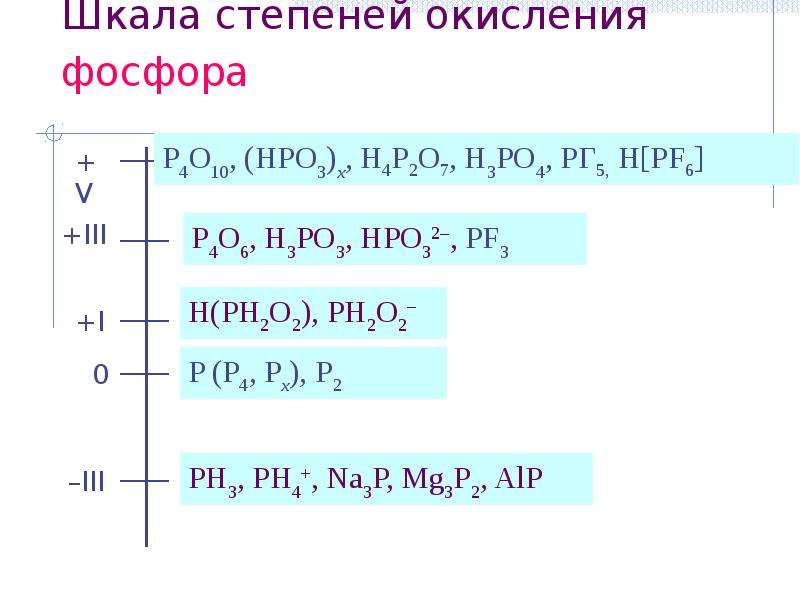
Содержание слайда: Шкала степеней окисления фосфора
№15 слайд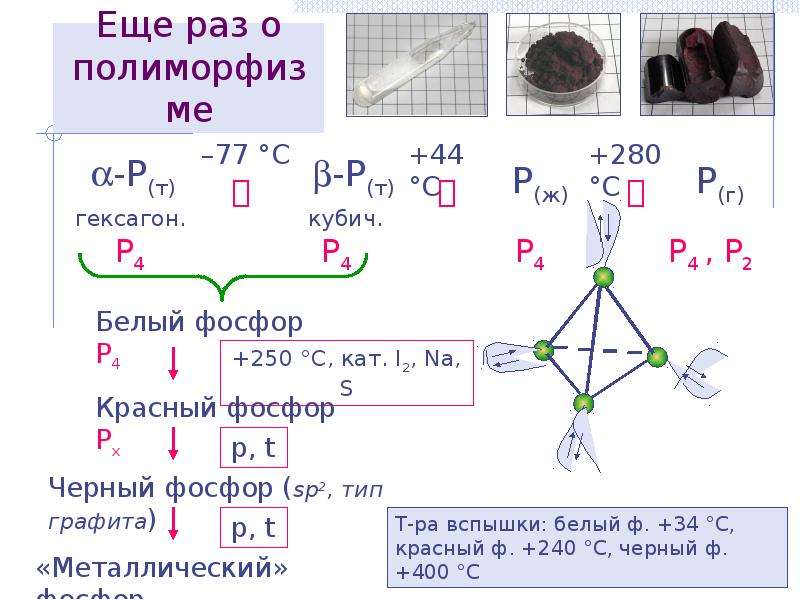
Содержание слайда: Еще раз о
полиморфизме
№16 слайд
Содержание слайда: Дисмутация фосфора в щелочной среде
на холоду:
4P + 3NaOH(разб) + 3H2O = 3NaH2P+IO2 + P–IIIH3
P + 3H2O + 3e = PH3 + 3OH–
P + 2OH– – 1e = H2PO2– (гипофосфит-ион)
при нагревании:
2P + 2NaOH(конц) + H2O = Na2HP+IIIO3 + P–IIIH3
P + 3H2O + 3e = PH3 + 3OH–
P + 5OH– – 3e = HPO33– + 3H2O (фосфит-ион)
Получение
прокаливание фосфорита с углем и песком
2Ca3(PO4)2 + 10C + 6SiO2 = 2P2 + 10CO + 6CaSiO3
№17 слайд
Содержание слайда: Фосфиды
№18 слайд
Содержание слайда: Фосфин PH3
PH3 (монофосфин) – ядовитый газ с отвратительным запахом.
P2H4 (дифосфин) – аналог гидразина.
Получение:
Zn3P2 + 6H2O =
= 2PH3 + 3Zn(OH)2
PH4I + H2O = PH3 + HI
Реакции дисмутации в р-ре щелочи
Восст. свойства:
8AgNO3 + PH3 + 4H2O =
= 8Ag + H3PO4 + 8HNO3
№19 слайд
Содержание слайда: Кислородные кислоты
Фосфорноватистая (фосфоновая) к-та, одноосновная
H(PH2O2) + H2O (PH2O2) + H3O+; KK = 7,94·10–2
Фосфористая (фосфиновая) к-та, двухосновная
H2(PHO3) + H2O H(PHO3) + H3O+; KK = 1,00·10–2
H(PHO3)– + H2O (PHO3)2 + H3O+; KK = 2,57·10–7
Ортофосфорная к-та, трехосновная
H3PO4 + H2O H2PO4 + H3O+; KK = 7,24·10–3
H2PO4 + H2O HPO42 + H3O+; KK = 6,17·10–8
HPO42 + H2O PO43 + H3O+; KK = 4,57·10–13
Дифосфорная к-та H4P2O7
Полиметафосфорная к-та (HPO3)x
№20 слайд
Содержание слайда: Строение кислородных кислот: sp 3
№21 слайд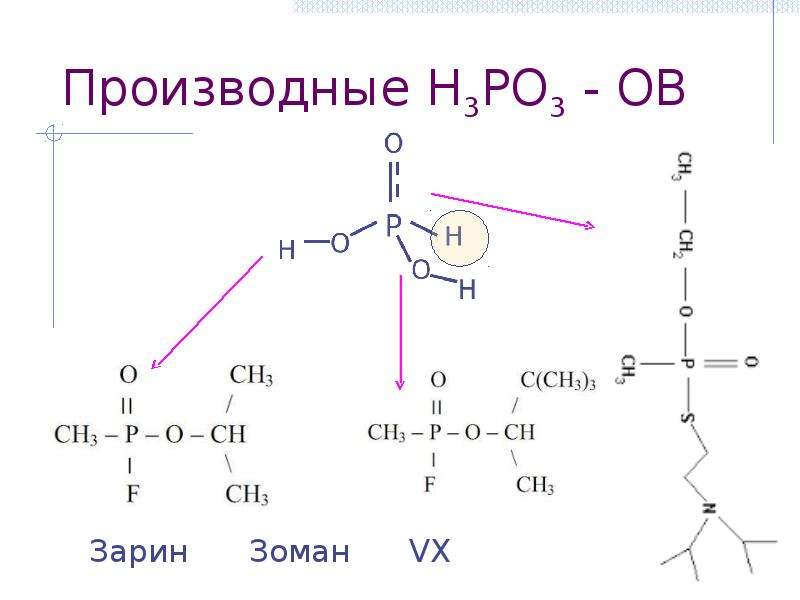
Содержание слайда: Производные H3PO3 - ОВ
№22 слайд
Содержание слайда: Кислородные кислоты фосфора
№23 слайд
Содержание слайда: Кислородные кислоты фосфора
№24 слайд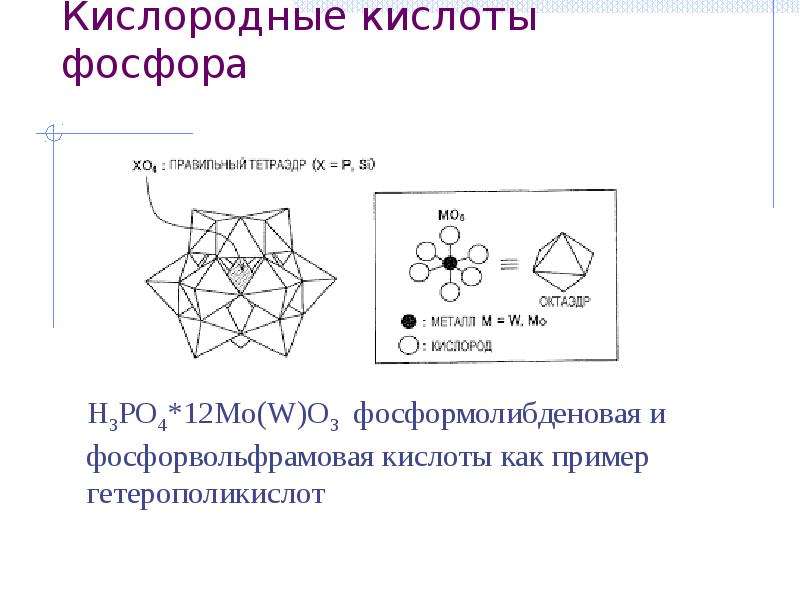
Содержание слайда: Кислородные кислоты фосфора
№25 слайд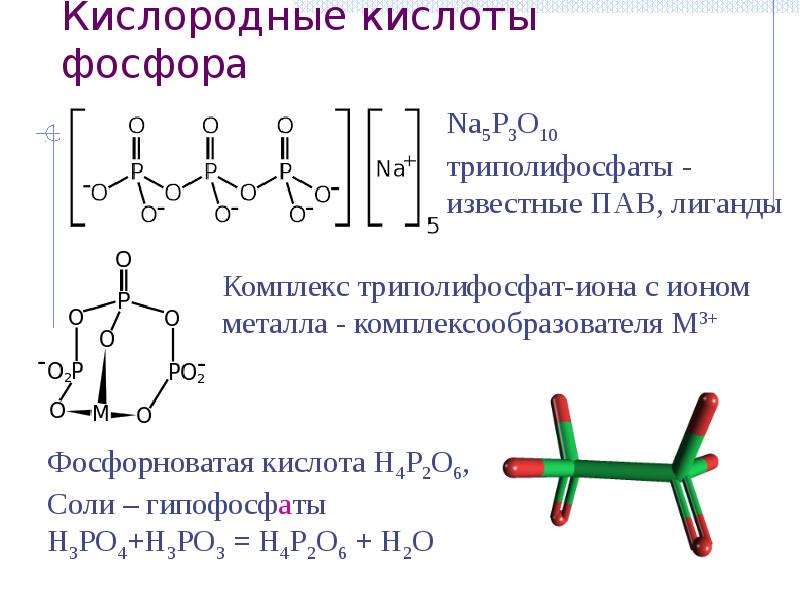
Содержание слайда: Кислородные кислоты фосфора
№26 слайд
Содержание слайда: Строение оксидов: sp 3-гибридизация
№27 слайд
Содержание слайда: Окислительно-восстановительные свойства
рН < 7: H3PO2 + H2O –2e = H3PO3 + 2H+
= –0,49 В
рН > 7: H2PO2 + 3 OH –2e = HPO32 + 2H2O
= –1,57 В
рН < 7: H3PO3 + H2O –2e = H3PO4 + 2H+
= –0,28 В
рН > 7: HPO32 + 3 OH –2e = PO43 + 2H2O
= –1,12 В
Пример:
H3PO3 + 2AgNO3 + H2O = H3PO4 + 2Ag + 2HNO3 разб
№28 слайд
Содержание слайда: Разделение сурьмы и висмута (сульфидный метод)
№29 слайд
Содержание слайда: Особенности химии висмута






































