Презентация Лекция 4. Химическая термодинамика онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Лекция 4. Химическая термодинамика абсолютно бесплатно. Урок-презентация на эту тему содержит всего 41 слайд. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Лекция 4. Химическая термодинамика
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:41 слайд
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:3.59 MB
- Просмотров:63
- Скачиваний:2
- Автор:неизвестен
Слайды и текст к этой презентации:
№3 слайд


Содержание слайда: Системой называют отдельное тело или группу тел, фактически или мысленно отделенных от окружающей среды.
Системой называют отдельное тело или группу тел, фактически или мысленно отделенных от окружающей среды.
Окружающая среда – это все, что находится в прямом или косвенном контакте с системой.
№5 слайд


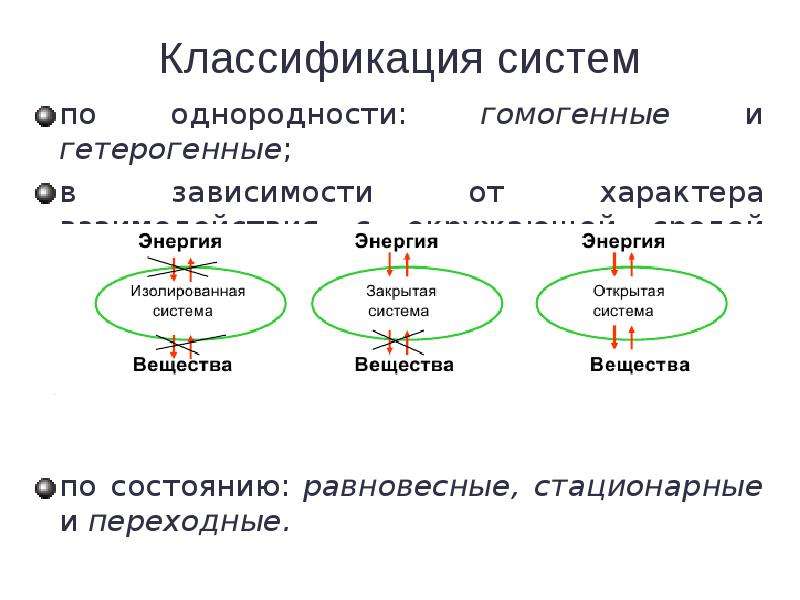
Содержание слайда: Т/д равновесное состояние характеризуется постоянством всех свойств во времени и отсутствием потока вещества и энергии в системе.
Т/д равновесное состояние характеризуется постоянством всех свойств во времени и отсутствием потока вещества и энергии в системе.
Стационарное состояние характеризуется постоянством свойств во времени и непрерывным обменом веществом и энергией между системой и окружающей средой.
Переходное состояние характеризуется изменением свойств системы во времени.
№6 слайд


Содержание слайда: Совокупность всех физических и химических свойств системы называют состоянием системы.
Совокупность всех физических и химических свойств системы называют состоянием системы.
Его характеризуют термодинамическими параметрами, которые бывают:
Интенсивными – параметры, которые не зависят от массы (температура, давление, плотность, концентрация).
Параметры, зависящие от массы, называют экстенсивными (объём, масса, внутренняя энергия, энтальпия, энтропия, термодинамические потенциалы).
№8 слайд


Содержание слайда: Внутренняя энергия
Внутренняя энергия (U) характеризует общий запас энергии системы. Она включает все виды энергии движения и взаимодействия частиц, составляющих систему.
Измерить U нельзя, поскольку невозможно лишить материю движения. Можно оценить лишь изменение внутренней энергии (U): U=Uкон-Uнач
Внутренняя энергия – функция состояния, т.е. не зависит от пути процесса, а только от начального и конечного состояния.
Экстенсивная величина [Дж/моль].
№9 слайд


Содержание слайда: Теплота и работа
Теплота (Q) - неупорядоченный (хаотический) вид передачи энергии.
Работа (W) - упорядоченный (организованный) вид передачи энергии.
Экстенсивные параметры [Дж/моль].
Работа и теплота связаны с процессом и являются функциями процесса, зависят от пути процесса.
№11 слайд


Содержание слайда: Формулировки
1.Энергия не исчезает бесследно и не возникает из ничего, переход ее из одного вида в другой происходит в строго эквивалентных количествах.
2.Энергия изолированной системы постоянна.
3. Вечный двигатель I рода невозможен, под которым подразумевается машина, производящая работу без затраты энергии.
№15 слайд


Содержание слайда: Следствия из закона Гесса.
1. Нr 298 =νi H0f 298(прод) - νiH0f 298(исх)
Стандартной энтальпией образования соединения называют изменение энтальпии (или тепловой эффект) в процессе образования одного моля данного вещества из простых веществ в стандартных условиях.
Стандартные энтальпии образования простых веществ в устойчивом агрегатном состоянии равны нулю.
№16 слайд


Содержание слайда: 2. Нr 298 =νi H0f 298(исх) -νi H0f 298(прод)
2. Нr 298 =νi H0f 298(исх) -νi H0f 298(прод)
Стандартной энтальпией сгорания называют изменение энтальпии в процессе полного сгорания в атмосфере кислорода одного моля вещества до высших оксидов в стандартных условиях при выбранной температуре.
Стандартные энтальпии сгорания высших оксидов в устойчивых состояниях равны нулю.
№18 слайд


Содержание слайда: I закон термодинамики дает данные лишь о тепловыделении и говорит о превращении одной формы энергии в другую.
I закон термодинамики дает данные лишь о тепловыделении и говорит о превращении одной формы энергии в другую.
Второй закон термодинамики дает возможность определить направление самопроизвольного процесса и пределы его протекания.
В термодинамическом смысле, самопроизвольный – это такой процесс, который совершается без внешних воздействий на систему.
№19 слайд


Содержание слайда: Новая функция состояния:
Новая функция состояния:
энтропия (S, Дж/моль·К) – мера беспорядка системы. Является критерием направленности процессов в изолированной системе: самопроизвольные процессы происходят в направлении увеличения энтропии системы: dS > 0 .
Формулировки второго закона термодинамики:
Теплота не может самопроизвольно переходить от более холодного тела к более горячему (Клаузиус).
Осуществление вечного двигателя II рода невозможно. Под вечным двигателем второго рода подразумевают тепловую машину, превращающую всю теплоту в работу, т.е. без передачи части ее холодильнику (В.Оствальд).
№21 слайд


Содержание слайда: Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса, называются экзэргоническими реакциями.
Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса, называются экзэргоническими реакциями.
Биохимические реакции, сопровождающиеся увеличением энергии Гиббса, называются эндэргоническими, и они не возможны без внешнего подвода энергии.
В живых организмах эндэргонические реакции происходят за счет их сопряжения с экзэргоническими реакциями.
№25 слайд


Содержание слайда: Закон действующих масс для скоростей
Скорость химической реакции пропорциональна произведению концентраций всех реагентов в соответствующих степенях:
для реакции аА + bВ сС + dD
где k – константа скорости реакции, зависящая от природы реагентов, катализатора и температуры реакции. Физический смысл k: равна скорости при единичных концентрациях реагентов.
№26 слайд


Содержание слайда: Молекулярность реакции определяется числом молекул (частиц), участвующих в элементарном акте реакции.
Молекулярность реакции определяется числом молекул (частиц), участвующих в элементарном акте реакции.
По молекулярности различают реакции:
Одномолекулярные: А → В;
Бимолекулярные: 2А → В; А + В С ;
Тримолекулярные: 3А → В; А + 2В С .
Порядок реакции характеризует зависимость скорости от концентрации и определяется как сумма показателей степеней при концентрациях, входящих в кинетическое уравнение.
Для простых реакций порядок и молекулярность совпадают.
Молекулярность – целое число,
Порядок реакции может быть любым, даже дробным.
№31 слайд


Содержание слайда: Энергия активации
Энергия активации Еак – величина, показывающая тот необходимый избыток энергии выше средней, которым должны обладать молекулы, чтобы реакция была возможной.
Энергия активации
Зависит:
- от природы реагирующих веществ,
-катализатора.
Не зависит от температуры.
№34 слайд


Содержание слайда: Катализ бывает:
Положительный и отрицательный, (когда скорость реакции уменьшается, в таком случае катализатор называют ингибитором).
Гетерогенный (когда реагирующие вещества и катализатор находятся в разных фазах) и гомогенный.
Автокатализ – когда катализатором служит одно из исходных веществ, или один из продуктов реакции.
№37 слайд


Содержание слайда: Специфические свойства ферментов
Размер. Относительная молекулярная масса ферментов составляет от 105 до 107, поэтому ферменты выделяют в самостоятельный класс ультрамикрогетерогенных катализаторов.
Высокая каталитическая эффективность. Каталитическая активность ферментов превышает активность других катализаторов в тысячи раз.
№38 слайд


Содержание слайда: Высокая специфичность. Под специфичностью фермента понимается его свойство изменять скорость реакций одного типа и не влиять на многие другие реакции, протекающие в клетке.
Высокая специфичность. Под специфичностью фермента понимается его свойство изменять скорость реакций одного типа и не влиять на многие другие реакции, протекающие в клетке.
Необходимость строго определенных условий: определенная температура (36 – 38 С) и определенное значение рН.
№40 слайд
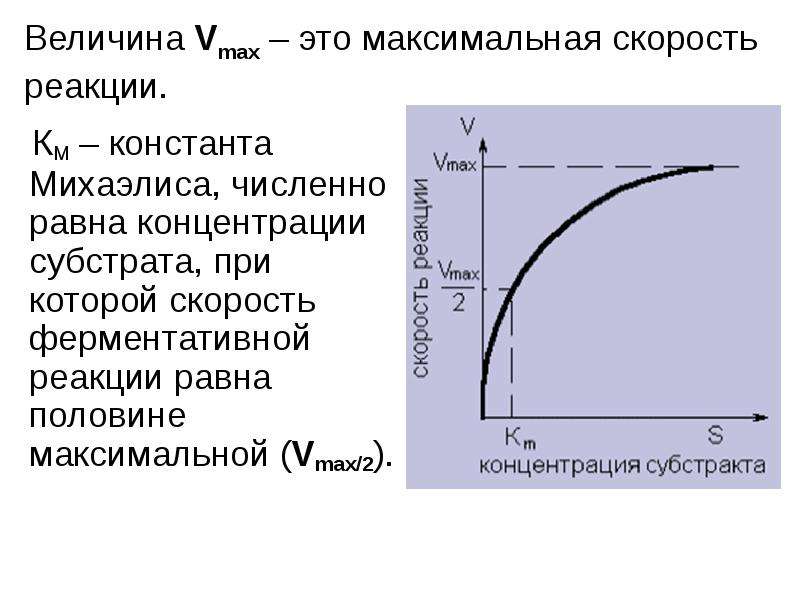

Содержание слайда: КМ – константа Михаэлиса, численно равна концентрации субстрата, при которой скорость ферментативной реакции равна половине максимальной (Vmax/2).
КМ – константа Михаэлиса, численно равна концентрации субстрата, при которой скорость ферментативной реакции равна половине максимальной (Vmax/2).
Скачать все slide презентации Лекция 4. Химическая термодинамика одним архивом:
Похожие презентации
-
 Основы химической термодинамики и термохимии. Лекция 3
Основы химической термодинамики и термохимии. Лекция 3 -
 Термодинамика химических процессов. Лекция 01-1
Термодинамика химических процессов. Лекция 01-1 -
 Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) -
 Понятия и определения химической термодинамики. (Лекция 11)
Понятия и определения химической термодинамики. (Лекция 11) -
 Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2)
Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2) -
 Химическая термодинамика. (Лекция 4)
Химическая термодинамика. (Лекция 4) -
 Химия. Лекция 1. Элементы химической термодинамики и биоэнергетики
Химия. Лекция 1. Элементы химической термодинамики и биоэнергетики -
 Почему протекают химические реакции Начала термодинамики Автор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А. М. Гор
Почему протекают химические реакции Начала термодинамики Автор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А. М. Гор -
 СОВРЕМЕННЫЕ ПРОБЛЕМЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Лекция 1
СОВРЕМЕННЫЕ ПРОБЛЕМЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Лекция 1 -
 Электролитическая диссоциация химических элементов Урок - лекция
Электролитическая диссоциация химических элементов Урок - лекция