Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
28 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
1.34 MB
Просмотров:
77
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Галогены и их неорганические соединения
Селезенев Р. В.
№2 слайд
Содержание слайда: Фтор
получение
в промышленности получают электролизом расплава гидрофторида калия
в лабораторных условиях – из фторидов металлов в высших степенях окисления
№3 слайд
Содержание слайда: Фтор
химические свойства
при н. у. реагирует со всеми простыми веществами, кроме N2, O2 и легких благородных газов
многие металлы пассивируются фтором
многие реакции соединений азота и кислорода с фтором идут под действием катализаторов
№4 слайд
Содержание слайда: Фториды металлов
химические свойства
фторид серебра (II) применяется для окислительного фторирования (часто вместе с F2)
фторид кобальта (III) – исключительно для фторирования углеводородов
фториды Zn, Sb (III), Pb (II) – мягкие фторирующие агенты
фторидами ЩМ фторируют в полярных неводных растворителях (например, MeCN)
№5 слайд
Содержание слайда: Фториды кислорода
получение
OF2 получают электролизом плавиковой кислоты или пропусканием фтора через 2% раствор NaOH
O2F2 получается прямым синтезом при УФ облучении
O4F2 получают, пропуская электрический разряд через смесь простых веществ
пропускание смесей O2 и F2 различного состава через тлеющий разряд возможно приводит к полуxению O3F2, O5F2, O6F2
№6 слайд
Содержание слайда: Фториды кислорода
свойства
OF2 – мощный фторирующий агент
O2F2 неустойчив, разлагается на простые вещества при -78°С
используется как низкотемпературный фотрирующий агент
O4F2 неустойчив, разлагается при – 183°С
№7 слайд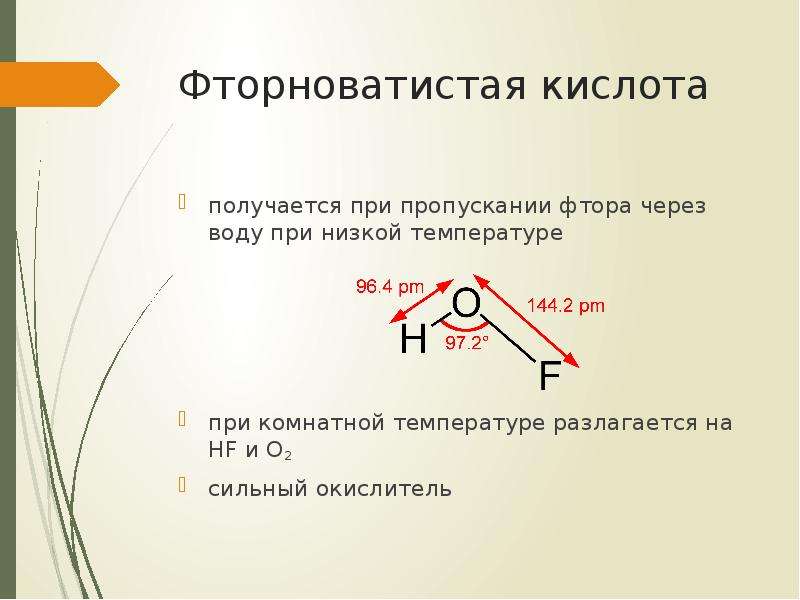
Содержание слайда: Фторноватистая кислота
получается при пропускании фтора через воду при низкой температуре
при комнатной температуре разлагается на HF и O2
сильный окислитель
№8 слайд
Содержание слайда: Межгалогенные соединения (интергалогениды)
Галогены образуют соединения друг с другом в четырех стехиометрических соотношениях:
XY
XY3
XY5
XY7
… а также тройные соединения
№9 слайд
№10 слайд
Содержание слайда: Межгалогенные соединения
физические свойства
№11 слайд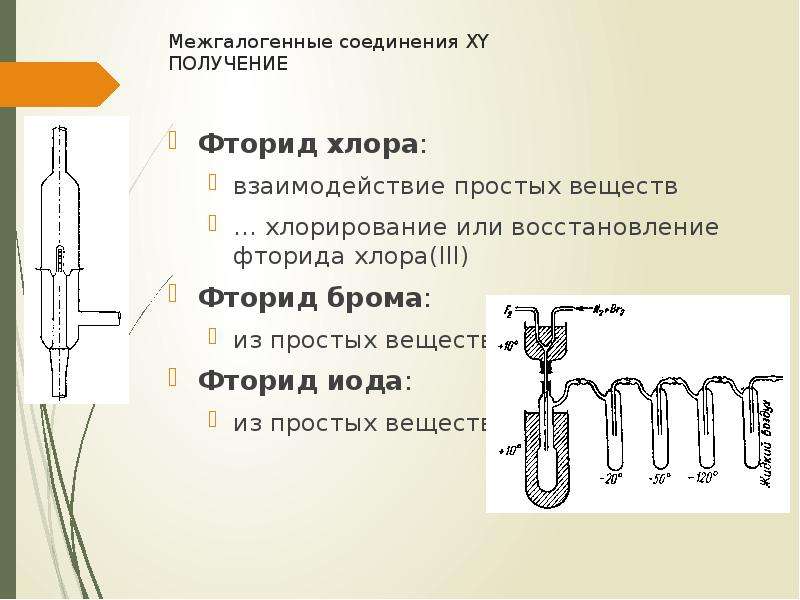
Содержание слайда: Межгалогенные соединения XY
получение
Фторид хлора:
взаимодействие простых веществ
… хлорирование или восстановление фторида хлора(III)
Фторид брома:
из простых веществ
Фторид иода:
из простых веществ
№12 слайд
Содержание слайда: Межгалогенные соединения XY
получение
Хлорид брома:
из простых веществ
Хлорид иода:
из простых веществ
хлорирование иодидов
действие окислителей в присутствие Cl- на I-
взаимодействие хлоридов с кислородными соединениями иода в кислой среде
окисление иода соединениями хлора
восстановление трихлорида иода иодом
Бромид иода:
из простых веществ
реакция хлорида иода с бромидом серы
№13 слайд
Содержание слайда: Межгалогенные соединения XY3
получение
Трифторид хлора:
из простых веществ
из фторида хлора
Трифторид брома:
из простых веществ
Трифторид иода:
из простых веществ
окисление иода фторидом ксенона
Гексахлорид дииода:
из простых веществ
№14 слайд
Содержание слайда: Межгалогенные соединения XY5
получение
Пентафторид хлора:
из простых веществ
из трифторида
фторирование хлоридов ЩМ
Пентафторид брома:
из простых веществ
фторирование бромидов ЩМ
Пентафторид иода:
из простых веществ
№15 слайд
Содержание слайда: Межгалогенные соединения XY7
получение
Гептафторид иода:
из простых веществ
фторирование иодидов
№16 слайд
Содержание слайда: Межгалогенные соединения
химические свойства
сильные окислители
подвергаются гидролизу
№17 слайд
№18 слайд
Содержание слайда: Электролиз межгалогенных соединений
№19 слайд
Содержание слайда: Межгалогенные соединения
химические свойства
реакционная способность увеличивается в рядах:
IFn BrFn ClFn
BrF BrF3 BrF5
IF IF3 BrF IF5 BrF3 ClF IF7 BrF5 ClF5 ClF3
№20 слайд
Содержание слайда: Фториды азота
Существует пять фторидов NF3, N2F4, цис- и транс-N2F2, N3F
Первый NF3 был получен только в 1928 г. Отто Руффом в Германии электролизом расплава NH4F/HF
Второй способ получения – фторирование аммиака
NF3 – газ без цвета и запаха
Нереакционноспособный, не разлагается водой, р-рами кислот и щелочей
Является фторирующим агентом
FN3 – один из самых взрывчатых ковалентных азидов
Получается при взаимодействии азидоводорода и фтора
№21 слайд
Содержание слайда: Фториды азота
N2F4 – бесцветный реакционноспособный газ
Получается при частичном дефторировании трифторида
… окислением NF2H
Является сильным фторирующим агентом
Образует аддукты
N2F2 получают из NF2H или N2F4
№22 слайд
Содержание слайда: Фториды азота
№23 слайд
Содержание слайда: Хлорид, бромид и иодид азота
NCl3 - густая летучая желтоватая крайне взрывчатая жидкость, т. пл. = -40°С, т. к. = 71°С
Применяют в разбавленном газообразном виде для отбеливания и дезинфекции муки
Получают хлорированием хлорида аммония
NBr3 – летучее твердое вещество темно-красного цвета
Получается бромированием бис(триметилсилил)бромамина хлоридом брома
NI3 – очень взрывчатое вещество, стабилен до 77К
Получают реакцией фторида иода с нитридом бора в фреоне
В виде аддукта – реакцией иода с аммиаком
№24 слайд
Содержание слайда: Псевдогалогениды
К псевдогалогенидам относят ионы CN-, N3-, NCO-, CNO-, SCN-, SeCN-, N(CN)2-, C(CN)3-
К псевдогаглогенам относят (CN)2, (NCS)2, (NCO)2, (NCSe)2
Если псевдогалогеноводороды растворить в воде, то образуются псевдогалогенид-ионы. Такие растворы называют псевдогалогеноводородными кислотами
У них выраженная склонность к образованию лигандных мостиков
№25 слайд
Содержание слайда: Дициан
Легковоспламеняющийся бесцветный высокотоксичный газ
Образуется при горении угля в электрической дуге в атмосфере азота
… при нагревании цианидов ртути или серебра
… смеси желтой кровяной соли с сулемой
… сухой перегонкой оксалата аммония в присутствии оксида фосфора(V)
… пропусканием сухого циановодорода над нагретым до 250°С пиролюзитом
… при окислении циановодорода воздухом на серебряном катализаторе
… при окислении циановодорода хлором на активированном угле
№26 слайд
Содержание слайда: Дициан
В чистом виде устойчив, но при наличии примесей при 300-500°С полимеризуется до парациана
№27 слайд
Содержание слайда: Дитиоциан
Получается при действии иода или брома на тиоцианат сербра в диэтиловом эфире или тетрахлорметане соответственно
Химическое или электрохимическое окисление тиоцианат иона
Дитиоциан неустойчив и полимеризуется, образуя оранжевый (SCN)x
Водные растворы дитиоциана разлагаются
Подобно иоду реагирует с тиосульфатом натрия, сероводородом
№28 слайд
Содержание слайда: Псевдогалогеноводородные кислоты
По свойствам напоминают галогеноводородные
Слабые кислоты:





































