Презентация Общая и неорганическая химия. Введение онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Общая и неорганическая химия. Введение абсолютно бесплатно. Урок-презентация на эту тему содержит всего 76 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Общая и неорганическая химия. Введение
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:76 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:5.10 MB
- Просмотров:65
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№3 слайд


Содержание слайда: ВВЕДЕНИЕ
ЦЕЛИ КУРСА
создать основу для дальнейшего изучения химических дисциплин, сформировать элементарные навыки работы в химической лаборатории
СОДЕРЖАНИЕ КУРСА
основные понятия и законы химии;
теория строения атома и образования химических связей в молекулах;
классы неорганических соединений;
общие закономерности протекания химических реакций, в том числе элементы химической термодинамики и химической кинетики;
основы теории растворов электролитов и неэлектролитов, закономерности окислительно-восстановительных и электрохимических процессов
типовые расчетные задачи
элементарные лабораторные навыки
№5 слайд


Содержание слайда: Происхождение термина “химия”
Есть несколько версий:
от египетского слова "Хем" - арабского названия этой страны - "египетская наука".
из греческого χυμος ("хюмос"), которое можно перевести как "сок растения".
от другого греческого слова - χυμα ("хюма"), означающего "литье", "сплав - это искусство литья выплавки металлов, то есть металлургии.
№6 слайд


Содержание слайда: Периодизация истории химии
Выделялют 2 основных основных периода:
а) эмпирический (с древности до XVIIIв);
процесс познания через эксперимент.
б) теоретический. (XVIII – по н.в.)
В XVIII столетии все большее внимание ученые стали уделять осмыслению полученных опытных данных, попыткам объяснить их при помощи единой умозрительной концепции.
№7 слайд


Содержание слайда: Основные периоды в истории химии
1. Период алхимии - с древности до XVI в. нашей эры. (создание основ рациональной фармации, обучение правилам приготовления целебных препаратов, а также составление списка лекарств).
2. Период зарождения научной химии (XVI - XVIII век).
3. Период открытия основных законов химии - конец XVIII - первая половина XIX века
4. Современный период с 60-х годов XIX века до наших дней.
Разработаны периодическая классификация элементов, теория химического строения и стереохимия, теория электролитической диссоциации Аррениуса и т.д.
№12 слайд


Содержание слайда: Период научной химии XIX—XX вв
За открытым Лавуазье законом сохранения массы последовал целый ряд новых количественных закономерностей — стехиометрические законы:
Закон эквивалентов (И. В. Рихтер, 1791—1798)
Закон постоянства состава (Ж. Л. Пруст, 1799—1806)
Закон кратных отношений (Дж. Дальтон, 1803)
Закон объёмных отношений, или закон соединения газов (Ж. Л. Гей-Люссак, 1808)
Закон Авогадро (А. Авогадро, 1811)
Закон удельных теплоёмкостей (П. Л. Дюлонг и А. Т. Пти, 1819)
Законы электролиза (М. Фарадей, 1830-е гг.)
Закон постоянства количества теплоты (Г. Гесс, 1840)
№20 слайд


Содержание слайда: Дмитрий Иванович Менделеев
Менделеев оставил свыше 500 печатных трудов, среди которых классические «Основы химии» — первое стройное изложение неорганической химии.
Открытый в 1869 Периодический закон химических элементов — получил всеобщее признание, позволил ученым предвидеть новые открытия и систематизировать накапливающийся экспериментальный материал.
№25 слайд
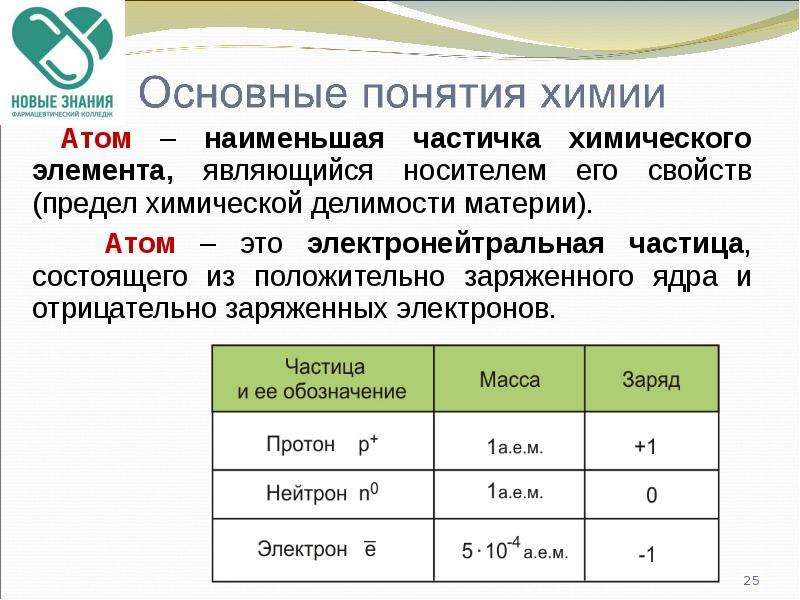

Содержание слайда: Атом – наименьшая частичка химического элемента, являющийся носителем его свойств (предел химической делимости материи).
Атом – наименьшая частичка химического элемента, являющийся носителем его свойств (предел химической делимости материи).
Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и отрицательно заряженных электронов.
№36 слайд


Содержание слайда: Основные понятия химии
Широко используются несколько видов химических формул:
Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых находятся частицы, образующие данное вещество.
Молекулярная (истинная) формула показывает качественный состав и число составляющих вещество частиц, но не показывает порядок связей частиц в веществе, т. е. его структуру.
Графическая формула отражает порядок соединения атомов, т. е. связи между ними.
№37 слайд


Содержание слайда: Что обозначают записи?
H2- это одна молекула водорода, в её состав входят два атома водорода.
5O2 - это пять молекул кислорода, в состав одной молекулы входят два атома кислорода.
6Fe - это шесть атомов железа.
3H2SO4 - это три молекулы серной кислоты, в состав одной молекулы серной кислоты входят два атома водорода, один атом серы, четыре атома кислорода.
№39 слайд


Содержание слайда: Атомная единица массы (а.е.м.) - внесистемная единица массы.
Атомная единица массы (а.е.м.) - внесистемная единица массы.
Атомная единица массы – это единица массы, равная 1/12 массы атома изотопа углерода 12С
m(С) = 1,99·10-26 кг
1/12 m(C) = 1/12 x 1,99·10-26 кг = 1,66·10-27 кг = 1,66·10-24 г
1 а.е.м. = 1,66·10-27 кг = 1,66·10-24 г
1 а.е.м. ≈ массе протона или нейтрона
№40 слайд


Содержание слайда: Относительная атомная масса элемента Ar
Относительная атомная масса элемента Ar
Относительная атомная масса элемента показывает во сколько раз масса его атома больше 1/12 массы атома углерода.
Например:
Аr(S) = 32, т.е. атом серы в 32 раза тяжелее 1/12 массы атома углерода.
№44 слайд


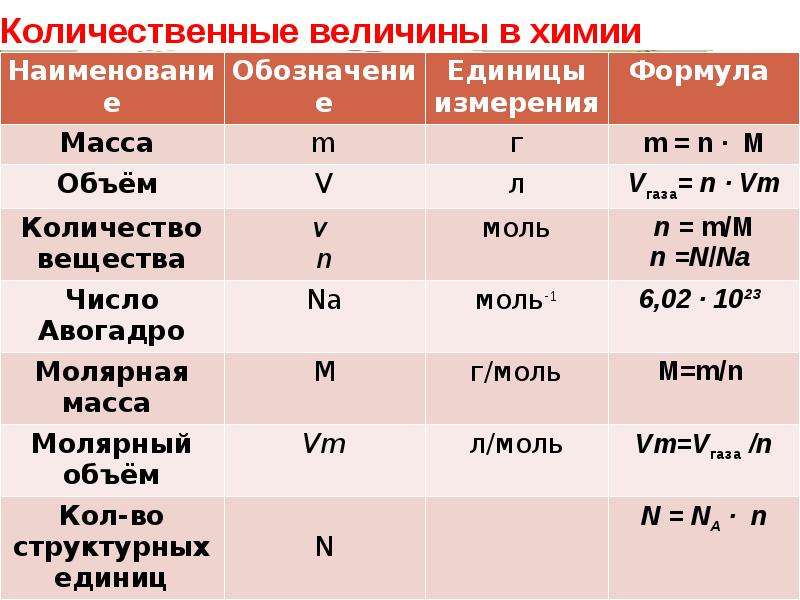
Содержание слайда: Количество вещества
В Международной системе СИ за единицу количества вещества принят моль.
МОЛЬ - это количество вещества (n), которое содержит 6,02.1023 структурных единиц (атомов, молекул, ионов) данного вещества (6,02·1023 частиц, число Авогадро NA )
1 моль атомов Н, 1 моль молекул Н2
№46 слайд


Содержание слайда: Основные понятия химии
Постоянная Авогадро ( ) – число атомов или молекул (или других структурных единиц), содержащихся в одном моле вещества
При решении химических задач нужно знать, сколько структурных частиц (N) вещества содержится в определённом количестве вещества.
N = NA · n
№48 слайд


Содержание слайда: Молярная масса (М)
– масса 1 моля вещества в граммах
[М] = [г/моль]
Молярная масса численно равна относительной молекулярной массе
М = Мr
Мr (Н2О) = 18,0152 а.е.м.
М(Н2О) = 18,0152 г/моль
Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро
М = NA · m0
mв-ва = n · M
№53 слайд


Содержание слайда: Основные законы химии
Закон объемных отношений
Следствие.
Стехиометрические коэффициенты в уравнениях химических реакций для газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
2CO + O2 = 2CO2
2 объема CO реагируют с 1 объемом O2 и получается 2 объема CO2
№54 слайд


Содержание слайда: Основные законы химии
Закон постоянства состава вещества.
Сформулирован Ж.-Л. Прустом в 1799 г..
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Однако уже в начале XIX в. К. Бертолле показал, что элементы могут соединятся друг с другом в разных соотношениях в зависимости от массы реагирующих веществ.
№55 слайд


Содержание слайда: Основные законы химии
Современная формулировка закона постоянства состава вещества таков:
Состав соединений молекулярной структуры является постоянным независимо от способа их получения.
Состав соединений немолекулярной структуры (с атомной, ионной или металлической кристаллической решеткой) не является постоянным и зависит от способа их получения.
№56 слайд


Содержание слайда: Основные законы химии
Соединения постоянного состава - дальтониды (в память английского химика и физика Дальтона).
Состав выражается простыми формулами с целочисленными стехиометрическими индексами, например:
Н2О, НCl, ССl4, СO2
Соединения переменного состава - бертоллиды (в память французского химика Бертолле).
Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям, например
FeSx, где 1,02 < x < 1,10
№64 слайд


Содержание слайда: Роль химии в жизни современного общества очень велика. Она проникла во все сферы деятельности человека.
Фундаментальные законы химии применяются в науке, технике и медицине, а также во всех отраслях промышленности. В их числе металлургия, целлюлозно-бумажная, строительная, нефтеперерабатывающая.
Химическая промышленность развивается в настоящее время гораздо быстрее, чем любая другая, и в наибольшей степени определяет научно-технический прогресс.
№72 слайд


Содержание слайда: Значение общей и неорганической химии
В подготовке провизоров общая и неорганическая химия являются теоретической базой для изучения химических и прикладных дисциплин, в частности биохимии, фармацевтической химии, технологии лекарств, физико-химических методов анализа и др.
№75 слайд


Содержание слайда: Список используемой литературы
О.С. Габриелян, И.Г. Остроумов, Е.Е. Остроумова, С.А. Сладков. Химия для профессий и специальностей естественнонаучного профиля. Учебник. 3-е издание. М:. издательский центр «Академия», 2014г.
Бабков Александр Васильевич. Общая и неорганическая химия: учебник / А. В. Бабков, Т. И. Барабанова, В. А. Попков. - М. : ГЭОТАР-Медиа, 2013. - 384 с. : ил.
Скачать все slide презентации Общая и неорганическая химия. Введение одним архивом:
Похожие презентации
-
 Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения
Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения -
 Общая и неорганическая химия. Лекция 21 Общая характеристика элементов VА-группы. Азот
Общая и неорганическая химия. Лекция 21 Общая характеристика элементов VА-группы. Азот -
 Общая и неорганическая химия
Общая и неорганическая химия -
 Физические явления в химии НЕОРГАНИЧЕСКАЯ ХИМИЯ 8 КЛАСС УЧИТЕЛЬ ХИМИИ: Т. А. КОМАРОВА
Физические явления в химии НЕОРГАНИЧЕСКАЯ ХИМИЯ 8 КЛАСС УЧИТЕЛЬ ХИМИИ: Т. А. КОМАРОВА -
 Химия элементов. Лекция 11 Общая характеристика элементов VIБ-группы. Хром
Химия элементов. Лекция 11 Общая характеристика элементов VIБ-группы. Хром -
 Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне Ким Елена Петро
Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне Ким Елена Петро -
 Раздел: Неорганическая химия 8 класс Автор учебника О. С. Габриелян (базовый уровень) Учитель химии МОУ «Лебяжьевская средня
Раздел: Неорганическая химия 8 класс Автор учебника О. С. Габриелян (базовый уровень) Учитель химии МОУ «Лебяжьевская средня -
 По Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть
По Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть -
 Неорганическая химия Сероводород
Неорганическая химия Сероводород -
 ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА»
ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА»