Презентация Органическая химия. Алифатические углеводороды онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Органическая химия. Алифатические углеводороды абсолютно бесплатно. Урок-презентация на эту тему содержит всего 31 слайд. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Органическая химия. Алифатические углеводороды
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:31 слайд
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:3.25 MB
- Просмотров:97
- Скачиваний:0
- Автор:неизвестен
Слайды и текст к этой презентации:
№2 слайд


Содержание слайда: План
План
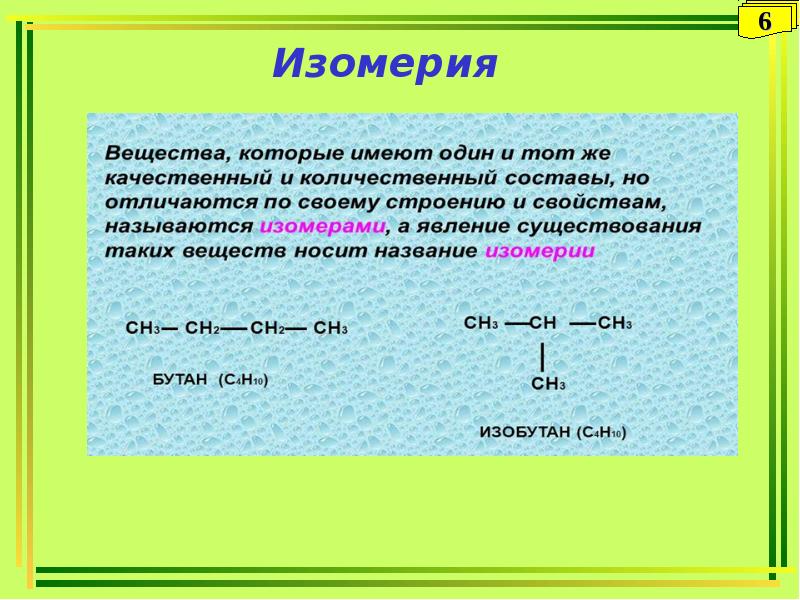
1. Введение в органическую химию. Теория строения А.М. Бутлерова. Основные понятия: гомологи, изомеры, радикалы, функциональные группы, индуктивный и мезомерный эффекты.
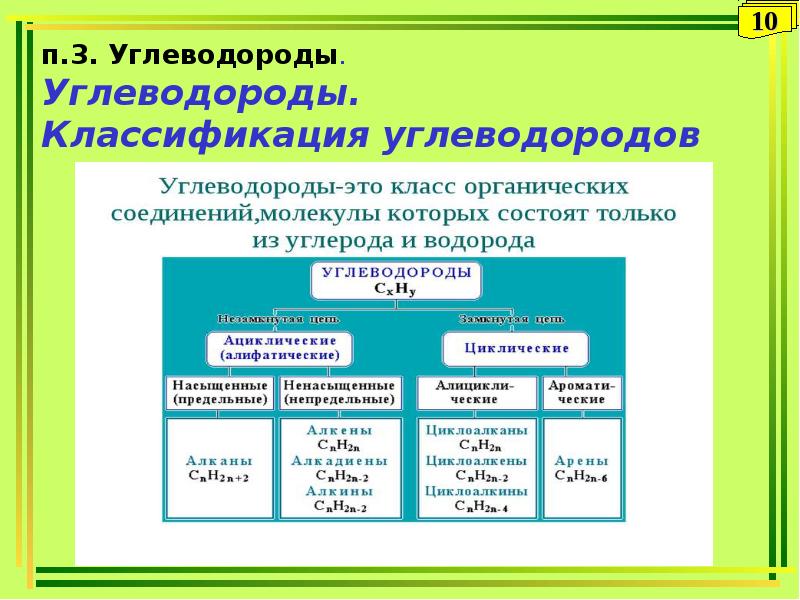
2. Классификация органических веществ.
3. Углеводороды:
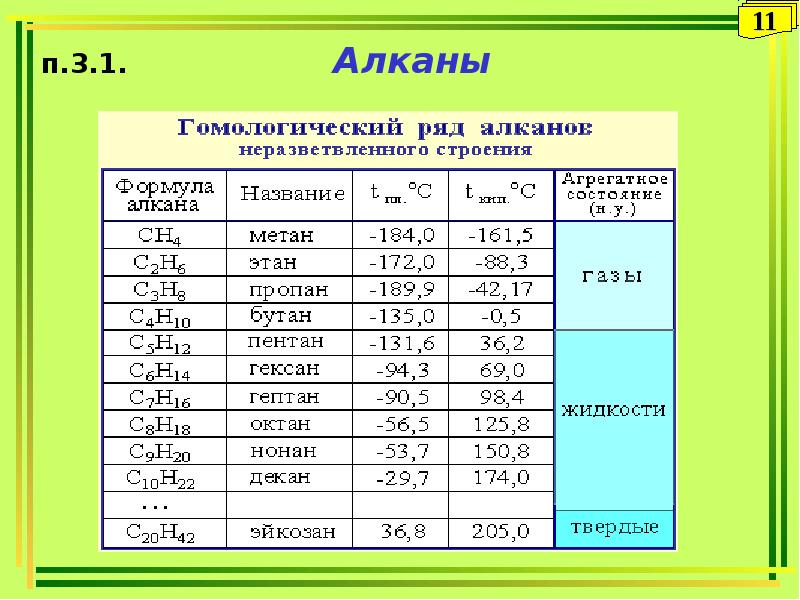
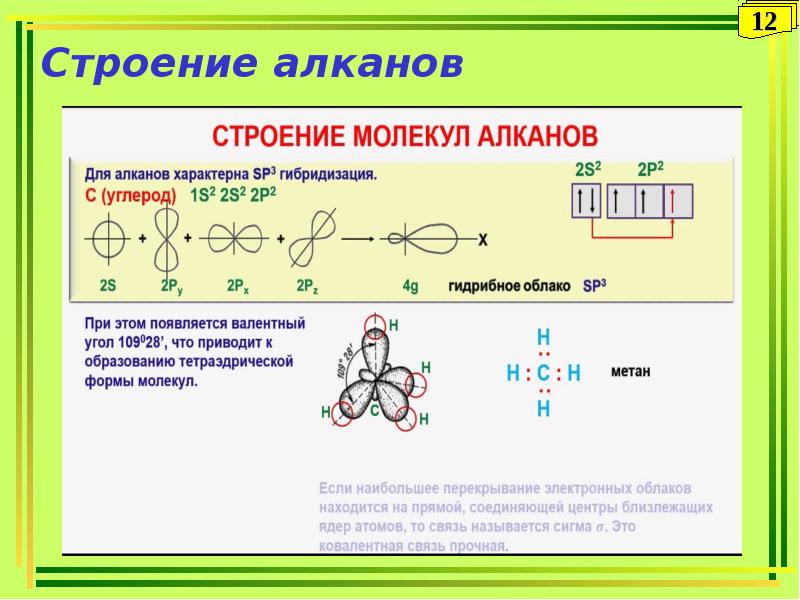
3.1. Предельные углеводороды (алканы).
3.2. Этиленовые углеводороды (алкены).
3.3. Алкадиены.
3.4. Алкины.
№3 слайд


Содержание слайда: п.1. Введение в органическую химию. Теория строения А.М. Бутлерова. Основные понятия: гомологи, изомеры, радикалы, функциональные группы, индуктивный и мезомерный эффекты.
п.1. Введение в органическую химию. Теория строения А.М. Бутлерова. Основные понятия: гомологи, изомеры, радикалы, функциональные группы, индуктивный и мезомерный эффекты.
Органическая химия – химия углеводородов и их производных.
Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н (СН4, С4Н10).
Производные УВ – продукты замещения атомов «Н» в молекулах УВ на другие атомы или группы атомов.
№5 слайд


Содержание слайда: Теория строения органических веществ А.М. Бутлерова
1. Атомы в молекулах соединены друг с другом не беспорядочно, а в определенной последовательности, согласно их валентности.
2. Свойства веществ зависят не только от того, атомы каких элементов и в каком количестве входят в состав молекул, но и от последовательности соединения атомов в молекулах, т.е. от их химического строения.
3. Атомы или группы атомов, входящих в состав молекулы, взаимно влияют друг на друга. Это взаимное влияние определяет свойства веществ.
4. Строение молекул может быть установлено на основе изучения их химических свойств. И наоборот: зная строение вещества, можно предсказать его свойства.
№8 слайд


Содержание слайда: п.2. Классификация органических веществ
Классификация по типу углеродного скелета
В зависимости от строения углеродного скелета органические соединения разделяют на ациклические – соединения с открытой (незамкнутой) углеродной цепью и циклические.
Ациклические соединения могут быть как насыщенными, так и ненасыщенными.
Циклические соединения – соединения с замкнутой цепью – в зависимости от природы атомов, составляющих цикл, делят на карбоциклические и гетероциклические.
Карбоциклические соединения содержат в цикле только атомы углерода и делятся на две существенно различающиеся по химическим свойствам группы: алифатические циклические (сокращенно алициклические) и ароматические. Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов.
№9 слайд


Содержание слайда: Классификация органических веществ (продол.)
Классификация по типу функциональной группы
В большинстве органических соединений, кроме атомов углерода и водорода, содержатся атомы других элементов (не входящие в скелет). Эти атомы или их группировки, во многом определяющие физические и химические свойства органических соединений, называют функциональными группами.
Важнейшие функциональные группы:
−F, −Cl, −Br, −I (галоген) галогенпроизводные
−OH (гидроксил) спирты, фенолы
>C=O (карбонил) альдегиды, кетоны
−COOH (карбоксил) карбоновые кислоты
−NH2, >NH, >N− (аминогруппа) амины
−NO2 (нитрогруппа) нитросоединения
−SO3H (сульфогруппа) сульфокислоты
№15 слайд


Содержание слайда: Методы получения алканов
Алканы, как правило, получают разделением природных смесей углеводородов. Лабораторных способов получения немного:
1. Гидрирование алкенов
Сn Н2n + Н2 → Сn H2n+2
2. Взаимодействие галогеналканов с активными металлами (Реакция Вюрца)
2 RBr + 2 Na → R—R + 2 NaBr
3. Термическое декарбоксилирование солей органических кислот t
R−COONa + NaOH → R−H + Na2CO3
№18 слайд


Содержание слайда: Непредельные углеводороды
Непредельные, или ненасыщенные, УВ содержат кратные углерод- углеродные связи
(двойные, тройные)
Непредельными называются углеводороды, в молекулах которых имеются атомы углерода, связанные между собой двойными или тройными связями. Их также называют ненасыщенными углеводородами, так как их молекулы имеют меньшее число атомов водорода, чем насыщенные.
№21 слайд


Содержание слайда: Методы получения алкенов
1. Дегидрирование алканов:
Cr2O3, t
Сn H2n+2 → Cn H2n + H2
2. Дегалогенирование дигалогенопроизводных:
R−CH(Hal)−CH2−Hal + Zn → R−CH=CH2 + ZnHal2
3. Дегидрогалогенирование галогенопроизводных:
спирт
R−CH2−CH2−Hal + KOH → R−CH=CH2 + KHal + H2O
4. Дегидратация спиртов:
t, H2SO4(к)
R−CH2−CH2−OH → R−CH=CH2 + H2O
№27 слайд


Содержание слайда: Алкины. Ацетилен
Алкины – углеводороды, содержащие кроме σ-связей две π-связи (тройную связь) у одной пары углеродных атомов. Первый представитель этого класса веществ – ацетилен HC≡CH, в связи с чем алкины также называют ацетиленовыми углеводородами. Общая формула гомологического ряда алкинов Сn Н2n−2 (изомерны алкадиенам).
4.1. Номенклатура и изомерия алкинов
Названия ацетиленовых углеводородов образуются от названий соответствующих предельных углеводородов заменой окончания –ан на –ин.
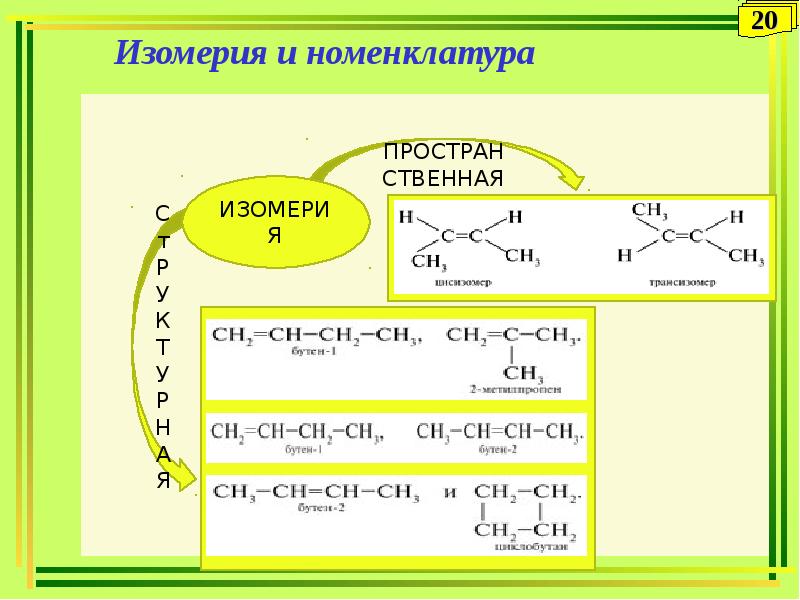
Для алкинов характерны изомерия углеродного скелета и изомерия положения тройной связи:
CH≡C−CH2−CH2−CH3 CH≡C−CH−CH3 3-метилбутин-1
Пентин-1 |
CH3−C≡C−CH2−CH3 CH3
и пентин-2
№28 слайд


Содержание слайда: Методы получения алкинов
Общий способ получения алкинов – отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних (а), либо у одного атома углерода (б), под действием спиртового раствора щелочи:
спирт
а) R−CH(Hal)−CH2(Hal) + 2 KOH → R−C≡C−H + 2 KHal + 2 H2O
спирт
б) R−CH2−C(Hal)2−CH3 + 2 KOH → R−C≡C−CH3 + 2 KHal + 2H2O
Ацетилен получают высокотемпературным крекингом метана
1500º
2 СН4 → Н−С≡С−Н + 3 Н2,
а также гидролизом карбида кальция, образующегося при высоких температурах из оксида кальция и углерода:
СаО + 3 С → СаС2 + СО ; СаС2 + 2 Н2О → Н−С≡С−Н + Са(ОН)2
№29 слайд


Содержание слайда: Химические свойства ацетилена
1.Реакция галогенирования
CH≡CH + 2Br 2 → CHBr2−CHBr2
1,1,2,2-тетрабромэтан
Алкины, так же как и алкены, обесцвечивают бромную воду.
2. Реакция гидрогалогенирования
Эти реакции, как правило, проводят в присутствии катализаторов. Для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова:
AlBr3
CH3−C≡CH + HBr → CH3−CBr=CH2
2-бромпропен
CH3−CBr=CH2 + HBr → CH3−CBr2−CH3
2,2-дибромпропан
№30 слайд


Содержание слайда: Химические свойства ацетилена (прод.)
3. Реакция гидратации (реакция Кучерова)
Вода присоединяется к алкинам с образованием неустойчивых продуктов − енолов, которые быстро изомеризуются в карбонильные соединения. Реакция протекает в присутствии сульфата ртути HgSO4 :
Hg2+
R−C ≡C−R + H2O → [ R−C = CH−R ] → R−C−CH32 - R
| | OH O
неустойчивая
«енольная форма «кето-форма»
Реакция гидратации ацетилена по Кучерову имеет промышленное значение, в результате образуется уксусный альдегид:
CH ≡CH + H2O → [ CH2=CH] → CH3−C=O
| | OH H
№31 слайд


Содержание слайда: Химические свойства ацетилена (прод.)
4. Реакция замещения
Атом водорода, находящийся у углерода в sp-гибридном состоянии, достаточно подвижен и способен замещаться на атомы металлов. Поэтому алкины, в отличие от алкенов, способны образовывать соли – ацетилениды:
СН≡СН + NaNH2 → СН≡ СNa + NH3
ацетиленид натрия
HC≡CH + 2 [Ag(NH3)2]OH → Ag−C≡C−Ag↓ + 2 NH3 + 2 H2O
ацетиленид дисеребра
Ацетилениды тяжелых металлов Ag, Cu, Hg представляют собой не истинные соли, а ковалентно построенные соединения, нерастворимые в воде, взрывоопасные в сухом виде.
5. Реакция гидрирования (→этан)
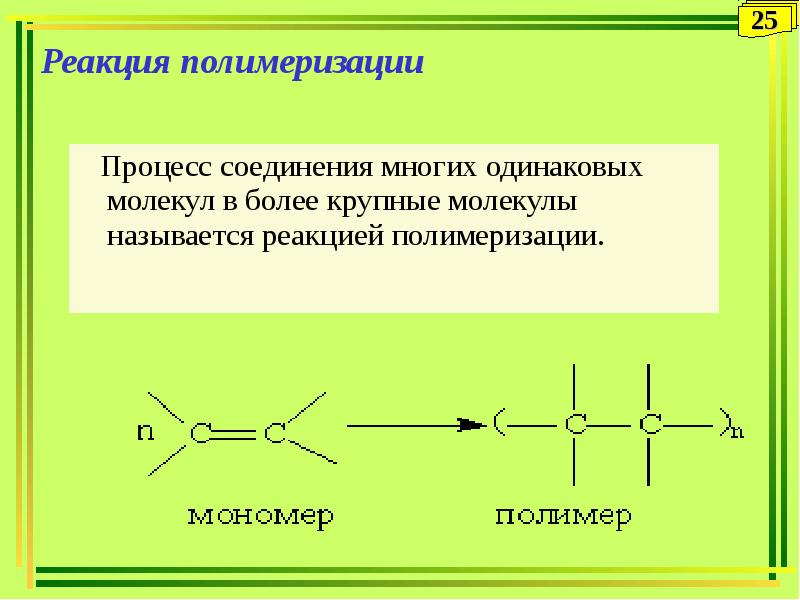
6. Реакция тримеризации (→бензол)
7. Реакция окисления (горения)
Скачать все slide презентации Органическая химия. Алифатические углеводороды одним архивом:
Похожие презентации
-
 Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды -
 Химия органических соединений. Углеводороды
Химия органических соединений. Углеводороды -
 Классификация органических веществ Химия. 10 класс Абрамова С. И.
Классификация органических веществ Химия. 10 класс Абрамова С. И. -
 Органическая химия Жиры
Органическая химия Жиры -
 Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ 10 Ст. Новомыша
Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ 10 Ст. Новомыша -
 Физические явления в химии НЕОРГАНИЧЕСКАЯ ХИМИЯ 8 КЛАСС УЧИТЕЛЬ ХИМИИ: Т. А. КОМАРОВА
Физические явления в химии НЕОРГАНИЧЕСКАЯ ХИМИЯ 8 КЛАСС УЧИТЕЛЬ ХИМИИ: Т. А. КОМАРОВА -
 Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне Ким Елена Петро
Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне Ким Елена Петро -
 Раздел: Неорганическая химия 8 класс Автор учебника О. С. Габриелян (базовый уровень) Учитель химии МОУ «Лебяжьевская средня
Раздел: Неорганическая химия 8 класс Автор учебника О. С. Габриелян (базовый уровень) Учитель химии МОУ «Лебяжьевская средня -
 Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения
Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения -
 По Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть
По Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть