Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
26 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
2.06 MB
Просмотров:
63
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Протолитические равновесия и процессы
№2 слайд
Содержание слайда: Теория электролитической диссоциации Аррениуса пригодна лишь для водных растворов, в неводных растворителях она несостоятельна.
Теория электролитической диссоциации Аррениуса пригодна лишь для водных растворов, в неводных растворителях она несостоятельна.
Например, NH4Cl, ведущий себя как соль в водном растворе, при растворении в жидком аммиаке проявляет свойства кислоты, растворяя металлы с выделением водорода:
NH3
2NH4Cl + Ca = 2NH3 + CaCl2 + H2.
Мочевина CO(NH2)2, растворяясь в безводной уксусной кислоте, проявляет свойства основания, в жидком аммиаке – свойства кислоты, а ее водные растворы – нейтральны.
№3 слайд
Содержание слайда: Протолитическая теория
кислот и оснований
(Теория Бренстеда-Лоури)
Основные положения:
1. Кислота – молекула или ион, отдающие Н+ (протон), т.е. донор протонов.
Основание - молекула или ион, присоединяющие Н+, т.е. акцептор протонов.
№4 слайд
№5 слайд
Содержание слайда: Амфолитами являются:
Амфолитами являются:
гидроксиды (Zn, Al, Pb, Sn, Cr);
гидроанионы многоосновных кислот (НСО3- , НРО42- , Н2РО4- );
аминокислоты;
вода
№6 слайд
Содержание слайда: Жидкие протонсодержащие растворители вступают в обратимую реакцию автопротолиза.
Жидкие протонсодержащие растворители вступают в обратимую реакцию автопротолиза.
Например, для воды:
2Н2О = Н3О+ + ОН- или упрощенно Н2О = Н+ + ОН-
Состояние равновесия характеризуется ионным произведением воды Kw:
при 25 оС
K w = 10-14 и
[OH-] = [H+] = 10-7 моль/л
Содержание протонов [H+] и гидроксид-ионов [OH-] удобно выражать через водородный и гидроксидный показатели.
№7 слайд
Содержание слайда: Водородный показатель (рН)
Водородный показатель (рН)
№8 слайд
№9 слайд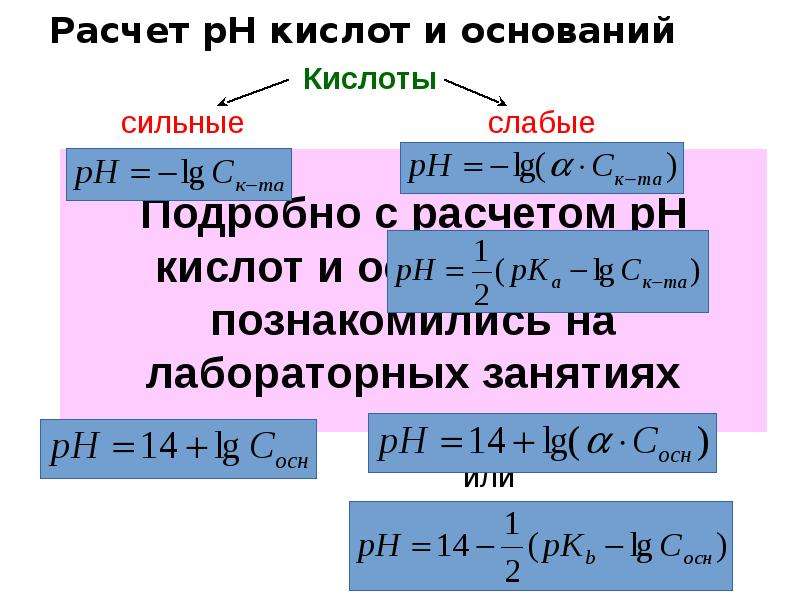
Содержание слайда: Расчет рН кислот и оснований
Кислоты
сильные слабые
или
Основания
сильные слабые
или
№10 слайд
№11 слайд
№12 слайд
Содержание слайда: Буферные системы
Растворы, способные сохранять значение рН при разбавлении или добавлении небольших количеств кислоты или щелочи.
Классификация БС
1. Кислотные – состоят из слабой кислоты и соли этой кислоты, образованной сильным основанием
(СН3СООН + СН3СООNa) – ацетатный буфер
2. Основные – состоят из слабого основания и соли этого основания, образованной сильной кислотой
(NH4OH + NH4Cl) – аммиачный буфер
3. Солевые – состоят из солей многоосновных кислот
(Na2HPO4 + NaH2PO4 ) – фосфатный буфер
роль слабого основания роль слабой кислоты
4. Растворы амфолитов (аминокислот, белков)
№13 слайд
Содержание слайда: Механизм поддержания рН
Механизм поддержания рН
Рассмотрим ацетатный буферный раствор:
СН3СООН СН3СОО- + Н+;
СН3СООNa СН3СОО- + Na+.
+ сильную кислоту (НCl):
СН3СОО- + Н+ СН3СООН
+ щелочь (NaОН):
СН3СООН + ОН- СН3СОО- + Н2О
№14 слайд
№15 слайд
Содержание слайда: Буферная емкость
Буферная ёмкость (В) – количество моль эквивалентов сильной кислоты или щелочи, добавление которой к 1 л буферного раствора изменяет рН на единицу.
№16 слайд
Содержание слайда: Буферная ёмкость зависит от:
Буферная ёмкость зависит от:
природы добавляемых веществ и компонентов буферного раствора.
исходной концентрации компонентов буферной системы.
Чем больше количества компонентов кислотно-основной пары в растворе, тем больше буферная ёмкость этого раствора.
3) соотношения концентраций компонентов буферного раствора, а следовательно и от рН.
№17 слайд
Содержание слайда: Максимальная буферная емкость, т.е. наибольшая способность этой системы противостоять изменению рН, соответствует значению рН = рК. При этом Ссоли/Ск-та = 1.
Максимальная буферная емкость, т.е. наибольшая способность этой системы противостоять изменению рН, соответствует значению рН = рК. При этом Ссоли/Ск-та = 1.
Интервал рН = рК 1, называется зоной буферного действия системы.
Это соответствует интервалу соотношения Ссоли/Ск-ты от 1/10 до 10/1.
№18 слайд
Содержание слайда: Буферные системы крови
рН плазмы крови 7,40 0,05
№19 слайд
Содержание слайда: Кислотно-основное состояние организма (КОС)
Показатели КОС
(метод микро – Аструп)
№20 слайд
№21 слайд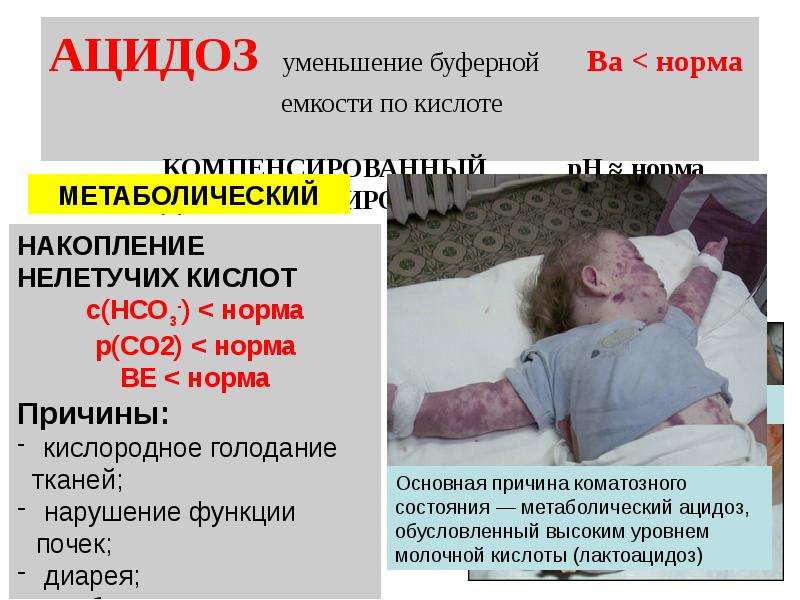
Содержание слайда: АЦИДОЗ уменьшение буферной Ва < норма
емкости по кислоте
КОМПЕНСИРОВАННЫЙ рН ≈ норма
ДЕКОМПЕНСИРОВАННЫЙ рН < норма
№22 слайд
Содержание слайда: АЦИДОЗ уменьшение буферной Ва < норма
емкости по кислоте
КОМПЕНСИРОВАННЫЙ рН ≈ норма
ДЕКОМПЕНСИРОВАННЫЙ рН < норма
№23 слайд
Содержание слайда: АЛКАЛОЗ увеличение буферной Ва > норма
емкости по кислоте
КОМПЕНСИРОВАННЫЙ рН ≈ норма
ДЕКОМПЕНСИРОВАННЫЙ рН > норма
№24 слайд
Содержание слайда: АЛКАЛОЗ увеличение буферной Ва > норма
емкости по кислоте
КОМПЕНСИРОВАННЫЙ рН ≈ норма
ДЕКОМПЕНСИРОВАННЫЙ рН > норма
№25 слайд
№26 слайд
Содержание слайда: КОРРЕКЦИЯ КОС
КОРРЕКЦИЯ КОС
Поиск и устранение причин:
нарушения процессов дыхания (респираторный ацидоз или алкалоз) или процессов пищеварения и выделения (метаболический ацидоз или алкалоз).
2. При ацидозе:
а) 4,5% NaHCO3,
или
б) лучше:
3,66% р-р трисамина или 11% р-р лактата натрия.
3. При алкалозе: 5% р-р аскорбиновой кислоты.



































