Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
28 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
1.06 MB
Просмотров:
77
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Химическая кинетика. Молекулярность и порядок реакции. Факторы, влияющие на скорость
Лектор: канд. хим. наук., доцент Иванова Н.С.
№2 слайд
Содержание слайда: Основные понятия кинетики
Кинетика раздел химии, изучающий механизмы химических реакций и скорости их протекания.
Скорость изменение концентрации (моль/л) реагирующих веществ в единицу времени (сек., мин., час).
№3 слайд
Содержание слайда: Основные понятия кинетики
Для реакции в общем виде
aA + bB xX + yY
скорость описывается кинетическим уравнением:
№4 слайд
Содержание слайда: Факторы, влияющие на скорость
1. Природа реагирующих веществ: определяется видом частиц (атомы, молекулы, ионы).
2. Концентрация реагирующих веществ: описывается законом действующих масс (ЗДМ)
,
где k const скорости реакции.
№5 слайд
Содержание слайда: Факторы, влияющие на скорость
3. Температура: описывается правилом Вант-Гоффа
Для химических реакций
= 2-4, для ферментативных
= 7-9.
№6 слайд
Содержание слайда: Основные положения теории активных соударений
Для эффективного взаимодействия частицы должны:
1. столкнуться;
2. иметь благоприятную ориентацию;
3. обладать достаточной
энергией.
№7 слайд
Содержание слайда: Энергия активации
,
где Еа (кДж/моль) энергия активации.
Еа минимальная энергия частиц, достаточная для того, чтобы частицы вступили в реакцию.
№8 слайд
Содержание слайда: Способы расчёта Еа
1. По уравнению Аррениуса.
2. Графический
№9 слайд
Содержание слайда: Молекулярность реакции
Число молекул реагентов, участвующих в простой одностадийной реакции, состоящей из одного элементарного акта, называется молекулярностью реакции.
Мономолекулярная реакция: C2H6 2CH3
Бимолекулярная реакция: CH3 + CH3 C2H6
Пример относительно редкой тримолекулярной реакции: 2NO + O2 2NO2
Молекулярность связана с механизмом реакции!
№10 слайд
Содержание слайда: Порядок реакции …
… всех показателей степеней концентраций реагирующих веществ в ЗДМ.
; П = a + b
Порядок реакции по веществу A равен a.
Порядок реакции отражает общую зависимость скорости от концентрации и часто не совпадает с молекулярностью.
№11 слайд
Содержание слайда: Кинетические уравнения для
элементарных реакций 0, I и II порядка
№12 слайд
Содержание слайда: Методы определения П
1. Метод изолирования Оствальда.
2. Метод подбора кинетических уравнений.
3. Графический
tg = П
№13 слайд
Содержание слайда: 4. Ката́лиз (от греч. κατάλυσις, восходит к καταλύειν — разрушение) — явление изменения скорости химической или биохимической реакции в присутствии веществ, количество и состояние которых в ходе реакции не изменяются.
4. Ката́лиз (от греч. κατάλυσις, восходит к καταλύειν — разрушение) — явление изменения скорости химической или биохимической реакции в присутствии веществ, количество и состояние которых в ходе реакции не изменяются.
Термин «катализ» был введён в 1835 году шведским учёным Берцелиусом.
№14 слайд
Содержание слайда: Катализа́тор — …
…вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции.
В отношении катализатора выполняются 2 условия:
1. катализатор ускоряет реакцию, для которой G 0.
2. Катализатор не смещает химического равновесия, т.е. не влияет на Кр.
№15 слайд
Содержание слайда: Виды катализа
1. Гомогенный катализ – катализатор находится в одной фазе с субстратом. Характерным примером является кислотно-основный катализ, который реализуется в организме при гидролизе жиров, спиртовом и молочном брожении, окислении С6Н12О6 и т. п. Скорость определяется по формуле:
№16 слайд
№17 слайд
Содержание слайда: 2. Гетерогенный катализ – катализатор и субстрат находятся в разных фазах. Особенность таких катализаторов наличие активных и аллостерических центров.
2. Гетерогенный катализ – катализатор и субстрат находятся в разных фазах. Особенность таких катализаторов наличие активных и аллостерических центров.
Активный центр центр, обладающий каталитической активностью.
Аллостерический центр участвует в явлении, которое носит название индуцированная приспособляемость фермента к субстрату и наоборот.
№18 слайд
Содержание слайда: 3. Ферментативный катализ (биокатализ) – ускорение биохимических реакций при участии белковых макромолекул, называемых ферментами (энзимами). Этот вид катализа относится к микрогетерогенному катализу, но имеет аналогии и с гомогенным катализом. Отличие ферментов от других катализаторов высокая активность и селективность первых.
3. Ферментативный катализ (биокатализ) – ускорение биохимических реакций при участии белковых макромолекул, называемых ферментами (энзимами). Этот вид катализа относится к микрогетерогенному катализу, но имеет аналогии и с гомогенным катализом. Отличие ферментов от других катализаторов высокая активность и селективность первых.
№19 слайд
Содержание слайда: Эмиль Герман Фишер
Эмиль Герман Фишер
(1852-1919)
В 1890 г. предположил, что специфичность ферментов определяется точным соответствием формы активного центра фермента и структуры субстрата. Такая трактовка называется моделью «ключ-замок».
№20 слайд
Содержание слайда: За счёт образования Е-S комплекса, в котором перераспределены электроны в субстрате, уменьшается прочность разрываемых связей, значительно уменьшается Еа, а скорость реакции сильно возрастает.
За счёт образования Е-S комплекса, в котором перераспределены электроны в субстрате, уменьшается прочность разрываемых связей, значительно уменьшается Еа, а скорость реакции сильно возрастает.
№21 слайд
Содержание слайда: Трактовка Фишера объясняет действие селективного фермента. Для неселективного фермента более реалистична индуцированная приспособляемость фермента к субстрату и наоборот. Неправильные субстраты — слишком большие или слишком маленькие — не подходят к активному центру, поэтому аллостерический центр «подгоняет» структуру субстрата под структуру активного центра.
Трактовка Фишера объясняет действие селективного фермента. Для неселективного фермента более реалистична индуцированная приспособляемость фермента к субстрату и наоборот. Неправильные субстраты — слишком большие или слишком маленькие — не подходят к активному центру, поэтому аллостерический центр «подгоняет» структуру субстрата под структуру активного центра.
№22 слайд
Содержание слайда: Кинетическая работа фермента
Уравнение Михаэ́лиса – Ме́нтен — описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
Уравнение имеет вид:
где Vm – максимальная скорость реакции, равная kcatEo;
KM – константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной;
S – концентрация субстрата.
№23 слайд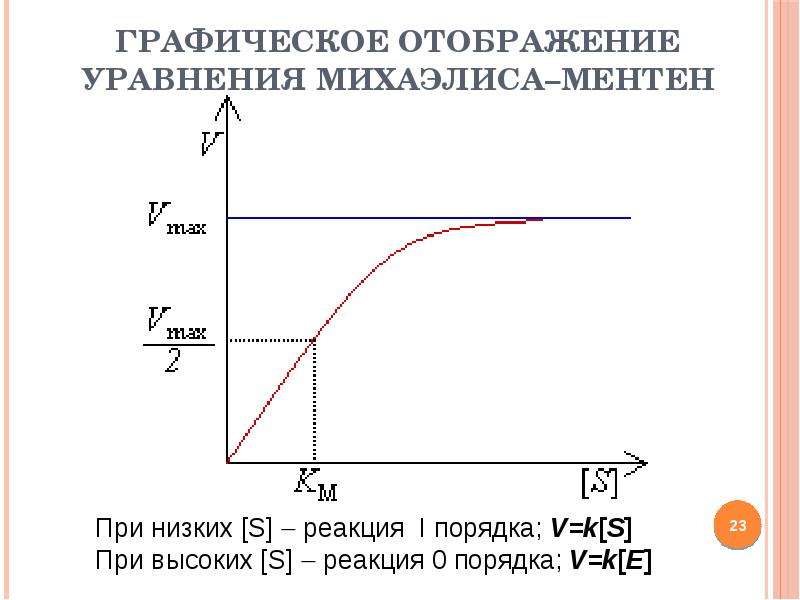
Содержание слайда: Графическое отображение уравнения Михаэлиса–Ментен
№24 слайд
Содержание слайда: Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее течение различных химических реакций.
Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее течение различных химических реакций.
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции.
№25 слайд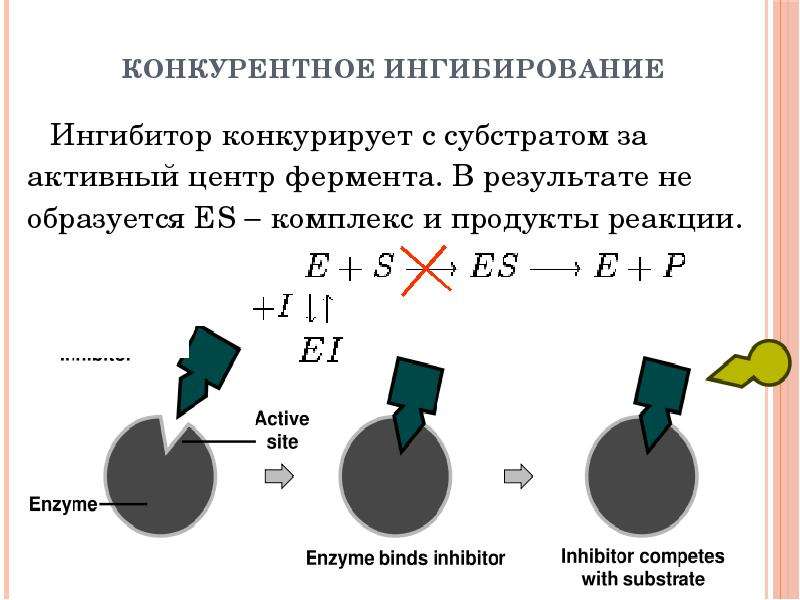
Содержание слайда: Конкурентное ингибирование
Ингибитор конкурирует с субстратом за активный центр фермента. В результате не образуется ES комплекс и продукты реакции.
№26 слайд
Содержание слайда: Неконкурентное ингибирование
Ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
№27 слайд
№28 слайд





































