Презентация Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе абсолютно бесплатно. Урок-презентация на эту тему содержит всего 131 слайд. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:131 слайд
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:12.11 MB
- Просмотров:156
- Скачиваний:5
- Автор:неизвестен
Слайды и текст к этой презентации:
№14 слайд


Содержание слайда: 3. Названия комплексных соединений
А) Комплексы без внешней сферы
[MLn] n L M (в одно слово)
Примеры:
[Ni(CO)4] – тетракарбонилникель;
[Co2(CO)8] – октакарбонилдикобальт;
[Al2Cl6] – гексахлородиалюминий;
[Co+III(NH3)3Cl3] – трихлоротриамминкобальт(III)
[Co+II(H2O)4(NO2)2] – динитротетрааквакобальт(II)
№15 слайд


Содержание слайда: Названия комплексных соединений
Б) Комплексный катион
[MLn]+X–
«анион катиона»: n L M(ст.ок.)
Примеры:
[AgI(NH3)2]OH –
гидроксид диамминсеребра(I);
[CoIII(NH3)6](OH)2Cl –
хлорид-дигидроксид гексаамминкобальта(III);
[Cr2III(NH3)9(OH)2]Cl4 –
хлорид дигидроксононаамминдихрома(III)
№17 слайд


Содержание слайда: Упражнения:
Na3[AgI(SO3S)2] –
бис(тиосульфато)аргентат(I) натрия
[PtII(py)4]2[FeII(CN)6] –
гексацианоферрат(II) тетрапиридинплатины(II)
[K(H2O)6][Al(H2O)6](SO4)2 –
сульфат гексаакваалюминия-гексааквакалия
[(CO)5Mn-Mn(CO)5] –
бис(пентакарбонилмарганец)
[(H2O)4Al(OH)2Al(H2O)4](SO4)2 –
сульфат ди(-гидроксо)бис(тетраакваалюминия)
№20 слайд
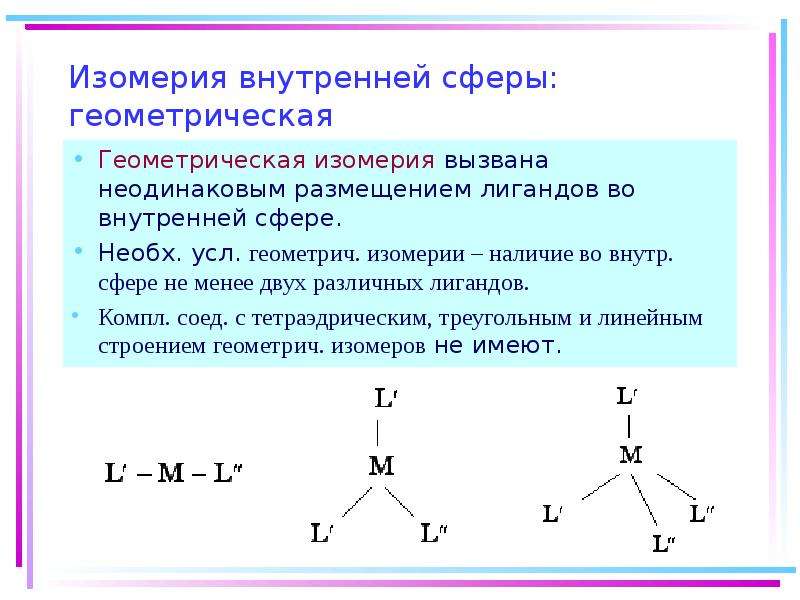

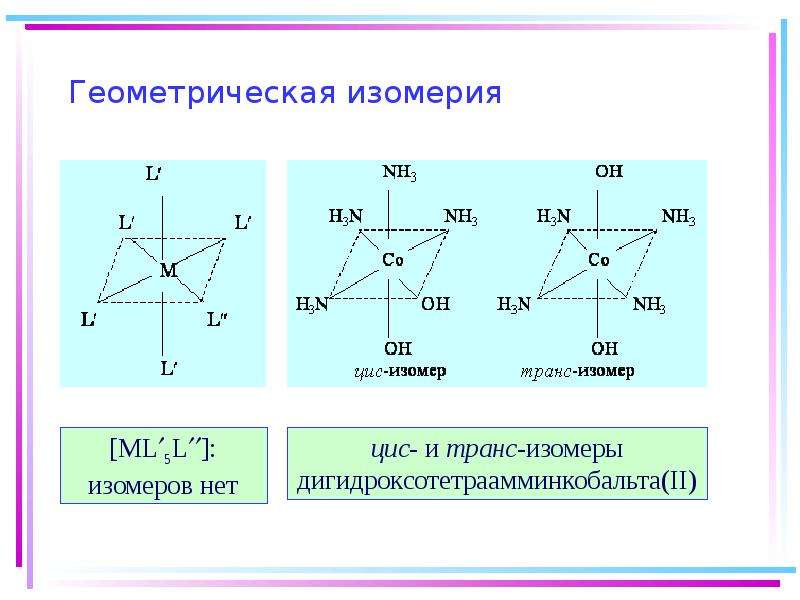
Содержание слайда: Изомерия внутренней сферы: геометрическая
Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней сфере.
Необх. усл. геометрич. изомерии – наличие во внутр. сфере не менее двух различных лигандов.
Компл. соед. с тетраэдрическим, треугольным и линейным строением геометрич. изомеров не имеют.
№33 слайд


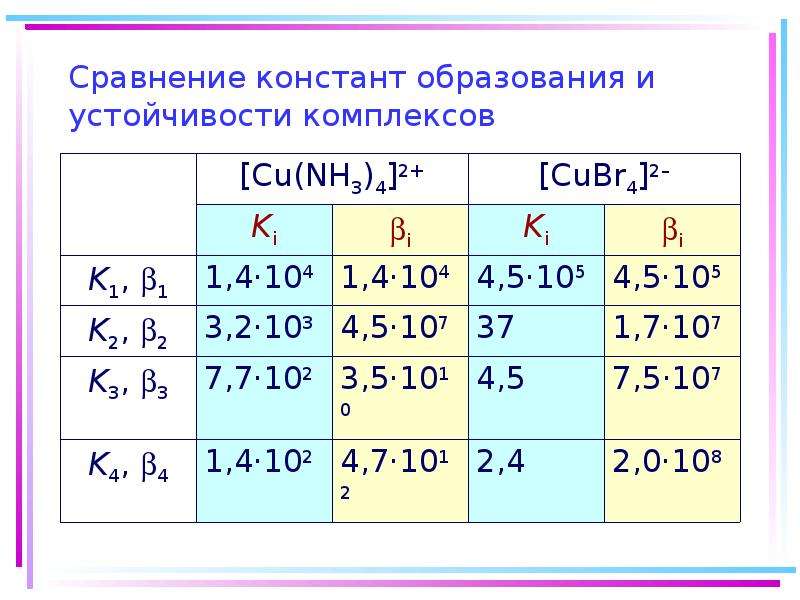
Содержание слайда: Сравнение устойчивости аммиачных комплексов
Ступени комплексообразования
[Cu(NH3)2]+ K2(обр) = 5,0·104
[Cu(NH3)]+ K1(обр) = 1,4·106
Природа комплексообразователя
[Cu(NH3)2]+ 2(обр) = 7,0·1010
[Ag(NH3)2]+ 2(обр) = 1,1·107
Комплекс Cu(I) устойчивее, чем комплекс Ag(I)
Степень окисления комплексообразователя
[CoII(NH3)6]2+ 6(обр) = 1,3·105
[CoIII(NH3)6]3+ 6(обр) = 3,2·1032
Комплекс Co(III) устойчивее, чем комплекс Co(II)
№35 слайд


Содержание слайда: Квантовомеханические теории строения комплексных соединений
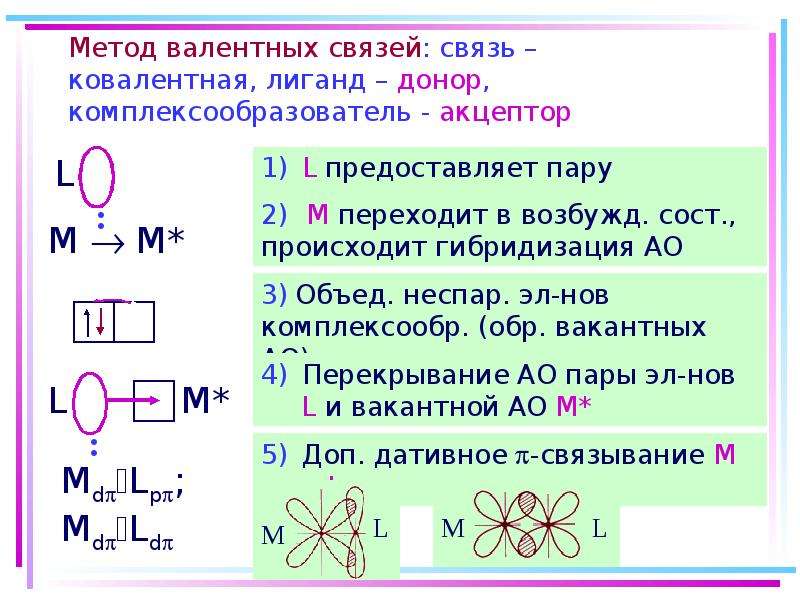
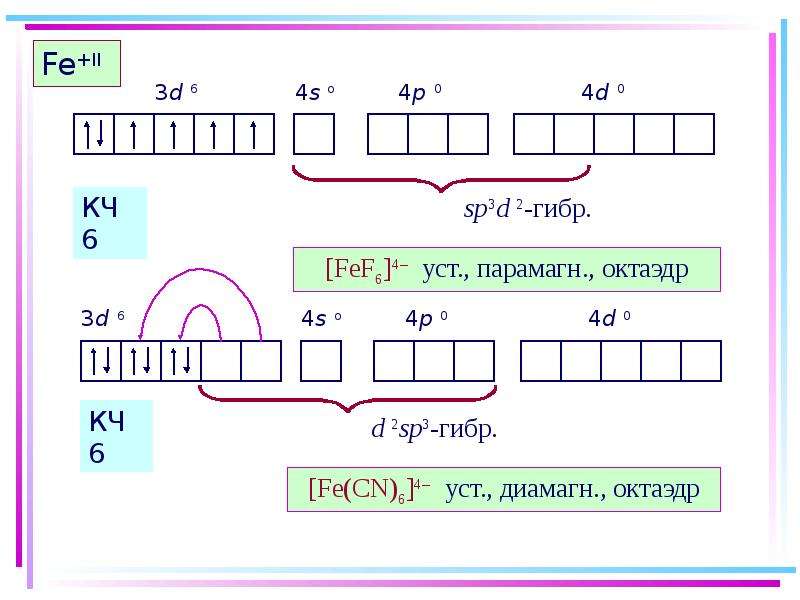
Для объяснения строения комплексных соединений наиболее широко применяются теория валентных связей (метод валентных связей) и теория кристаллического поля.
В рамках метода валентных связей считается, что между комплексообразователем и лигандами существует чисто ковалентная связь, которая реализуется по донорно-акцепторному механизму.
№41 слайд


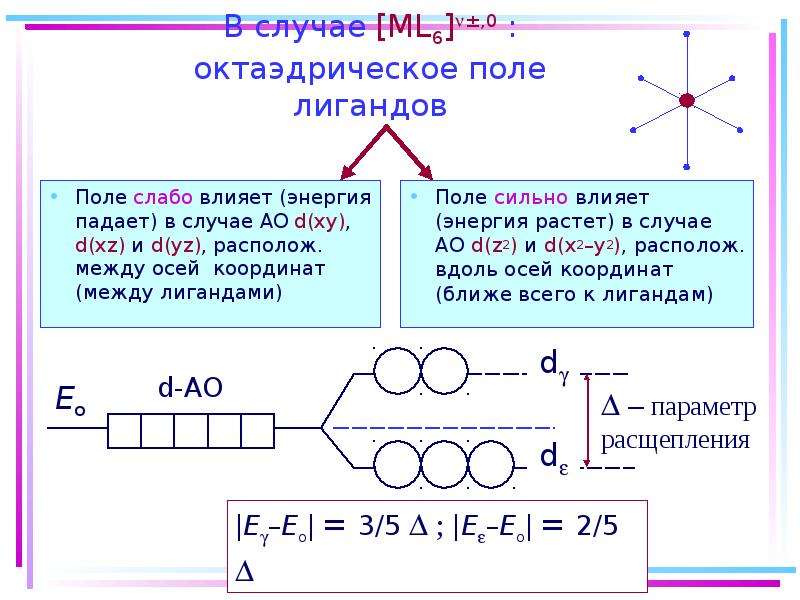
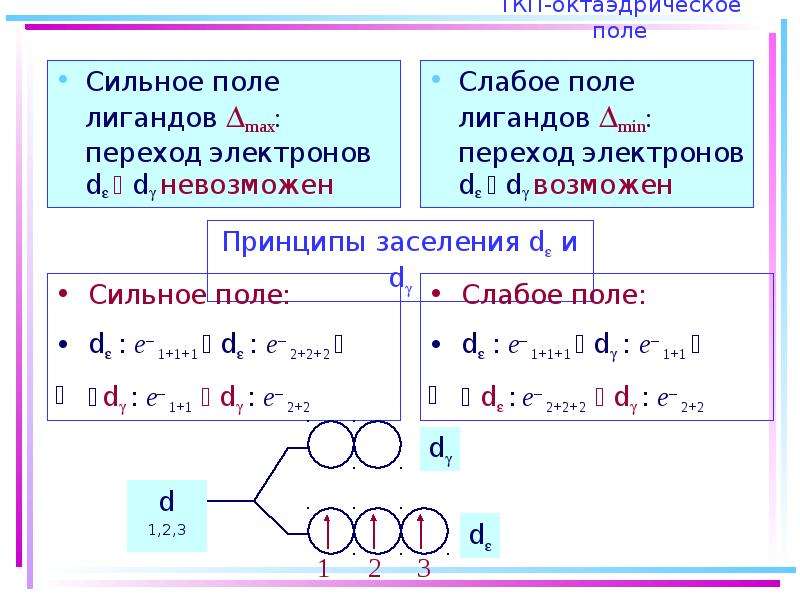
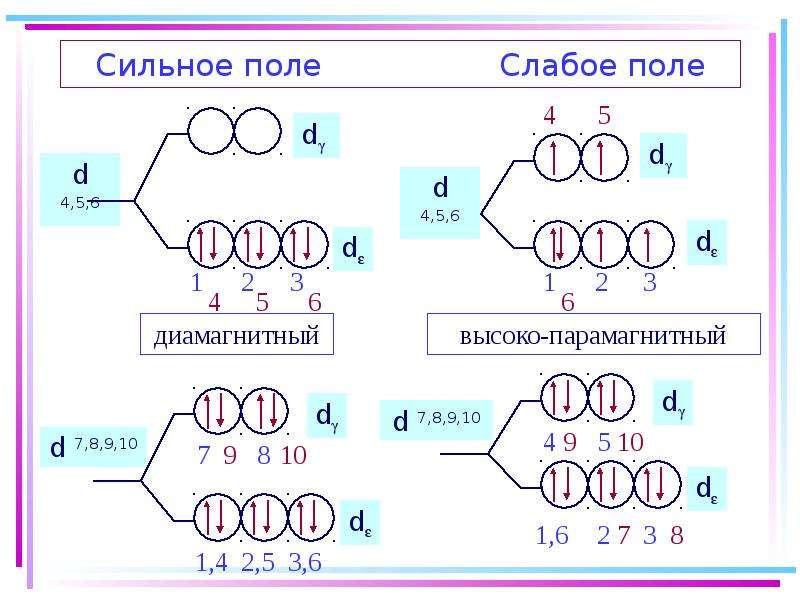
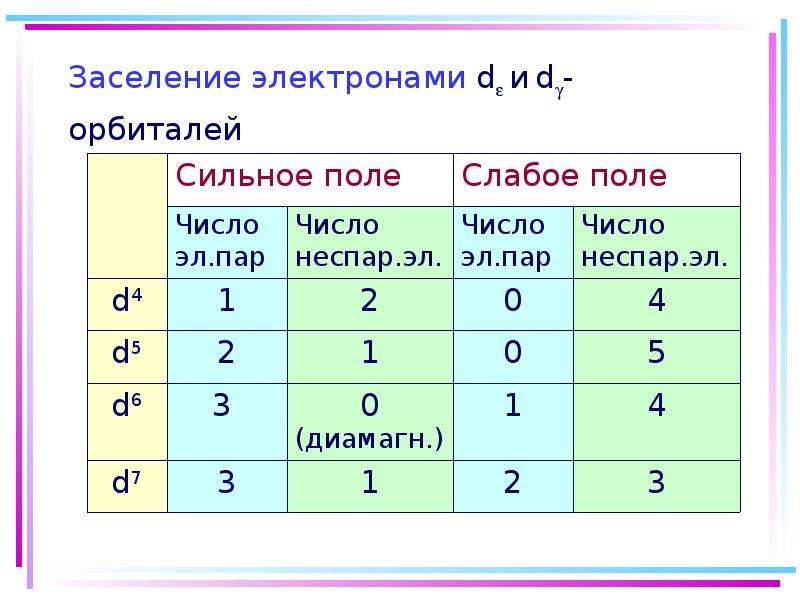
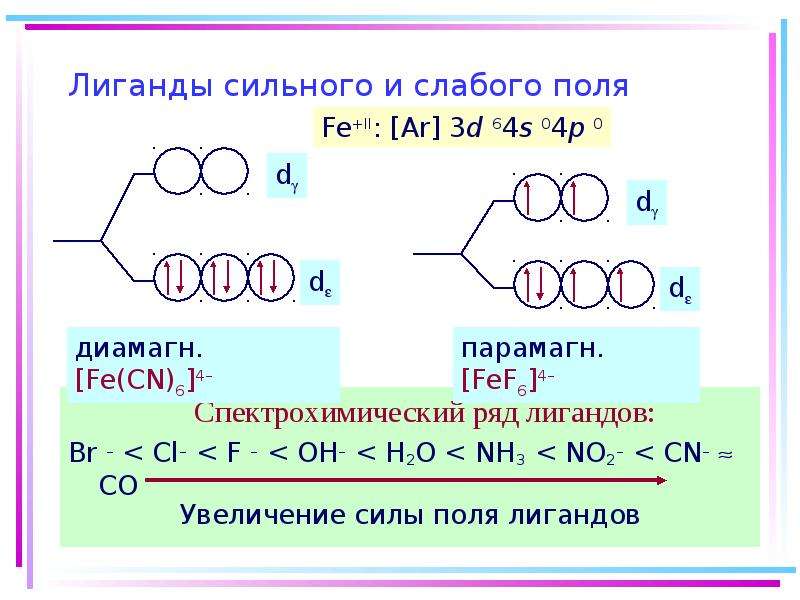
Содержание слайда: Основные положения теории кристаллического поля (поля лигандов)
Связь комплексообразователя (центр. атома) Mе с лигандами L считается чисто ионной
Лиганды L – точечные заряды в вершинах правильных полиэдров, т.е. на максимальном расстоянии друг от друга
Взаимодействие L между собой не рассматр.
Детально рассматривается влияние электростатич. поля лигандов на Mе, а именно, на энергетич. подуровни (ЭПУ) центрального атома
№48 слайд


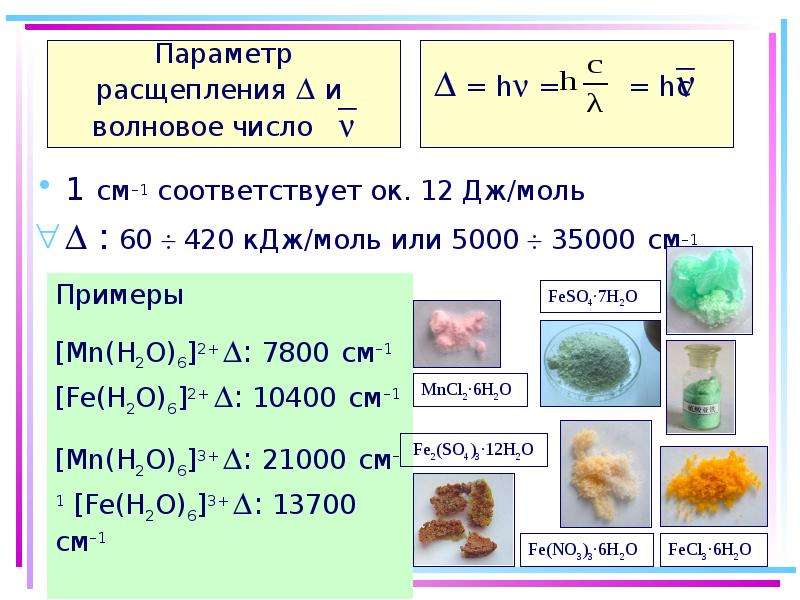
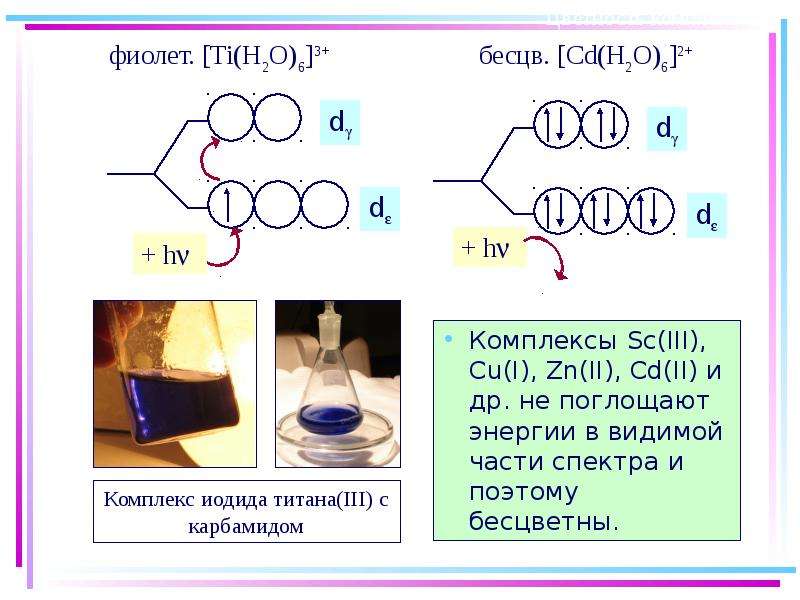
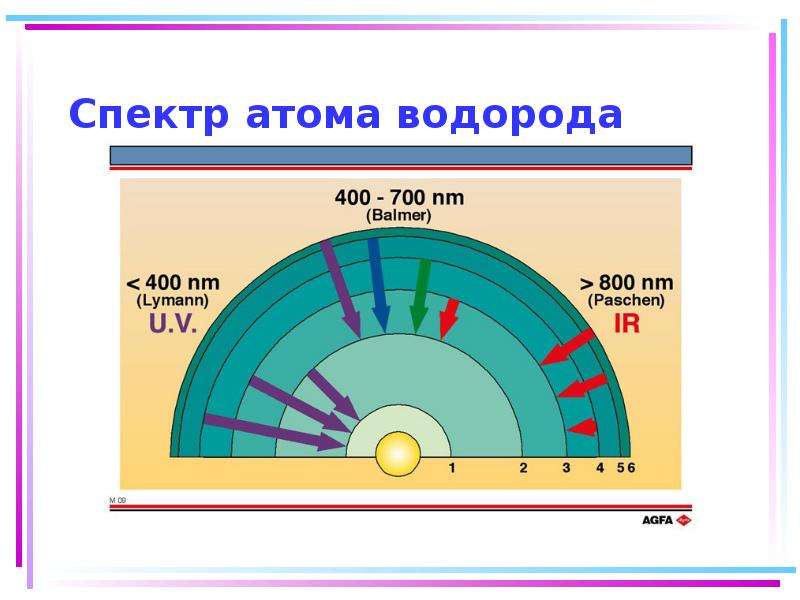
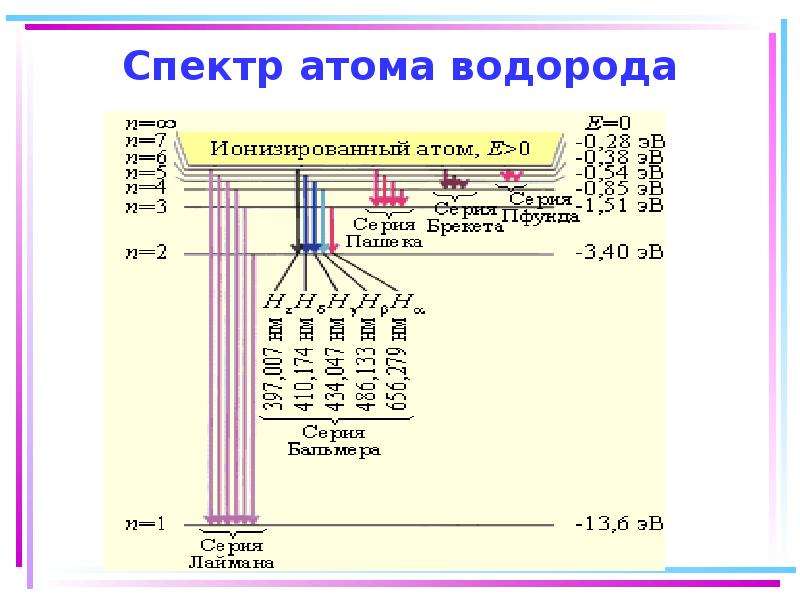
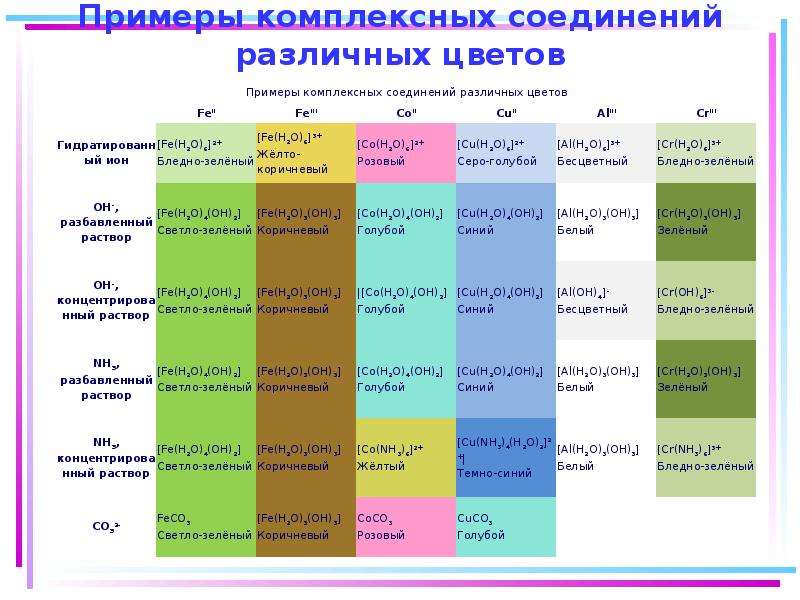
Содержание слайда: Цветность комплексных соединений
При облучении образца в-ва светом видимой части спектра может наблюдаться:
отсутствие поглощения света (образец бесцветен)
полное поглощение света (образец черный)
поглощение света определенной длины волны (образец имеет цвет, дополнительный к поглощенному).
№64 слайд


Содержание слайда: Методы синтеза комплексных соединений
Реакция обмена лигандов
А) в водном растворе (обр, принцип Ле Шателье):
[Сu(H2O)4]2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 8H2O
(обр. прод.) > (обр. исх.реаг.)
Б) в неводном растворителе:
[Al(H2O)6]3+ + NH3·H2O
[Al(H2O)6]3+(s) + 6NH3(ж) = [Al(NH3)6]3+(s) + 6H2O(s)
В) без растворителя:
[Ni(H2O)6]Cl2(т) + 6NH3(г) = [Ni(NH3)6]Cl2(т) +6H2O(г)
Г) внутримол. обмен лигандов в тв. фазе:
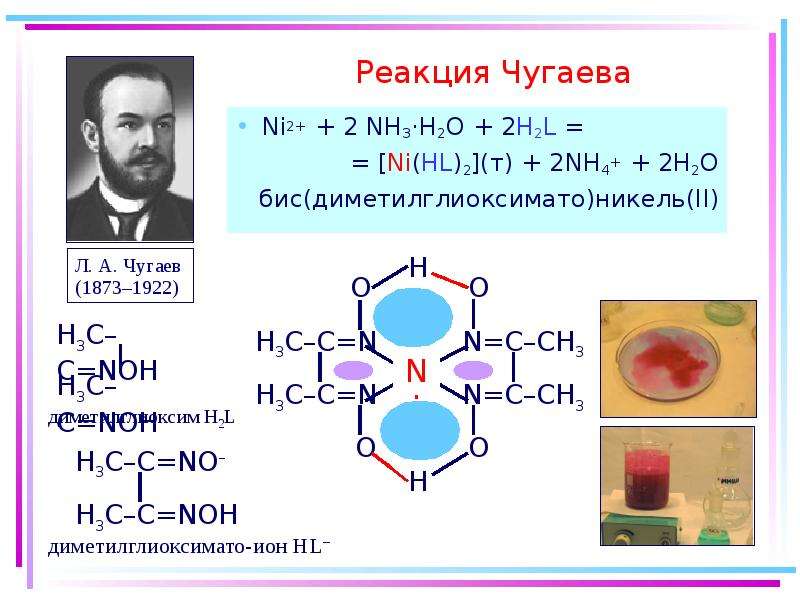
2[Co(H2O)6]Cl2(т) + t° = Co[CoCl4](т) + 12H2O
розовый синий
№65 слайд


Содержание слайда: Методы синтеза комплексных соединений
Д) ОВР + реакции обмена лигандов
+Ок.+ L
[СoII(H2O)6]2+ [СoIIIL6]3+
Ок.: H2O2, KNO2 … L – NH3, NO2– …
Примеры:
2CoIICl2 + 12NH3 + H2O2 = 2[CoIII(NH3)6](OH)Cl2
CoIICl2 + 7KNO2 + 2CH3COOH =
= K3[CoIII(NO2)6] + NO + 2KCl + 2CH3COOK + H2O
+ Вс
[NiII(CN)4]2– [Ni0(CN)4]4–
№129 слайд


Содержание слайда: Содержание
Введение
Комплексные ионы
Комплексные соединения
Реакции комплексообразования
Координационные соединения
Глава 1. Основные понятия координационной теории
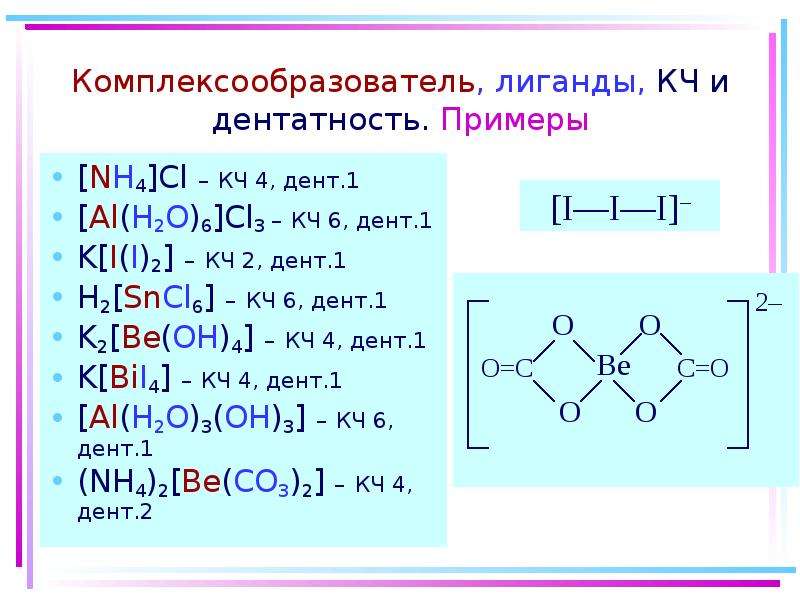
1.1. Комплексообразователь
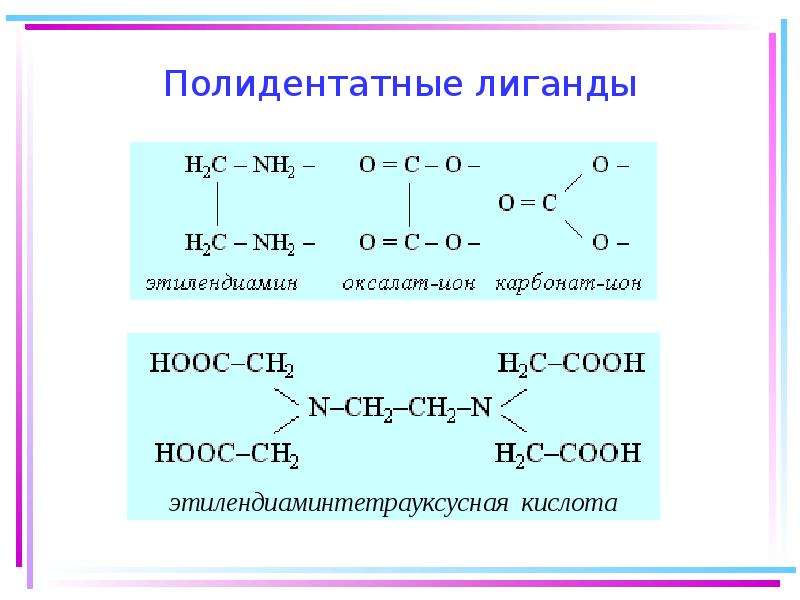
1.2. Лиганды
1.3. Дентатность
1.4. Координационное число
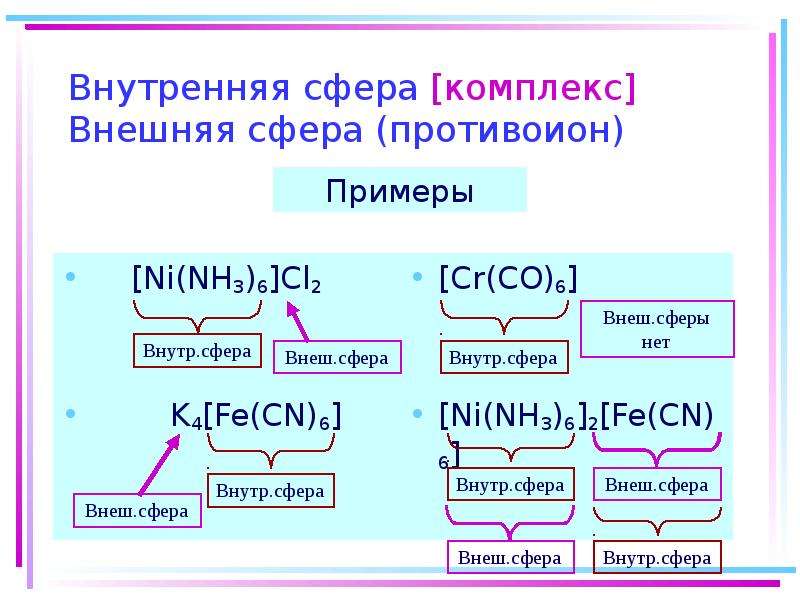
1.5. Внутренняя и внешняя сфера
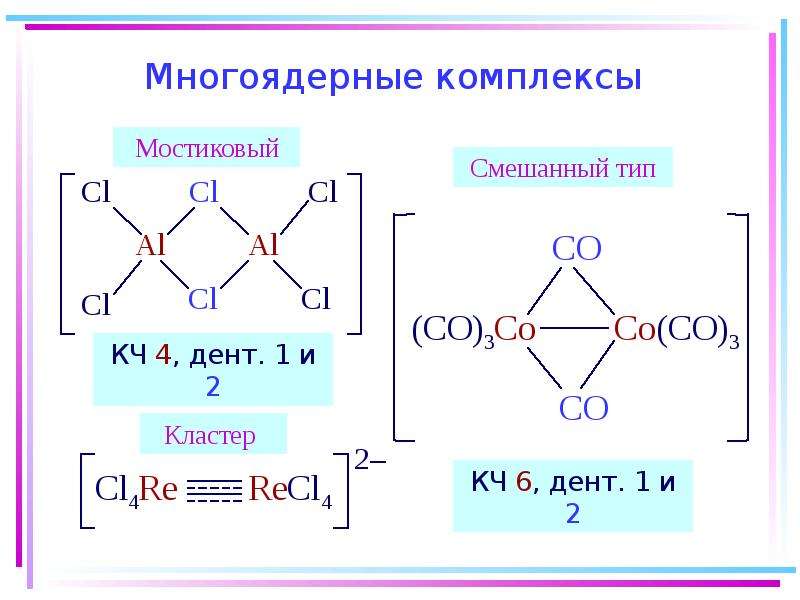
1.6. Многоядерные комплексы
Глава 2. Номенклатура комплексных соединений
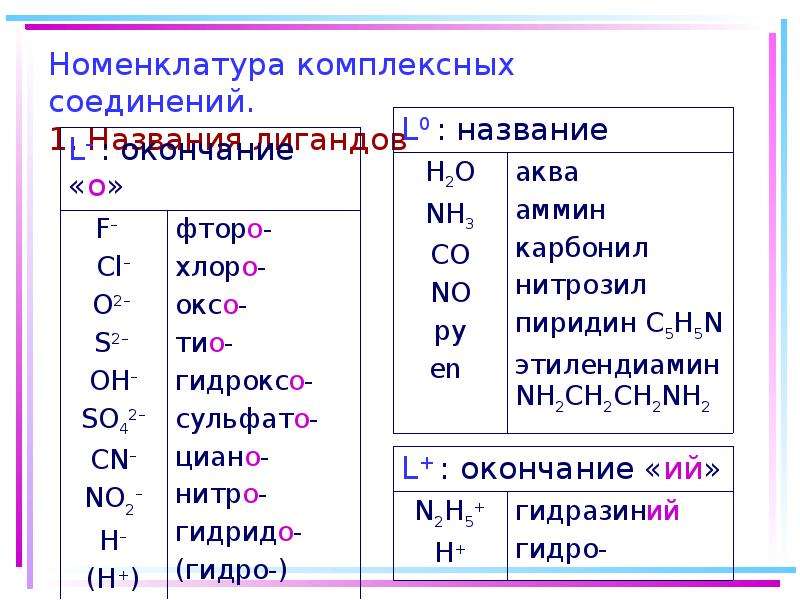
2.1. Названия лигандов
2.2. Порядок перечисления лигандов
2.3. Нейтральные комплексы
2.4. Комплексные катионы
2.5. Комплексные анионы
2.6. Мостиковые группы и многоядерные комплексы
2.7. Геометрические изомеры
Глава 3. Строение комплексных соединений
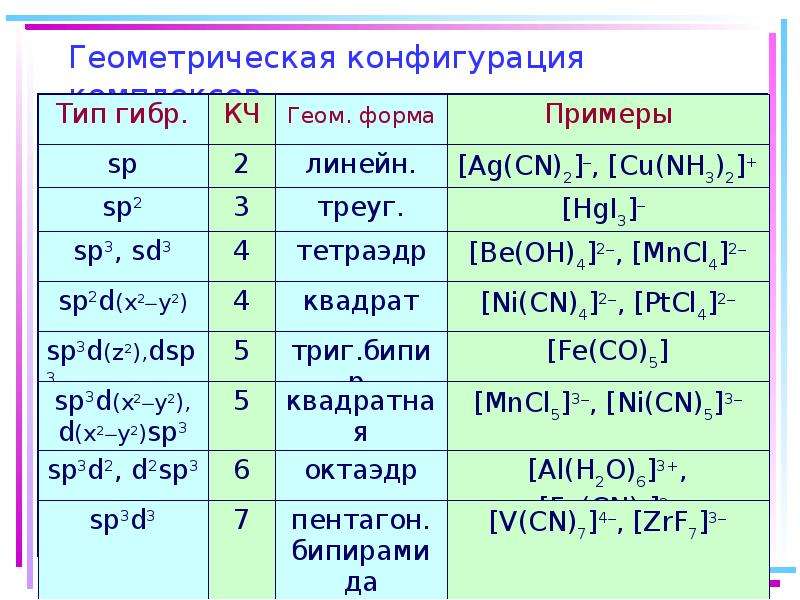
3.1. Координационное число 2
3.2. Координационное число 3
3.3. Координационное число 4
3.4. Координационное число 5
3.5. Координационное число 6 и выше
№130 слайд


Содержание слайда: Глава 4. Изомерия комплексных соединений
Глава 4. Изомерия комплексных соединений
4.1. Изомерия лигандов
4.2. Геометрическая изомерия
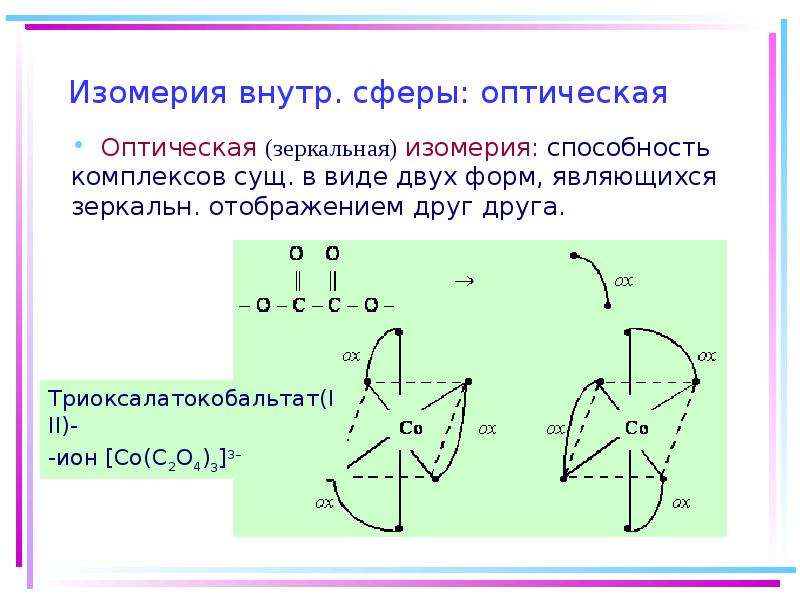
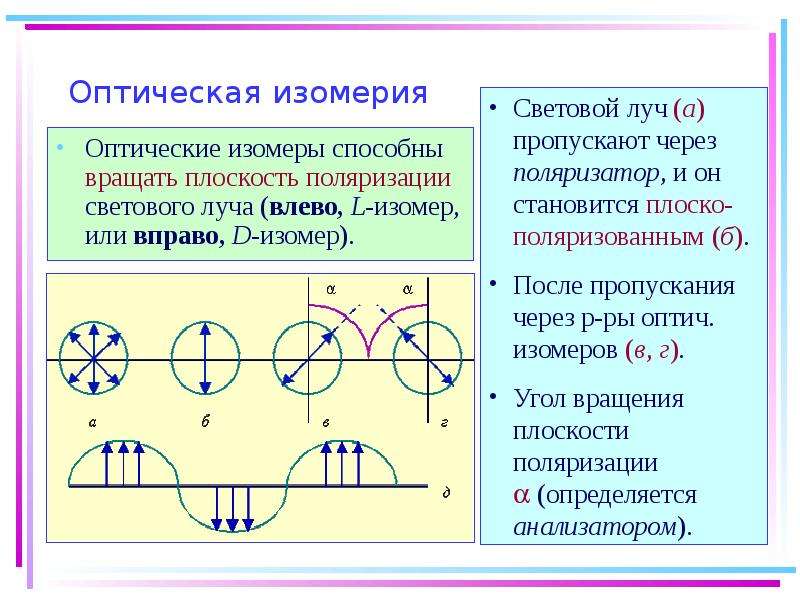
4.3. Оптическая изомерия
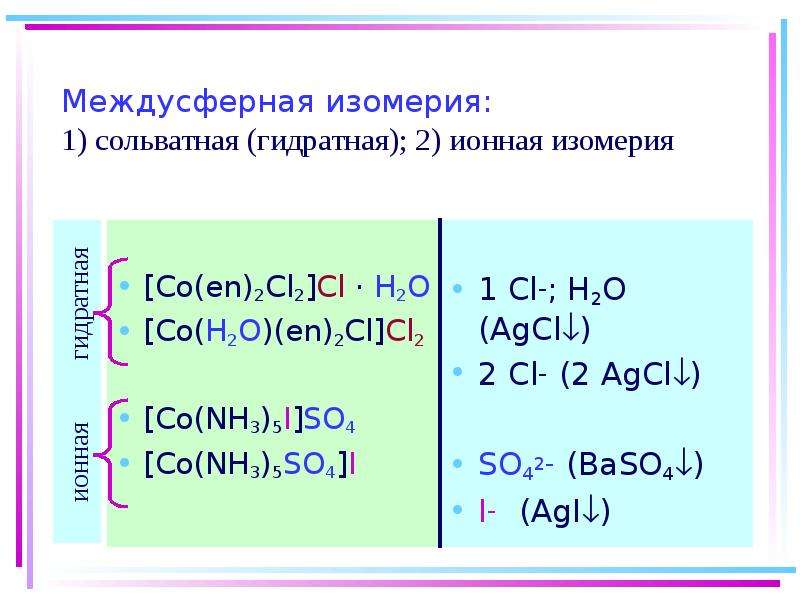
4.4. Сольватная (гидратная) изомерия
4.5. Ионная изомерия
Вопросы к 4 главе
Глава 5. Устойчивость комплексных соединений в растворе
5.1. Комплексные соединения без внешней сферы
5.2. Отщепление ионов внешней сферы
5.3. Обратимая диссоциация комплексов
5.4. Ступенчатая и полная константы образования
5.5. Прочность комплексов
5.6. Константы нестойкости
5.7. Примеры образования и разрушения комплексов
Вопросы к 5 главе
Глава 6. Квантовомеханические теории строения комплексов
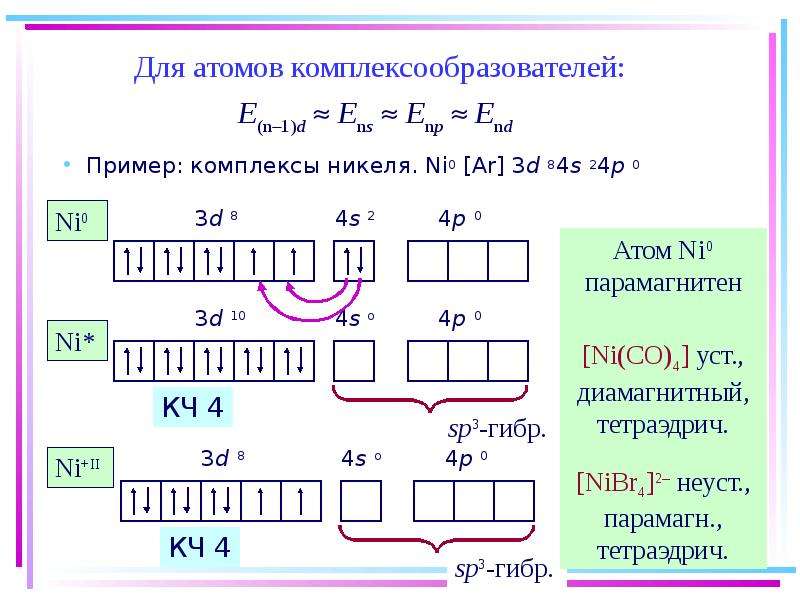
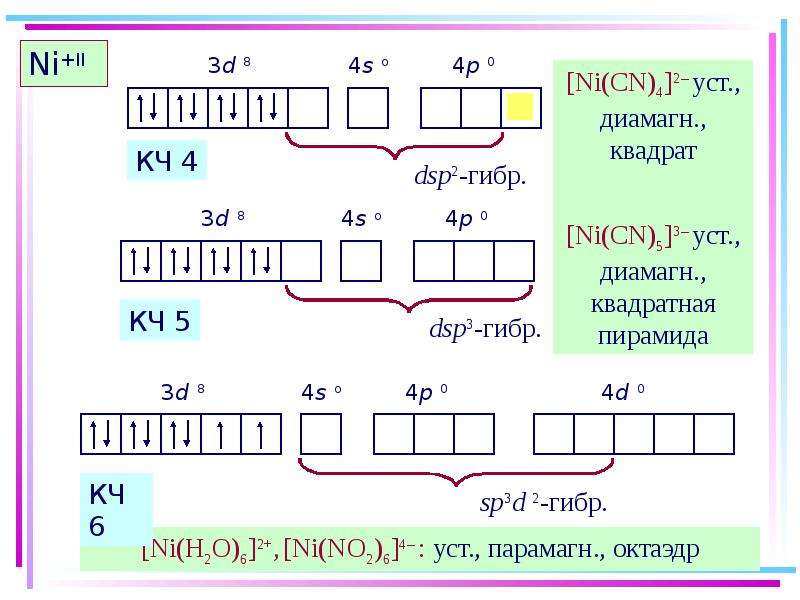
6.1. Теория валентных связей
6.2. Гибридизация орбиталей и структура комплексов
6.3. Теория кристаллического поля
6.4. Цветность
6.5. ММО для комплексных соединений
№131 слайд


Содержание слайда: Глава 7. Типы комплексных соединений
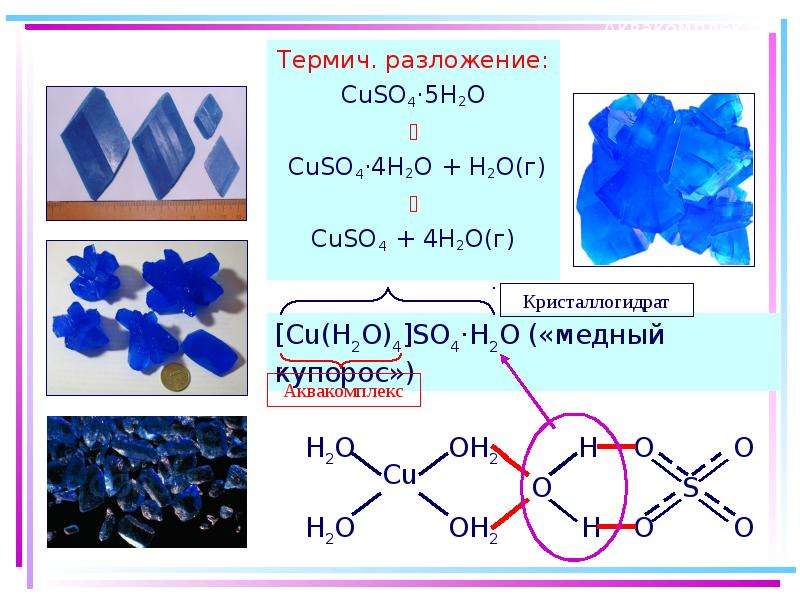
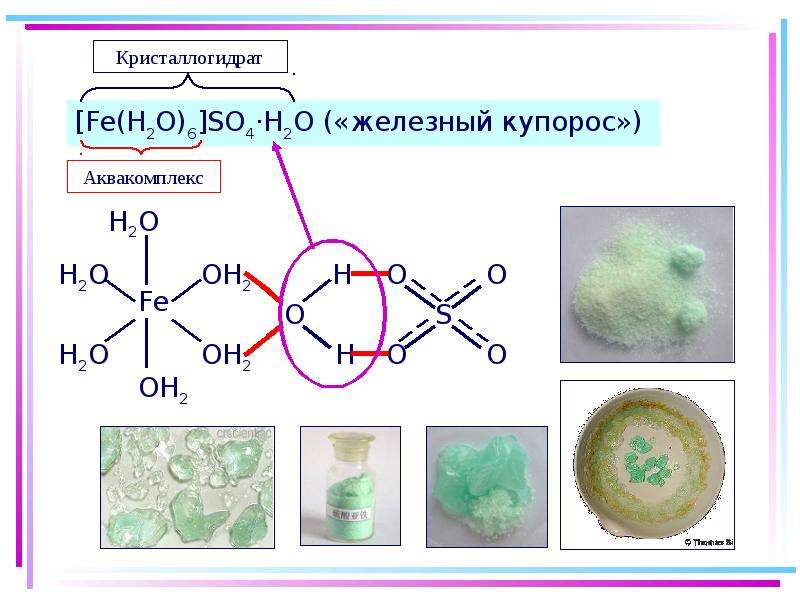
7.1. Аквакомплексы
7.2. Гидроксокомплексы
7.3. Аммиакаты
7.4. Ацидокомплексы
7.5. Анионгалогенаты
7.6. Катионгалогены
7.7. Гидридные комплексы
7.8. Карбонильные комплексы
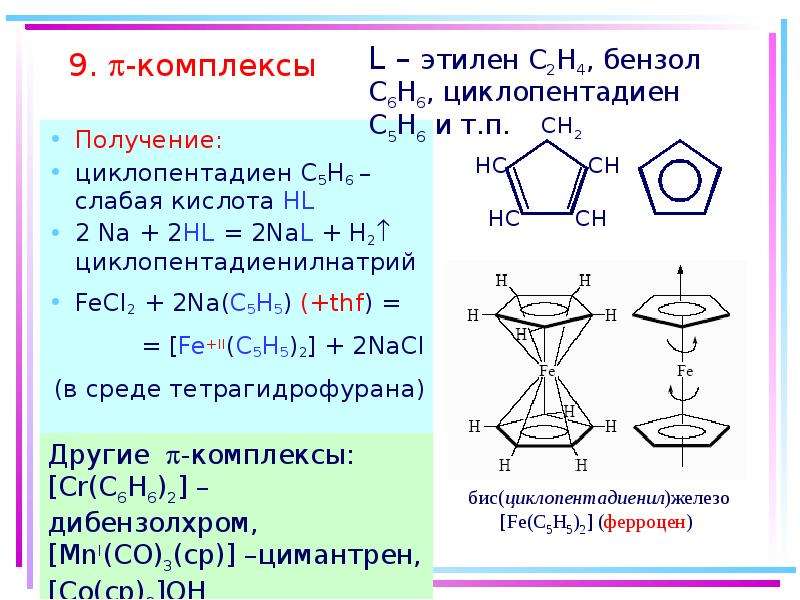
7.9. p-комплексы
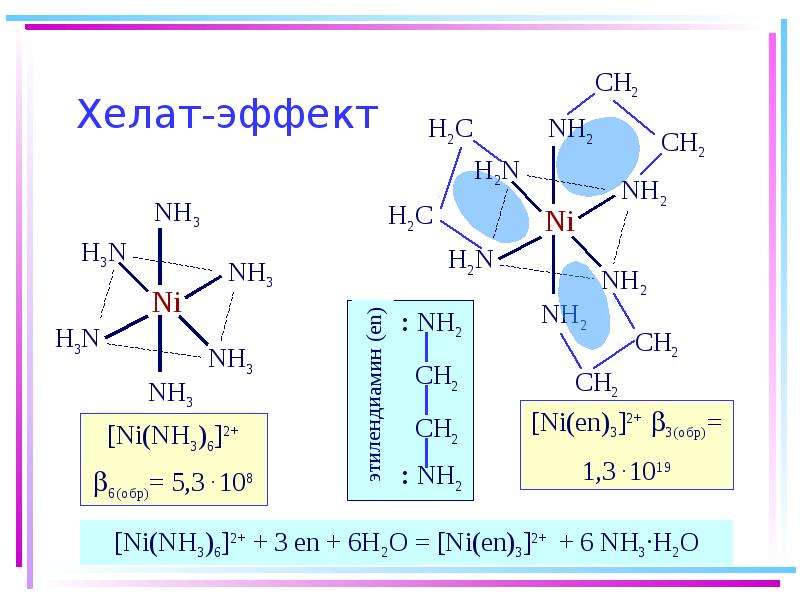
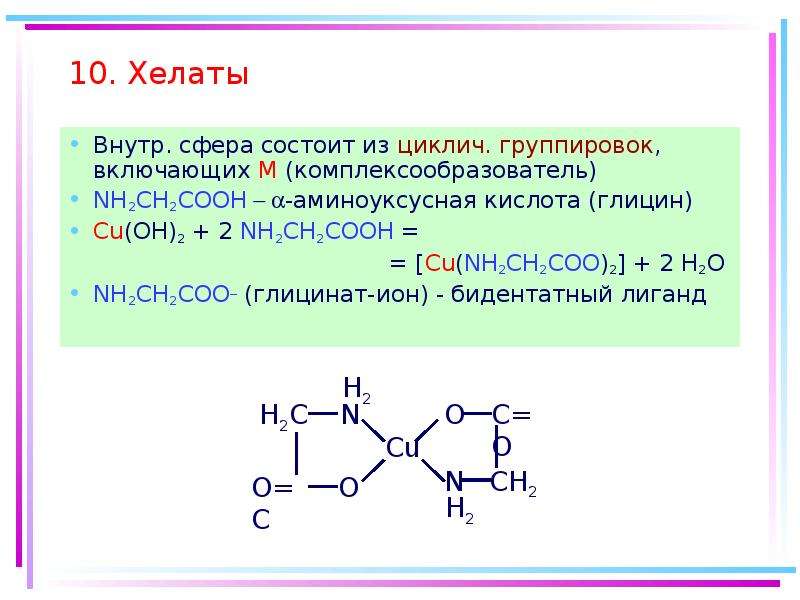
7.10. Хелаты
7.11. Многоядерные комплексы
Глава 8. Элементы Периодической системы Д.И. Менделеева: способность к образованию комплексов
8.1. Элементы s-секции
8.2. Элементы p-секции
8.3. Элементы d-секции
8.4. Лантаноиды и актиноиды
Скачать все slide презентации Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе одним архивом:
Похожие презентации
-
 Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач.
Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач. -
 Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах
Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах -
 Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева -
 Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ
Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ -
 Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений -
 Основные этапы развития химии комплексных соединений Лектор: канд. хим. наук, ст. преп. Камиль Абрарович Сагдеев
Основные этапы развития химии комплексных соединений Лектор: канд. хим. наук, ст. преп. Камиль Абрарович Сагдеев -
 ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ 1. Метод валентных связей (ВС). 2. Теория кристаллического поля (ТКП). 3. Метод мо
ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ 1. Метод валентных связей (ВС). 2. Теория кристаллического поля (ТКП). 3. Метод мо -
 Оксосоединения. Основные понятия
Оксосоединения. Основные понятия -
 Биогеохимия: основные понятия, история развития, практическое значение идей биогеохимии
Биогеохимия: основные понятия, история развития, практическое значение идей биогеохимии -
 Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды