Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
17 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
1.14 MB
Просмотров:
155
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
№2 слайд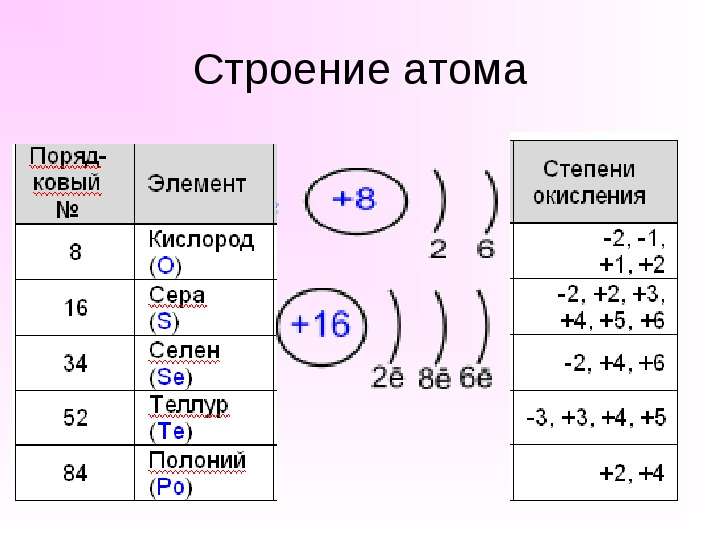
№3 слайд
Содержание слайда: Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.)
Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.)
Самый распространенный элемент на Земле; в воздухе - 21% по объему;
в земной коре - 49% по массе;
в гидросфере - 89% по массе;
в составе живых организмов-- до 65% по массе.
№4 слайд
Содержание слайда: Взаимодействие веществ с кислородом называется окислением.
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель.
№5 слайд
№6 слайд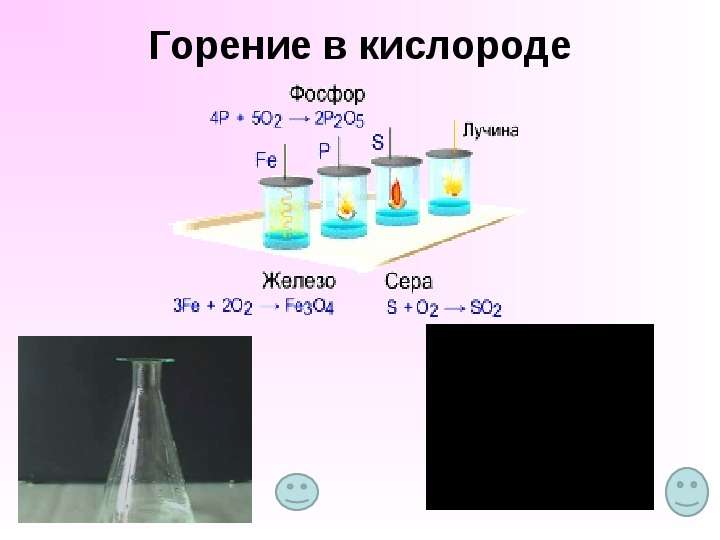
№7 слайд
Содержание слайда: Физические свойства - Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), tкип = 445С
Физические свойства - Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), tкип = 445С
Аллотропия
1)ромбическая (a - сера) - S8
tпл. = 113C; = 2,07 г/см3
Наиболее устойчивая модификация.
№8 слайд
Содержание слайда: 2) моноклинная (b - сера) - темно-желтые иглы
2) моноклинная (b - сера) - темно-желтые иглы
tпл. = 119C; = 1,96 г/см3
Устойчивая при температуре более 96С; при обычных условиях превращается в ромбическую.
3) пластическая - коричневая резиноподобная (аморфная) масса, неустойчива, при затвердевании превращается в ромбическую.
№9 слайд
№10 слайд
№11 слайд
Содержание слайда: Сероводород и сульфиды
Сероводород и сульфиды
H2S
Оксид серы (IV) SO2
Сернистая кислота H2SO3
Сульфиты и гидросульфиты
Na2SO3 NaHSO3
№12 слайд
Содержание слайда: H2SO4
H2SO4
№13 слайд
№14 слайд
Содержание слайда: Правила ТБ при работе с кислотами
Правила ТБ при работе с кислотами
Правила разбавления серной кислоты
№15 слайд
Содержание слайда: Серная кислота – сильный электролит, поэтому хорошо диссоциирует в воде на ионы и может образовывать два типа солей.
Серная кислота – сильный электролит, поэтому хорошо диссоциирует в воде на ионы и может образовывать два типа солей.
1 ст. H2SO4 → H + HSO4 гидросульфат ион
2-
2 ст. HSO4 → H + SO4 сульфат ион
+ 2-
H2SO4 → 2H + SO4
№16 слайд
Содержание слайда: С Металлами до Н
С Металлами до Н
С основными оксидами
С растворимыми основаниями
С нерастворимыми основаниями
С солями (качественные реакции на сульфат-анион SO4)
Составьте уравнения
реакций
в свете ТЭД
№17 слайд
Содержание слайда: http://www.1tv.ru/promovideo/9952
http://www.1tv.ru/promovideo/9952


























