Презентация Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3 онлайн
Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
30 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
405.90 kB
Просмотров:
92
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Лекция №3
Тема: «Алкены»
План:
1. Общая характеристика ,гомологический ряд, номенклатура ,изомерия.
2. Методы синтеза алкенов.
3. Физические свойства
4. Химические свойства:
а) реакция присоединения;
б)реакция окисления;
в) реакция полимеризации.
5.Отдельные представители алкенов.
№2 слайд
Содержание слайда: 1. Общая характеристика, гомологический ряд, номенклатура , изомерия.
Алкенами называются алифатические углеводороды, содержащие в молекуле двойную связь
С ═ С
Они относятся к группе непредельных углеводородов.
Общая формула гомологического ряда алкенов
(олефинов):
В молекуле алкена ненасыщенные атомы углерода
находятся в состоянии sp3 – гибридизации, двойная
связь между ними образована 1σ- и 1π-связями.
№3 слайд
№4 слайд
№5 слайд
Содержание слайда: Схема образования SP2-гибридных орбиталей (второе валентное состояние атома углерода С)
№6 слайд
Содержание слайда: Гомологический ряд алкенов
Этен C2H4
Пропен C3H6
н-бутен C4H8
н-пентен C5H10
н-гексен C6H12
н-гептен C7H14
н-октен C8H16
н-нонен C9H18
н-децен C10H20
№7 слайд
Содержание слайда: Номенклатура
1.Систематическая (международная) номенклатура
Выбираем цепочку с двойной связью.
Нумеруем с того конца, где ближе двойная связь.
Цифрой указываем номера углеродных атомов, где есть радикалы и называем их.
Называем всю цепочку, окончание –ан меняем на –ен.
В конце указываем номер углеродного атома, от которого начинается двойная связь.
1 2 3 4
СН2 ═ С - СН2 - СН3
│
СН3
2-метилбутен -1
№8 слайд
Содержание слайда: 2.Рациональная номенклатура
Выбираем 2 центральных атома, соединенных двойной
связью.
Отсекаем все связи, отходящие от центральных атомов.
Называем радикалы от младшего к старшему.
К названию радикалов добавляем слово «Этилен».
СН3 – С ═ СН – СН - СН3
│ │
СН3 СН3
Диметилизопропилэтилен
№9 слайд
Содержание слайда: Изомерия
Алкены, число атомов углерода в которых больше
двух, (т.е. кроме этилена) имеют изомеры.
Изомерия строения углеродного скелета:
1 2 3 4 5
№10 слайд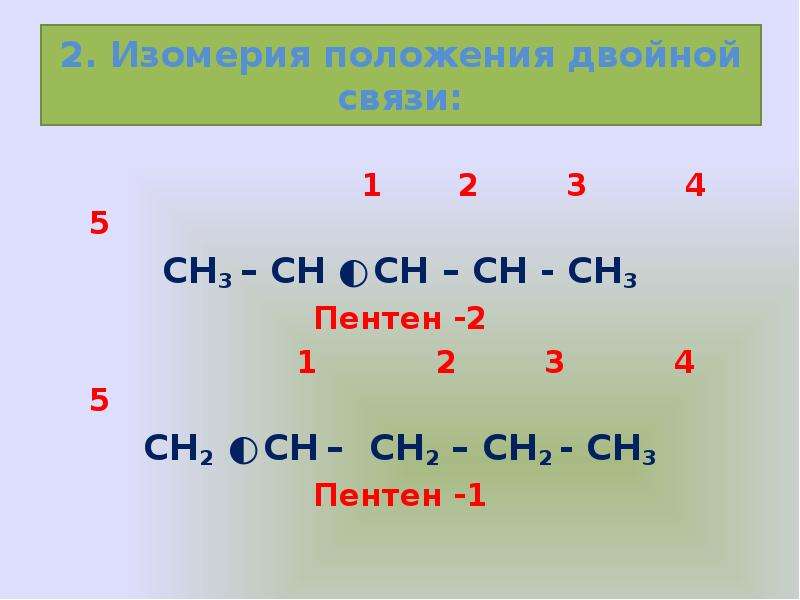
Содержание слайда: 2. Изомерия положения двойной связи:
1 2 3 4 5
СН3 – СН ═ СН – СН - СН3
Пентен -2
1 2 3 4 5
СН2 ═ СН – СН2 – СН2 - СН3
Пентен -1
№11 слайд
Содержание слайда: 3.Стереоизомерия
Стереоизомерия – изомерия расположения атомов
относительно двойной связи (пространственная).
Цис – и транс – изомеры не являются структурными изомерами,
т.к. они имеют одинаковую последовательность связей атомов,
а различаются только расположением атомов или групп в
пространстве.
Алкены, у которых хотя бы один атом
углерода, связанный двойной связью, имеет два
одинаковых заместителя, например 2-метилбутен – 1
СН2 ═ С - СН2 - СН3, не имеют цис- и транс – изомеров.
СН3
Цис- и транс – изомеры различаются по энергетическому
состоянию, по физико-химическим свойствам. Более устойчивы
– транс-изомеры.
№12 слайд
Содержание слайда: H H H CH3
| | | |
C = C C = C
| | | |
H3C CH3 H3C H
цис-бутен-2 транс-бутен-2
№13 слайд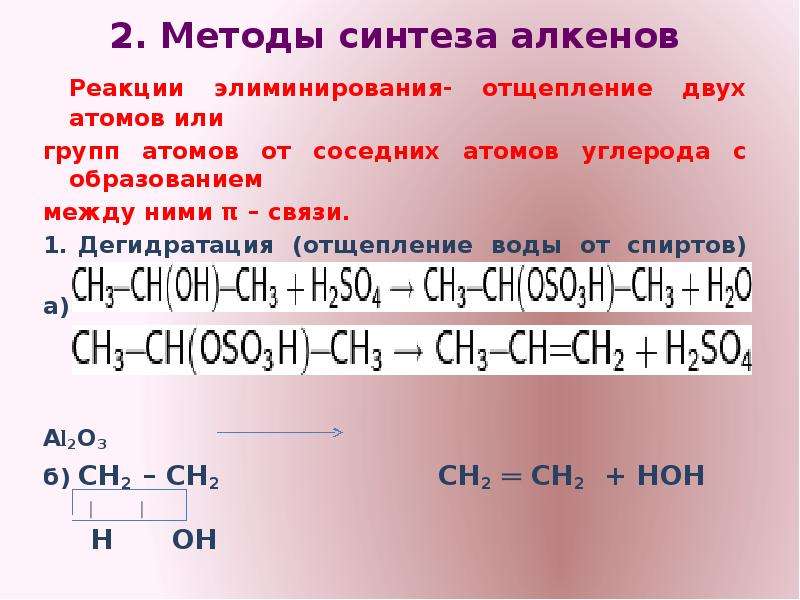
Содержание слайда: 2. Методы синтеза алкенов
Реакции элиминирования- отщепление двух атомов или
групп атомов от соседних атомов углерода с образованием
между ними π – связи.
Дегидратация (отщепление воды от спиртов) при температуре менее 150°C
а)
Аl2О3
б) СН2 – СН2 СН2 ═ СН2 + НОН
│ │
Н ОН
№14 слайд
№15 слайд
Содержание слайда: 2. Дегидрогалогенирование (отщепление галогеновдородов):
NаОН спирт. р-р
СН2 – СН2 СН2 ═ СН2 + НОН +NаСl
│ │
Н Сl
В случае нессиметричных молекул отщепление атома
водорода происходит от наименее гидрогенизированного атома
углерода по правилу Зайцева:
NаОН спирт. р-р
СН3 – СН – СН - СН 2 - СН3 СН3 – С ═ СН - СН2 - СН3
│ │ - NаВr, - НОН │
СН3 Вr СН3
№16 слайд
Содержание слайда: 3. Дегалогенирование ( отщепление галогена):
Zn
СН2 – СН2 СН2 ═ СН2 + Сl2
│ │
Сl Сl
4.Дегидрирование (отщепление водорода)
tº, Сr2О3
С4Н10 С4Н8 + Н2
№17 слайд
Содержание слайда: 3.Физические свойства
Низшие гомологи С2 –С4 при нормальных условиях – газы; С5-С17 – жидкости; высшие гомологи – твердые вещества.
Алкены нерастворимы в воде, но хорошо растворяются в органических растворителях.
№18 слайд
Содержание слайда: 4. Химические свойства
Химические свойства алкенов определяются
строением и свойствами двойной связи С=С,
которая значительно активнее других связей в
молекулах этих соединений. Поэтому для алкено
в наиболее характерны реакции, протекающие за счет
раскрытия менее прочной p -связи. При этом p -связь
(в исходном алкене) преобразуется в s -связь в
продукте реакции.
Исходное ненасыщенное соединение превращается в
насыщенное без образования других продуктов, то есть происходит реакция присоединения.
№19 слайд
Содержание слайда: а). Реакции присоединения.
Электронное облако π- связи подвергается атаке электрофильными реагентами.
Поэтому многие реакции алкенов протекают по механизму
электрофильного присоединения.
Гидрирование (восстановление):
tº = 150-300º, Ni
СН2 ═СН2 + Н2 СН3-СН3
2. Галогенирование:
СН2 ═СН2 + Вr2 СН2 - СН2 -
Вr Вr
качественная реакция на двойную связь
обесцвечивание бромной воды
№20 слайд
Содержание слайда: 3. Гидратация:
СН2 ═СН2 + Н2 О Н+ СН3 - СН2 - ОН
В реакциях несимметричных алкенов соблюдается
правило Марковникова.
Правило Морковникова: при присоединении молекул
типа НХ к несимметричным алкенам атом водо-
рода присоединяется к более гидрогенизировнному
атому углеводорода двойной связи, а остаток к
менее гидрогенизированному атому.
№21 слайд
Содержание слайда: 4. Гидрогалогенирование:
СН2 ═ СН - СН3 + НСl СН2 - СН - СН3
Н Сl
№22 слайд
№23 слайд
Содержание слайда: б). Реакции окисления
1. Окисление алкенов в мягких условиях (щелочная или нейтральная среда, холод, окислитель – КМnО4):
3СН2 ═ СН2 + 4Н2О + 2КМnО4 3СН2 - СН2 + 2КОН +2МnО2
ОН ОН коричневый
2. Окисление алкенов в жестких условиях (кислая среда, комнатная температура, окислитель - КМnО4 ):
а)СН2 ═ СН2+4Н2SО4+2КМnО4 2СО2+6Н2О+К2SО4+2МnSО4
б)СН3-СН ═ СН-СН3+Н2SО4+2КМnО4 СН3- СООН +3Н2О
+К2SО4+2МnSО4
№24 слайд
№25 слайд
№26 слайд
Содержание слайда: в). Реакции полимеризации
Реакции полимеризации – это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного соединения полимера. Молекулы алкена, вступающие в реакцию полимеризации называются мономерами. Полимеризация цепная реакция.
№27 слайд
Содержание слайда: 5. Отдельные предствители
1.С2Н4 – этилен- газ со слабым чесночным запахом, горит, образуя копоть, мало растворим в воде, Смесь этилена с воздухом используют для наркоза, обладает раздражающим и мутагенным действием Используется для синтеза этилового спирта , уксусного альдегида, уксусной кислоты, плиэтилена.
№28 слайд
Содержание слайда: 2.Пропен (пропилен) — вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие.
3.Бутен-2 — вызывает наркоз, обладает раздражающим действием.
№29 слайд
Содержание слайда: 4. Полиэтилен – получают полимеризацией этилена. Представляет собой бесцветный материал, имеющий низкую тепло- и электропроводность. Широко используется в быту и технике в виде посуды , плёнок, в медицинской промышленности.
5. Полипропилен – получают полимеризацией пропилена . Представляет собой твёрдый прозрачный материал. Используется для изготовления труб, деталей аппаратуры, особо прочной изоляции.
№30 слайд
Содержание слайда: С6Н5
6. Полистирол - (-СН2-СН-)n - используется для
изготовления игрушек, изоляции труб, предметов
домашнего обихода.
7. Фторопласт - полимеры из фторированного этилента. Чрезвычайно химически инертны. На них не действуют конц. Кислоты, сильные окислители, органические растворители. Они выдерживают нагревание до 300ºС . Фторопласты используются для изготовления коррозионной химической аппаратуры. Широкое применение получили покрытия фторопластом (тефлоном) бытовых изделий.







































