Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
22 слайда
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
3.68 MB
Просмотров:
55
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
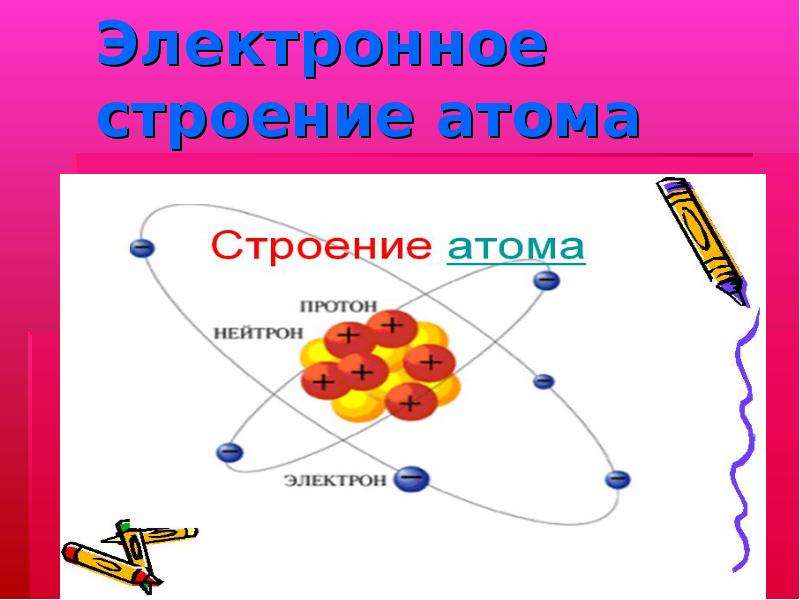
Содержание слайда: Электронное строение атома
The electronic structure of the atom
№2 слайд
Содержание слайда: Положение электронов в ядре
(The position of the electrons in the nucleus)
Стационарные орбиты в настоящее время называют уровнями
Уровни нумеруются от ядра как целые числа
Уровни состоят из подуровней
На каждом подуровне может быть несколько орбиталей
Орбиталь – это зона атома, где теоретически может находится один электрон
Из всех орбиталей и электронов на них состоит зона электронной плотности или электронное облако атома
№3 слайд
Содержание слайда: Орбиталь
s-орбиталь сферической формы
р-орбиталь – вытянутые восьмерки (гантелеобразная форма)
d-орбиталь
f-орбиталь
№4 слайд
Содержание слайда: Электронная модель атома Шредингера
(The electronic model of the atom
E. Schrodinger)
№5 слайд
Содержание слайда: Квантовые числа
В атоме нет ни одного электрона с одинаковым набором квантовых чисел
In the atom there is no electron with the same set of quantum numbers
№6 слайд
Содержание слайда: Матрица для написания электронной диаграммы атома
(The matrix for writing electronic
diagram of an atom)
№7 слайд
Содержание слайда: Пример построения орбитальной диаграммы
(Вариант I)
№8 слайд
Содержание слайда: Матрица для написания электронной диаграммы атома
(Вариант II)
№9 слайд
№10 слайд
Содержание слайда: Примеры записи электронной формулы и орбитальных диаграмм для некоторых элементов
Examples of recording electronic formula and orbital diagrams for some elements
№11 слайд
Содержание слайда: Матрица для записи характеристики электрона
с помощью квантовых чисел
(Matrix for recording the quantum characteristics of electrons)
№12 слайд
Содержание слайда: Таблица квантовых чисел
№13 слайд
Содержание слайда: Таблица квантовых чисел
или
энергетическая характеристика электронов в атоме
(Table of quantum numbers or energy characteristics of electrons in the atom)
№14 слайд
Содержание слайда: Порядок заполнения электронных орбиталей можно взять из длинной формы Периодической Таблицы
(The order of filling of electronic orbitals can be taken from the long form of the Periodic Table)
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, ...
№15 слайд
Содержание слайда: Полный вариант длинной формы Периодической таблицы.
Этот вариант наиболее удобен для изучения распределения электронов в атоме и классификации элементов на основании строения последнего электронного уровня.
Full version the long form of the Periodic table. This option is most convenient to study the distribution of electrons in the atom, classification elements based on electronic structure the last level.
№16 слайд
Содержание слайда: Основные правила заполнения электронами электронных уровней
На одной орбитали не может находится одновременно больше двух электронов (Правило Паули)
Электроны заполняют свои орбитали вначале по одиночке, а только потом образуют пары (Правило Гунда)
Принцип минимума энергии: при заполнении электронных оболочек в первую очередь заполняются оболочки с минимальной энергией (ближайшие к ядру уровни и подуровни)
Правило «октета - дублета»Все атомы стремятся к завершению своего внешнего уровня до двух или восьми электронов.
Правило Клечковского – Меделунга. Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел . При одинаковой сумме раньше заполняется орбиталь с меньшим значением .
№17 слайд
Содержание слайда: Как электроны характеризуют элементы?
(As the electrons characterize the elements?)
Элементы называют по последнему подуровню , который они заполняют:
s-элементы,
p-элементы,
d-элементы,
f-элементы
А их последние электроны называют:
s-электроны,
p-электроны,
d-электроны,
f-электроны
Внешним уровнем атома называют самый далекий от ядра уровень на котором есть электроны
Завершенным уровнем называется уровень на котором находится полный комплект электронов. Это значит у этого уровня максимально заполнены все орбитали
№18 слайд
Содержание слайда: Орбитальная диаграмма атома Азота
№19 слайд
№20 слайд
№21 слайд
№22 слайд