Презентация Студент это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович онлайн
Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
75 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
3.99 MB
Просмотров:
50
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Студент − это не сосуд, который надо
наполнить, а факел, который надо зажечь
Л. Арцимович
№2 слайд
Содержание слайда: Фенолы
№3 слайд
Содержание слайда: Номенклатура
№4 слайд
Содержание слайда: Способы получения фенола
Сплавлением натриевой соли бензолсульфокислоты с гидроксидом натрия
PhSO3Na + NaOH
PhONa + NaHSO3
№5 слайд
Содержание слайда: Способы получения фенола
Гидролиз галогенсодержащих бензолов
№6 слайд
Содержание слайда: Способы получения фенола
Из солей диазония
[Ph-N+N]Cl + Н2О
PhOH + N2 + НCl
Из бензола
C6H6 + N2O PhOH + N2
№7 слайд
Содержание слайда: Способы получения фенола
Кумольный метод
№8 слайд
Содержание слайда: Кислотность
№9 слайд
Содержание слайда: Свойства фенолов
№10 слайд
Содержание слайда: Реакция Вильямсона
№11 слайд
Содержание слайда: Образование сложных эфиров
№12 слайд
Содержание слайда: Свойства фенолов
Фенольные соединения взаимодействуют с хлоридом железа (III) и образуют характерные цветные комплексы (качественная реакция)
№13 слайд
Содержание слайда: Свойства фенолов
фенол окрашивает в красно-фиолетовый цвет, крезол - в синий, резорцин - в темно-фиолетовый
№14 слайд
Содержание слайда: Фенолы
Электрофильное замещение в ароматическом ядре
№15 слайд
Содержание слайда: Галогенирование
№16 слайд
Содержание слайда: Галогенирование
№17 слайд
Содержание слайда: Нитрование
№18 слайд
Содержание слайда: Сульфирование
№19 слайд
Содержание слайда: Ипсо-замещение сульфогруппы
№20 слайд
Содержание слайда: Нитрозирование
№21 слайд
Содержание слайда: С-алкилирование и
С-ацилирование
№22 слайд
Содержание слайда: Синтез фенолфталеина
№23 слайд
Содержание слайда: Перегруппировка Фриса
№24 слайд
Содержание слайда: Перегруппировка Кляйзена
№25 слайд
Содержание слайда: Сочетание с солями диазония
№26 слайд
Содержание слайда: Реакция Кольбе-Шмитта
№27 слайд
Содержание слайда: Фенолформальдегидные смолы
№28 слайд
Содержание слайда: Бисфенол А
№29 слайд
Содержание слайда: Реакция Реимера-Тимана
№30 слайд
Содержание слайда: Формилирование по Вильсмайеру
№31 слайд
Содержание слайда: Окисление
№32 слайд
Содержание слайда: Окисление
Пространственно затрудненных фенолов до феноксильных (ароксильных) радикалов осуществляется под действием гексацианоферрата (III) калия в бинарной системе бензол-вода, диоксида свинца PbO2, оксида серебра или другого одноэлектронного окислителя в индифферентной среде, а также электрохимически
№33 слайд
Содержание слайда: Антиоксиданты
№34 слайд
Содержание слайда: Хиноловые эфиры
№35 слайд
Содержание слайда: Восстановление
№36 слайд
Содержание слайда: Защита функциональных групп в органическом синтезе
№37 слайд
Содержание слайда: Использование защитных групп в синтезе
В многостадийном синтезе, как правило, приходится иметь дело с полифункциональными соединениями
№38 слайд
Содержание слайда: Использование защитных групп в синтезе
Многие из функциональных групп должны сохраниться в неизменном виде в целевом соединении
Цель защиты функциональных групп в синтезе – предотвращение их превращений в условиях проведения реакций
№39 слайд
Содержание слайда: Использование защитных групп в синтезе
При этом возникают проблемы:
1) Не все функциональные группы совместимы в одной молекуле
(нельзя получить магний- или литийорганическое соединение, содержащее в молекуле карбонильную функцию и т.д.)
№40 слайд
Содержание слайда: Использование защитных групп в синтезе
№41 слайд
Содержание слайда: Использование защитных групп в синтезе
При этом возникают проблемы:
2) Один и тот же реагент может взаимодействовать с разными функциональными группами
№42 слайд
Содержание слайда: Использование защитных групп в синтезе
В рассмотренных ситуациях используют избирательную блокаду тех или иных функциональных групп, создавая так называемые защитные группы, маскирующие данную функцию
№43 слайд
Содержание слайда: Использование защитных групп в синтезе
Реакция Кневенагеля между ванилином и малоновой кислотой осложняется другими реакциями, связанными с наличием фенольной ОН-группы
С6Н5СНО + СН2(СООС2Н5)2
С6Н5СН=С(СООС2Н5)2 + Н2О
№44 слайд
Содержание слайда: Использование защитных групп в синтезе
ОН-группу ванилина блокируют, "защищают"
№45 слайд
Содержание слайда: Использование защитных групп в синтезе
Задача использования защитных групп включает два момента: создание защитной группы и удаление, после проведения необходимых изменений в молекуле
Одну и ту же функциональную группу можно защитить различными способами
№46 слайд
Содержание слайда: Способы создания и удаления защитных групп для спиртов
№47 слайд
Содержание слайда: Использование защитных групп в синтезе
Конкретную защитную группу выбирают с учетом реагентов и условий реакции так, чтобы в этих условиях защитная группа не разрушалась
№48 слайд
Содержание слайда: Использование защитных групп в синтезе
Группа ТНР устойчива в щелочных условиях (рН 6-12), но неустойчива к водным растворам кислот и к кислотам Льюиса
ТНР группа относительно устойчива к действию нуклеофилов и металлоорганических соединений, к гидридам, гидрированию и действию окислителей
№49 слайд
Содержание слайда: Использование защитных групп в синтезе
Одной из наиболее популярных защитных групп для спиртов является трет-бутилдиметилсилильная (TBDMS) группа
№50 слайд
Содержание слайда: Использование защитных групп в синтезе
Эфиры спиртов с этой группой устойчивы к действию многих реагентов, причем защитная группа легко удаляется в условиях, не затрагивающих другие функциональные группы
TBDMS защита приблизительно в 104 раз более устойчива к гидролизу, чем триметилсилильная (TMS) защита
№51 слайд
Содержание слайда: Использование защитных групп в синтезе
Сейчас выработаны определенные стратегии, позволяющие использовать защиту различных групп в процессе данного синтеза
Защитные группы в органической химии, ред. Дж.МакОми, М., Мир, 1976
P.G.M.Wuts, T.W.Green, Protective Groups in Organic Synthesis, 3nd ed., Wiley, N.-Y., 1999
№52 слайд
Содержание слайда: Использование защитных групп в синтезе
В настоящее время выделяют две основные стратегические линии при использовании защитных групп:
а) принцип «ортогональной стабильности»
б) принцип "модулированной лабильности"
№53 слайд
Содержание слайда: Использование защитных групп в синтезе
Эти принципы относятся к тем случаям, когда в процессе синтеза одновременно используются несколько различных защитных групп
№54 слайд
Содержание слайда: Принцип ортогональной стабильности
Требует, чтобы каждая из используемых защитных групп удалялась в таких условиях, в которых остальные защитные группы остаются без изменений (в качестве примера можно привести сочетание тетрагидропиранильной, бензоильной и бензильной групп)
№55 слайд
Содержание слайда: Принцип ортогональной стабильности
№56 слайд
Содержание слайда: Принцип ортогональной стабильности
При таком подходе данную защитную группу можно удалить на любой стадии синтеза
№57 слайд
Содержание слайда: Принцип модулированной лабильности
Принцип модулированной лабильности подразумевает, что все используемые защитные группы удаляются в сходных условиях, но с различной легкостью
№58 слайд
Содержание слайда: Принцип модулированной лабильности
При этом наименее кислотно-чувствительную метоксиметильную защитную группу нельзя удалить, не затронув остальные защитные группы
№59 слайд
Содержание слайда: Использование защитных групп в синтезе
В настоящее время в арсенале химика-синтетика имеется большое число различных защитных групп
Однако, синтез надо стремиться планировать так, чтобы обойтись либо совсем без защитных групп, либо свести их применение к минимуму
№60 слайд
Содержание слайда: Использование защитных групп в синтезе
"The best protecting group is no protecting group"
("Самая лучшая защитная группа - отсутствие защитной группы")
№61 слайд
Содержание слайда: Использование защитных групп в синтезе
Использование защитных групп в синтезе требует дополнительных операций (удлиняет и удорожает синтез)
Применение защитных групп, как правило, отрицательно сказывается на выходе целевого продукта
№62 слайд
Содержание слайда: Защитные группы
(некоторые примеры)
№63 слайд
Содержание слайда: Гидроксильная группа
Один из способов защиты гидроксильной группы
№64 слайд
Содержание слайда: Гидроксильная группа
Способ защиты
Образование сложных эфиров RCOOR’
Действуют R’COCl и пиридин
Защита устойчива к электрофилам, окислению
Удаление защитной группы
NH3 и MeOH
№65 слайд
Содержание слайда: Амины RNH2
Амиды RNHCOR’, Уретаны RNHCOOR’, Фталимиды
Действуют R’COCl, Хлорформиаты R’OC(O)Cl, Фталевый ангидрид
Защита устойчива к электрофилам
Удаление защитной группы HO--H2O или H+-H2O, для R’= CH2Ph: H2(кат.) или HBr, для R’= t-Bu: H+, NH2NH2
№66 слайд
Содержание слайда: Аминогруппа
Защитная группа
Снятие защиты
№67 слайд
Содержание слайда: Аминогруппа
Бензилоксикарбонильная группа
№68 слайд
Содержание слайда: Альдегиды RCHO
Ацеталь RCH(OR’)2 (1,3-диоксолан)
Действуют R’OH, H+
или HOCH2CH2OH, H+
Защита устойчива к нуклеофилам, основаниям, восстановителям
Удаление защитной группы
H+, H2O
№69 слайд
Содержание слайда: Кетоны R2CO
Кеталь R2C(OR’)2 1,3-диоксолан
Действуют R’OH, H+
или HOCH2CH2OH, H+
Защита устойчива к нуклеофилам, основаниям, восстановителям
Удаление защитной группы
H+, H2O
№70 слайд
Содержание слайда: Кислоты RCOOH
Сложные эфиры: RCOOMe, RCOOEt
RCOOCH2Ph, RCOOBu-t, RCOOCH2CCl3
Действуют CH2N2, EtOH и H+
PhCH2OH и H+
H+ и t-BuOH, СCl3CH2OH
Защита устойчива к слабым основаниям, электрофилам
Удаление защитной группы HO- и H2O,
H2(кат.) или HBr, H+, Zn и MeOH
№71 слайд
Содержание слайда: Фенолы ArOH
Простые метиловые эфиры или метоксиметиловые эфиры
Действуют Me2SO4 и K2CO3, MeOCH2Cl и основание
Защита устойчива к основаниям и слабым электрофилам
Удаление защитной группы HI и HBr или BBr3, CH3COOH-H2O
№72 слайд
Содержание слайда: Тиолы RSH
Защитная группа AcSR
Действуют RSH+AcCl+основание
Защита устойчива к электрофилам
Удаление защитной группы
HO--H2O
№73 слайд
Содержание слайда: Защита положений ароматического кольца
ArNH2 + NaNO2 + 2 HCl ArN+NCl- + NaCl + 2 H2O
№74 слайд
Содержание слайда: Пример
№75 слайд










 Студент это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович
Студент это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович БИОГЕННЫЕ S–ЭЛЕМЕНТЫ s-Элементы – это элементы, в атомах которых заполняется электронами s-подуровень внешнего электронного уров
БИОГЕННЫЕ S–ЭЛЕМЕНТЫ s-Элементы – это элементы, в атомах которых заполняется электронами s-подуровень внешнего электронного уров НЕМЕТАЛЛЫ Все, что я познаю, я знаю, для чего это мне надо и где и как я могу эти знания применить. Найти разумный баланс между
НЕМЕТАЛЛЫ Все, что я познаю, я знаю, для чего это мне надо и где и как я могу эти знания применить. Найти разумный баланс между Углеводы, их классификация и строение Углеводы – это органические вещества, молекулы которых состоят из атомов углерода, водород
Углеводы, их классификация и строение Углеводы – это органические вещества, молекулы которых состоят из атомов углерода, водород Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова От греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой
От греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро
Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро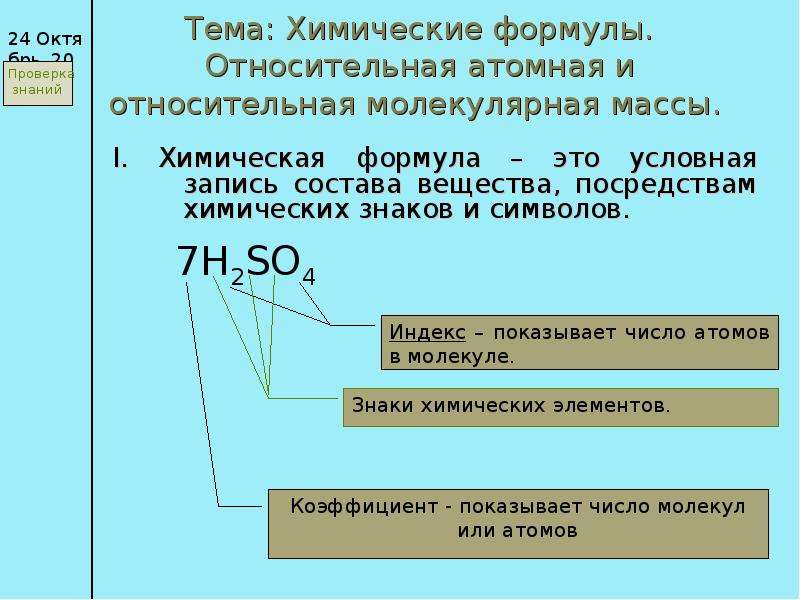 Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с
Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с Актуальность Все химические процессы, протекающие в живых организмах, контролируются ферментами. Поэтому они играют в
Актуальность Все химические процессы, протекающие в живых организмах, контролируются ферментами. Поэтому они играют в




































































