Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
31 слайд
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
3.18 MB
Просмотров:
126
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Химия элементов. Лекция 1
Общая характеристика элементов IVA-группы. Углерод и кремний
№2 слайд
Содержание слайда: Элементы IVА-группы
№3 слайд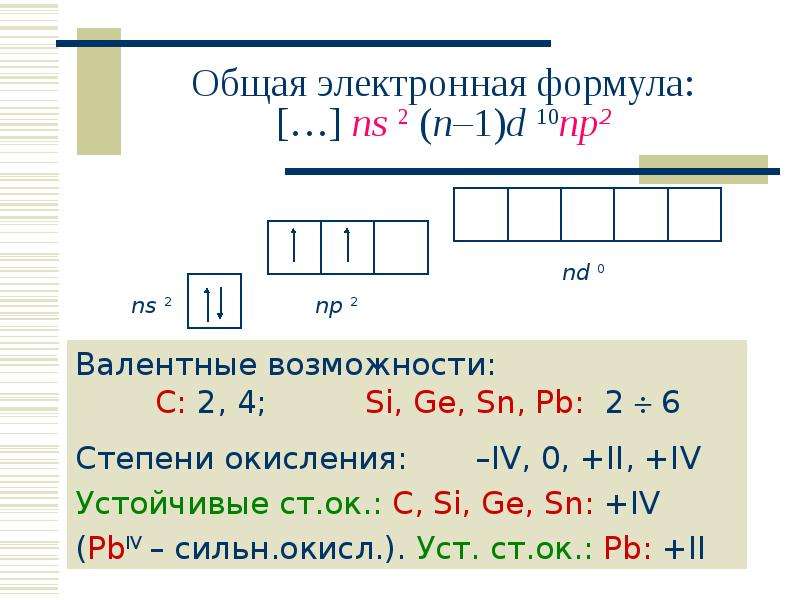
Содержание слайда: Общая электронная формула:
[…] ns 2 (n–1)d 10np2
Валентные возможности: С: 2, 4; Si, Ge, Sn, Pb: 2 6
№4 слайд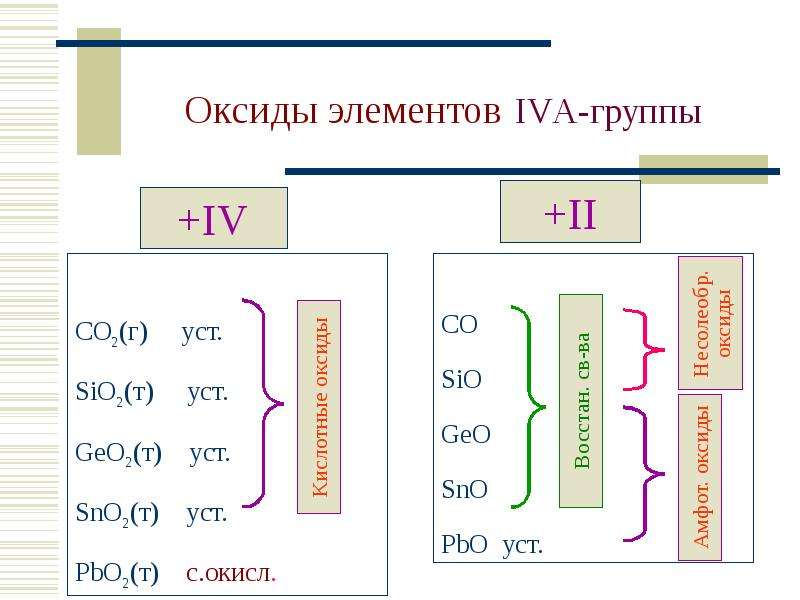
Содержание слайда: Оксиды элементов IVА-группы
№5 слайд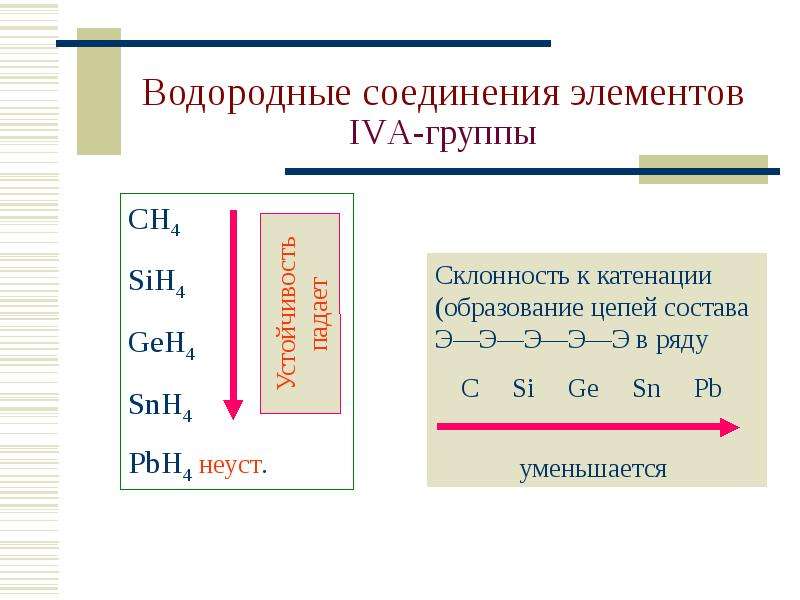
Содержание слайда: Водородные соединения элементов IVА-группы
№6 слайд
Содержание слайда: Простые вещества
Аллотропия
Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен.
Олово «белое» и «серое».
№7 слайд
Содержание слайда: Химические свойства
При комн. темп.
С, Si, Ge + H2O
С, Si, Ge + H3O+
Sn, Pb + H2O
Sn + H3O+ Sn2+ + H2
Pb + H3O+ Pb2+ + H2
№8 слайд
Содержание слайда: Химические свойства
С(т) + KOH
Si + 4NaOH = Na4SiO4 + 2H2
Si + 8OH– –4e – = SiO44– + 4H2O
2H2O + 2e – = H2 + 2OH–
Ge + 2KOH + 2H2O2 = K2[Ge(OH)6]
Ge + 6OH– –4e – = [Ge(OH)6]2–
H2O2 + 2e – = 2OH–
Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2
Sn + 3OH– –2e – = [Sn(OH)3]–
2H2O + 2e – = H2 + 2OH–
№9 слайд
Содержание слайда: Простые вещества
№10 слайд
Содержание слайда: Распространение в природе и важнейшие минералы
2. Si 25,80%
(27,72% в литосфере)
13. C 0,087%
(0,032% в литосфере)
31. Sn 0,0035%
35. Pb 0,0018%
46. Ge 6 ·10–4% (РРЭ)
№11 слайд
Содержание слайда: Углерод: графит, алмаз, каменный уголь, нефть, природный газ, орг. в-ва, карбонаты
№12 слайд
Содержание слайда: Германий, олово и свинец
№13 слайд
Содержание слайда: Шкала степеней окисления углерода
№14 слайд
Содержание слайда: Графит
Т. пл. 3800 С, т. кип. 4000 С, плотность 2,27 г/см3, электропроводен, устойчив.
Типичный восст-ль (реагирует с водородом, кислородом, фтором, серой, металлами).
Кристаллическая решетка слоистая (sp2-гибридизация).
№15 слайд
Содержание слайда: Алмаз
Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515 г/см3.
Крист. решетка атомная (sp3-гибридизация).
Выше 1200 С переходит в графит.
При прокаливании на воздухе сгорает.
№16 слайд
Содержание слайда: Карбин и фуллерен
Карбин: линейные макромолекулы (С2)n, бесцветен и прозрачен, полупроводник; плотность 3,27 г/см3; выше 2300 С переходит в графит.
№17 слайд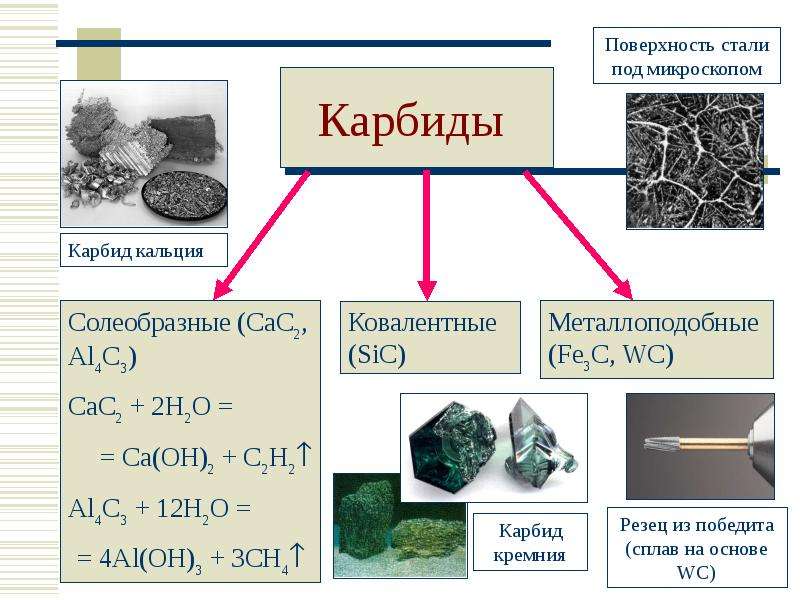
Содержание слайда: Карбиды
№18 слайд
Содержание слайда: Водородные соединения. Метан CH4
СН4 – газ без цвета и запаха, горюч, главная сост. часть природного газа.
Получение в лаборатории:
CH3COONa + NaOH (+t) =
= Na2CO3 + CH4
Горение:
CH4 + O2 = С + 2H2O
CH4 + 2O2 (изб.) =
= СO2 + 2H2O
№19 слайд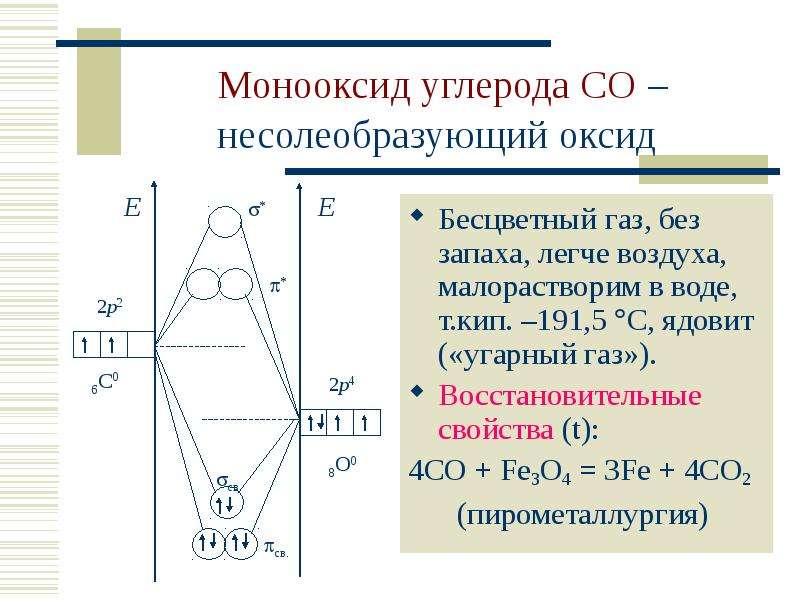
Содержание слайда: Монооксид углерода CO – несолеобразующий оксид
Бесцветный газ, без запаха, легче воздуха, малорастворим в воде, т.кип. –191,5 С, ядовит («угарный газ»).
Восстановительные свойства (t):
4CO + Fe3O4 = 3Fe + 4CO2
(пирометаллургия)
№20 слайд
Содержание слайда: Монооксид углерода CO
Донорные свойства:
CO образует прочные комплексы, например [Fe(CO)5].
№21 слайд
Содержание слайда: Диоксид углерода CO2 (кислотный оксид)
Бесцветный газ, без запаха, тяжелее воздуха, умеренно растворим в воде (при комн. т-ре в 1 л воды – около 1,7 л CO2).
В тв. сост. («сухой лёд») – молекулярная крист. решетка; т. возгонки –78 С, т.пл. –57 С (р = 5 атм).
№22 слайд
Содержание слайда: Моногидрат CO2 . H2O и угольная кислота H2CO3
В водном растворе:
CO2 (г) + H2O CO2 . H2O H2CO3
H2CO3 – слабая двухосновная кислота:
H2CO3 + H2O HCO3– + H3O+ ; KK = 4,27 · 10–7
HCO3– + H2O CO32– + H3O+ ; KK = 4,68 · 10–11
№23 слайд
Содержание слайда: Строение: sp2-гибридизация
№24 слайд
Содержание слайда: Карбамид и цианамид
Синтез карбамида:
NH4NCO (NH2)2CO (+t)
(Фридрих Вёлер, 1828 г.)
№25 слайд
Содержание слайда: Псевдогалогениды
Циановодород HCN – бесцв.ж., т. пл. –13,3 С, т.кип. +25,6С).
В водн. р-ре – слабая «синильная кислота»:
HCN + H2O CN– + H3O+; KK = 4,93 · 10–10
Цианид-ион CN : донорные св-ва, образует прочные комплексы, ядовит.
№26 слайд
Содержание слайда: Псевдогалогениды
Тиоцианат водорода HNCS («родановодород») не ядовит.
В водном растворе HNCS - сильная к-та
Ион NCS : слабые донорные свойства
№27 слайд
Содержание слайда: Кремний
Химическое растворение
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O
Si + 4NaOH = Na4SiO4 + 2H2
Получение кремния
SiO2 + 2Mg = 2MgO + Si
SiCl4 + 2H2 = Si + 4HCl (кремний ос.ч.)
№28 слайд
Содержание слайда: Водородные соединения SinH2n+2 (силаны)
Моносилан SiH4:
SiH4 + 2O2 = SiO2 + 2H2O
Получение силанов:
SiO2 + 4Mg(изб) = Mg2Si + 2MgO
(силицид магния)
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4
Mg2Si + 4H3O+ = 2Mg2+ + 4H2O + SiH4
№29 слайд
Содержание слайда: Кислородные соединения
Полиморфизм диоксида кремния:
№30 слайд
Содержание слайда: Травление стекла
SiO2 + 4HF = SiF4 + 2H2O
SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода)
№31 слайд
Содержание слайда: При подкислении водных растворов силикатов и германатов








































